基本介紹
- 中文名:四面體構型
- 外文名:tetrahedral configuration
- 化合物代表:甲烷
- 分類:立體結構化學
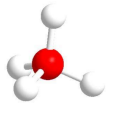
四面體構型是指一分子中的中心原子和四個原子鍵結,四個原子形成四面體4個頂點的分子構型。若和中心原子鍵結的4個原子都是同一種原子(例如甲烷CH4),則其鍵角為109.5°。周期表中有許多元素的化合物都是四面體形分子構型,理...
四面體形分子構型是指一分子中的中心原子和四個原子鍵結,四個原子形成四面體的四個頂點的分子構型。若和中心原子鍵結的四個原子都是同一種原子(例如甲烷CH4),則其鍵角為cos−1(−1/3)≈109.5°。。周期表中有許多元素的化合物都是四面體形分子構型,理想分子有Td的對稱群,但大部份四面體形構型分子的...
費歇爾投影式用兩條交叉的線表示含碳化合物的四面體結構,相當於將球棍模型或透視式的3D結構分子經過扁平化,如此便可於紙平面上比較旋光異構體分子中的原子或基團在空間上的排列方式。研究簡史 四面體構型 對於對映異構現象,一般的平面結構式如乳酸的分子式CH3CH(OH)COOH,無法表示它的基團在空間的相對位置。最開始...
電子構型的過渡金屬離子或原子配位時可形成四面體構型配合物。而 組態的過渡金屬離子或原子一般是形成平面正方形配合物。但具有 組態的金屬若因原子太小,成配位體原子太大,以致不可能形成平面正方形時,也可能形成四面體的構型。六配體 八面體是最常見的構型。這是最普遍且最重要的配位數。通常是相當於6個配位原子...
sp3雜化,是指同一原子內由1個ns軌道和3個np軌道參與的雜化,所形成的4個雜化軌道稱sp³雜化軌道。各含有1/4的s成分和3/4的p成分,雜化軌道間的夾角為109°28',空間構型為正四面體。sp³軌道雜化是基於軌道雜化理論的一個重要分支,是一種比較常見的軌道雜化方式。雜化過程 sp³雜化一般發生在分子形成過程...
通過這些類型的鍵把原子按一定的空間排列結合成分子,形成分子的構型和構象。例如碳是共享電子對鍵(共價鍵)的基本參加者,碳和氫2 種元素的原子可形成烴類化合物,正四面體構的CH4是其中最簡單的烴,還可形成環狀化合物,例如環己烷;矽和氧是礦物質的基本元素,雲母和石英都含有矽氧單元 。金屬原子被夾在烴環...
簡稱三氟硫氮。一種穩定的無色氣體,並且是製備其他硫-氮-氟化合物的重要前體。空間構型為四面體,硫原子在中心,含有硫氮三鍵。英文名為Thiazyltrifluoride。其他信息 SMILES:FS(F)(F)#N InChI:1/F3NS/c1-5(2,3)4 InChIKey:UQUPGRNSXINWBS-UHFFFAOYAR ChEBI:30507 LogP:1.92388 理化性質 NSF₃在...
四面體N 即R₄N⁺也可成為手性中心,叔胺分子無對稱性,似乎應有旋光性,但由於傘效應,易於翻轉,每秒翻轉2.3×1010次,翻轉能壘很低,外消旋化了。但如果N在環上橋頭位置時,就不能翻轉了。其他元素P,As也可成為四面體構型,成為手性中心。化合物 四面體C上具有四個不同的取代基時,成為手性碳。(四個...
O₄的預計構型為正四面體或者矩形,從兩種構型中性分子O₄,正一價分子O₄⁺和負一價分子O₄⁻的基態電子結構,並根據能量最低原則確定了各自的結構參數,從而得到了O₄分子2種結構的基態總能量、一價電離能及電子親合勢能.與氧原子、普通氧分子O₂和臭氧分子O₃的計算結果比較,顯示O₄分子可以以正...
立體構型:正四面體型,與甲烷互為等電子體。 定義:是由氨分子衍生出的正價離子。氨分子得到一個質子就形成銨離子。由於化學性質類似於金屬離子,故命名為“銨”,屬於原子團。 銨根遇大量氫氧根(OH-)易生成氨氣(NH3)和水: 銨鹽一般為易溶於水的白色晶體,可用做肥料。 銨鹽的性質 播報 編輯 銨鹽皆為晶體,易溶於...
②四配位磷化合物。為sp3雜化的四面體構型,包括季鏻離子R4P+和形式上是五價的磷醯基化合物X3PO。這類化合物的PO鍵穩定性很高。四配位磷化合物的旋光異構體較易拆分。③五配位磷化合物。為sp3d雜化的三角雙錐(六面體)構型,例如磷烷:五配位磷有機化合物具有一系列的分子重組特性,很多四配位磷有機化合物在反應...
螺槳烷是一類三環有機化合物,三個環共用一個碳碳共價鍵。它們的特徵包括:有碳為反向四面體構型、空間張力很大以及反應活性很高,因此在有機化學中被廣泛研究。此類化合物是因為其形狀類似螺旋槳而得名。最簡單的螺槳烷是[1.1.1]螺槳烷和[2.2.2]螺槳烷。1,3-去氫金剛烷既是金剛烷家族中的一員,也是[...
船式構象和椅式構象,按照碳原子具有正四面體構型的學說,環己烷分子中的六個碳原子在鍵角(109.5°)保持不變的情況下,可以兩種不同的空間形式,組成六元環,稱為環己烷的船式構象和椅式構象。術語簡介 根據現代分子結構理論,由於基團的相互作用的緣故,椅式構象比船式構象穩定得多,常溫下環己烷幾乎完全是椅式...
若構型不同的手性原子處在鏈末端,則這兩個異構體又稱為“端基差向異構體”。其他情況下,可分別用“Cn差向異構體”標明,n為不對稱原子的位置編號,C也可以是其他四面體構型的原子。舉例 α-D-吡喃葡萄糖與β-D-吡喃葡萄糖 β-D-吡喃葡萄糖與β-D-吡喃甘露 與葡萄糖互為差向異構體的有:甘露糖(C2),...
sp3雜化 四面體構型 四配位數 金剛石、CH4、烷C sp2雜化 平面三角型 三配位數 石墨、CO32-、C6H6、烯C sp 雜化 直線型 二配位數 CO2、CS2、炔C 2-1金剛石和石墨 ⒈金剛石 金剛石中C原子均採取sp3雜化,每個C原子以4個sp3雜化軌道與其它C原子相連形成4個σ鍵。金剛石是無色透明的晶體(晶格屬於原子晶格...
端基差向異構體:若構型不同的手性原子處在鏈末端,則這兩個異構體又稱為“端基差向異構體”。其他情況下,可分別用“Cn差向異構體”標明,n為不對稱原子的位置編號,C也可以是其他四面體構型的原子。簡介 端基差向異構一般存在於糖類中,是差向異構的一種。端基差向異構一般存在於糖類中,是差向異構的一種...
Hg2+形成配合物的傾向較小。而Hg2+易和Cl-、Br-、 I-、CN-、 SCN-等形成穩定的配離子,配位數一般為2或4,配位數為4的配合物為四面體構型。反應舉例 例如:Hg2+與I-反應,生成紅色HgI2沉澱,在過量I-作用下,HgI2又溶解生成[HgI4]2-配離子:Hg2+ + 2I- = HgI2↓ (紅色)HgI2 + 2I- = [HgI4]2...
