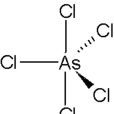
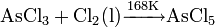化學結構
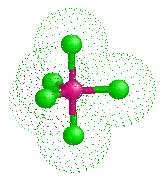 五氯化砷
五氯化砷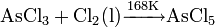
製法與性質
該反應的機理是,氯分子在紫外線照射下
均裂成活性氯原子,它與三氯化砷分子結合成五氯化砷。在低溫下,五氯化砷沒有足夠的能量使自身再次分解成三氯化砷和氯。
從1834年第一次試圖合成到1976年最終合成,竟然經歷了漫長的140多年。而同主族的
五氯化磷、
五氯化銻早已合成。五氯化砷可溶於
二硫化碳、
乙醚,它的化學性質很不穩定,在−50°C以上就會分解。固態五氯化砷的結構直到2001年才最終確定,AsCl5的空間構型與
五氯化磷(PCl5)類似,
拉曼光譜數據證實它們都是
三角雙錐形,其中水平方向的鍵長比軸向的短(As-Cleq = 210.6pm,211.9 pm; As-Clax= 220.7pm)。
同主族其他元素形成的五
氯化物——五氯化磷和五氯化銻都比五氯化砷穩定得多,而實驗測得它的
鍵能又沒有明顯下降,因此它的不穩定性較反常。這種現象可被歸結於d區收縮(類似的f區收縮又稱
鑭系收縮)。第一過渡系元素新增加的d電子不能有效
禁止核電荷,致使
有效核電荷上升,4s乃至4p、4d電子能量升高不易參與成鍵(這種現象在第6周期元素中更明顯,被稱為
惰性電子對效應)。類似的現象還有
硒酸和
高溴酸的強氧化性,儘管上面給出一些解釋,但目前仍不能完整地給出解釋。
 五氯化砷
五氯化砷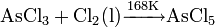
 五氯化砷
五氯化砷