基本介紹
物理性質
 氙的原子光譜
氙的原子光譜化學性質
數據
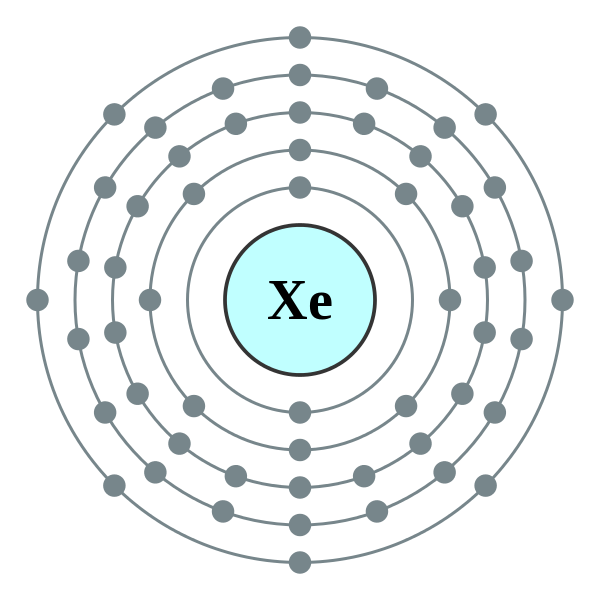 氙的電子排布
氙的電子排布I5: 5500;I6: 6600;I7: 9300;I8: 10600;I9: 19800;I10: 23000。
氟化反應與氟化氙








含氧化合物

複合氟化物

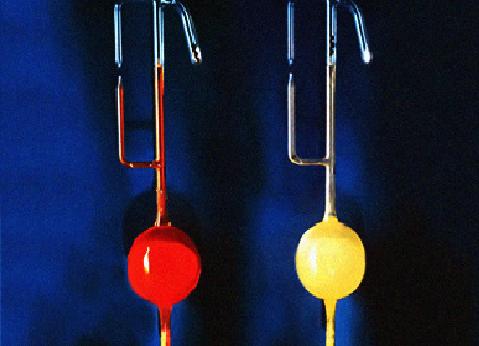 六氟化鉑(左)與六氟合鉑酸氙(右)
六氟化鉑(左)與六氟合鉑酸氙(右)其它化合物
研究歷史
同位素
主要用途
 高壓氙氣燈的白色
高壓氙氣燈的白色
XENON(化學元素氙的英文名)一般指本詞條
 氙的原子光譜
氙的原子光譜 氙的電子排布
氙的電子排布









 六氟化鉑(左)與六氟合鉑酸氙(右)
六氟化鉑(左)與六氟合鉑酸氙(右) 高壓氙氣燈的白色
高壓氙氣燈的白色XENON是微軟公司為其新一代電視遊戲機XBOX360所使用的CPU(中央處理器),IBM為其進行設計和生產。...
Xenon閃光燈是一種含有氙氣的新型大燈,又稱高強度放電式氣體燈,英文簡稱 HID Intensity Discharge Lamp。...
LG Xenon是一款採用冷暖型 ,空調匹數為1.5P ,適用面積為14-24㎡ ,室內機噪音為28-37dB,室內機尺寸為210×745×250mm等的壁掛式空調。...
規格參數 主體 品牌霍尼韋爾 Honeywell 型號Xenon 1902 顏色黑色 功能參數 解析度5 mil 掃描範圍10.2毫米 - 584.2 毫米 接口USB、鍵盤口、 RS232, IBM 46xx (...
Xenon DVR-PH8808AV(含VGA)是數字硬碟錄像機。...... 1. Xenon DVR-PH8808AV(含VGA)參數 .Xenon DVR-PH8808AV(含VGA)參數.2013-03-01[引用日期2013-03-0...
HONEYWELLXenon 1900GHD .京東[引用日期2015-01-25] 詞條標籤: 科學 V百科往期回顧 詞條統計 瀏覽次數:次 編輯次數:1次歷史版本 最近更新: 創建者:slr1f猜...
產品簡介Xenon 1900 是霍尼韋爾公司領先的第六代二維影像掃描器,重新定義了手持式掃描器的標準。 採用專為條形碼掃描而特製的感測器,Xenon 1900 在一系列二維影像技術...
Honeywell Xenon™ 1902gHD,1902gSR無線影像閱讀器是霍尼韋爾公司領先的第六代二維影像掃描器。...
Xenon 8421/1-GP是一款電子產品,產品外形為槍式。...... Xenon 8421/1-GP是一款電子產品,產品外形為槍式。中文名 Xenon 8421/1-GP 產品類型 模擬攝像機 ...
Xenon SN-E3142是一款模擬攝像機,產品外形為半球。...... Xenon SN-E3142是一款模擬攝像機,產品外形為半球。中文名 Xenon SN-E3142 類型 模擬攝像機 外形 ...
規格參數 主體 品牌技嘉 GIGABYTE 類型無線滑鼠 型號Aivia 星能 (Xenon) 顏色鏡面黑 規格 傳輸方式2.4G 人體工學是 滑鼠工作方式雷射 滑鼠解析度1000dpi 適用類型業...
XenonP828AV是一款硬碟錄像機,音頻輸入為1路RCA音頻輸入。...... XenonP828AV是一款硬碟錄像機,音頻輸入為1路RCA音頻輸入。中文名 Xenon P828AV 產品類型 ATM...
Xenon SN-SA3142GP的產品類型是模擬攝像機,成像器件是1/3英寸Sony CCD。...... Xenon SN-SA3142GP的產品類型是模擬攝像機,成像器件是1/3英寸Sony CCD。...
Xenon SN-R3148GP是一款模擬攝像機,成像色彩是彩色。...... Xenon SN-R3148GP是一款模擬攝像機,成像色彩是彩色。中文名 Xenon SN-R3148GP 產品類型 模擬攝像...
Xenon SN-LB3142GP是一款模擬攝像機,解析度為500×582PAL。...... Xenon SN-LB3142GP是一款模擬攝像機,解析度為500×582PAL。中文名 Xenon SN-LB3142GP 產品...
Xenon SN-EA3142DP是一款監控攝像機,成像色彩為彩色。...... Xenon SN-EA3142DP是一款監控攝像機,成像色彩為彩色。中文名 Xenon SN-EA3142DP 產品類型 模擬攝...
Xenon SN-9004AV是一款監控卡,工作環境溫度為-20~60℃,工作環境濕度為最大濕度95%。...
Xenon SN-S3148-GP是一款模擬攝像機,成像器件:1/3英寸Sony CCD。...... Xenon SN-S3148-GP是一款模擬攝像機,成像器件:1/3英寸Sony CCD。重要參數產品類型:模...
HONEYWELLXenon 1902GSR包裝清單 編輯 1902gsr掃描器×1 通訊充電底座×1 USB數據線×1[1] 參考資料 1. HONEYWELLXenon 1902GSR .京東[引用日期2015-01-14] ...
Xenon SN-U3142-GP是一款模擬攝像機,電源電壓為DC 12V。...... Xenon SN-U3142-GP是一款模擬攝像機,電源電壓為DC 12V。重要參數產品類型:模擬攝像機...
Xenon SN-HK3142GP是一款電子產品,產品功能是紅外燈。...... Xenon SN-HK3142GP是一款電子產品,產品功能是紅外燈。中文名 Xenon SN-HK3142GP 產品類型 模擬攝像...
Xenon SN-UA3142GP是一款監控攝像機,成像器件為1/3英寸Sony SuperHAD CCD。...... Xenon SN-UA3142GP是一款監控攝像機,成像器件為1/3英寸Sony SuperHAD CCD。...
Xenon DVR-PH4116AV是一款網路硬碟錄像機,複合視頻1.0Vp-p/75Ω。...... Xenon DVR-PH4116AV是一款網路硬碟錄像機,複合視頻1.0Vp-p/75Ω。...
Xenon SN-R3142GP是一款模擬攝像機。...... Xenon SN-R3142GP是一款模擬攝像機。中文名 Xenon SN-R3142GP 產品類型 模擬攝像機 產品功能 紅外燈 成像色彩 ...
Xenon SN-EA3148DP是一款監控攝像機,成像色彩為彩色。...... Xenon SN-EA3148DP是一款監控攝像機,成像色彩為彩色。中文名 Xenon SN-EA3148DP 產品類型 模擬攝...
氙(xenon)是一種稀有氣體,化學符號Xe。元素周期表中第18族元素之一,原子序數54。無色、無嗅、無味,化學性質極不活潑。存在於空氣中(每100ml空氣含氙0.0087mL...
中文名稱:氙;氙氣;液氙英文名稱:Xenon;xenon,refrigerated liquid(cryogenic liquid)國標編號 22015CAS號 7440-63-3EINECS號 231-172-7InChI InChI=1/Xe...
雙氙氣大燈,行業術語 BI-XENON,確切描述為:在同一個反射系統中,只使用一顆氙氣燈泡,通過機械快門的切換來滿足近光和遠光兩種照明功能。特別是,遠光照明時,近光...
