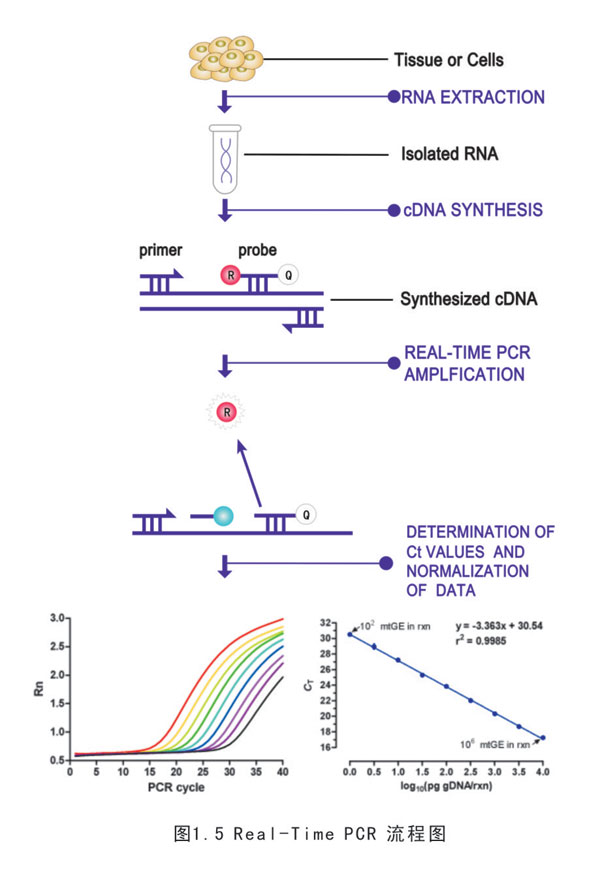
所謂real-time Q-PCR技術,是指在PCR反應體系中加入螢光基團,利用螢光信號累積實時監測整個PCR進程,最後通過標準曲線對未知模板進行定量分析的方法。利用螢光信號的變化實時檢測PCR擴增反應中每一個循環擴增產物量的變化,通過Ct值和標準曲線的分析對起始模板進行定量分析。
基本介紹
- 外文名:Real Time Q-PCR
- 方法:曲線對未知模板進行定量分析
- 介質:螢光信號
- 分析:Ct值和標準曲線
所謂real-time Q-PCR技術,是指在PCR反應體系中加入螢光基團,利用螢光信號累積實時監測整個PCR進程,最後通過標準曲線對未知模板進行定量分析的方法。利用螢光信號的變化實時檢測PCR擴增反應中每一個循環擴增產物量的變化,通過Ct值和標準曲線的分析對起始模板進行定量分析。
所謂real-time Q-PCR技術,是指在PCR反應體系中加入螢光基團,利用螢光信號累積實時監測整個PCR進程,最後通過標準曲線對未知模板進行定量分析的方法。利用螢光信號的變化...
Real-Time PCR 技術,又稱實時定量螢光PCR,是指在PCR反應體系中加入螢光基團,利用螢光信號累積實時監測整個PCR進程,最後通過標準曲線對未知模板進行總量分析或通過Ct值...
定量PCR,又稱定量即時聚合酶鏈鎖反應(Quantitative real time polymerase chain reaction,簡稱 Q-PCR/qPCR/rt-qPCR、定量即時PCR、即時定量PCR),是一種在DNA擴增...
實時螢光定量PCR (Quantitative Real-time PCR)是一種在DNA擴增反應中,以螢光化學物質測每次聚合酶鏈式反應(PCR)循環後產物總量的方法。通過內參或者外參法對待測...
Realtime PCR溶解曲線編輯 鎖定 討論999 本詞條缺少信息欄、概述圖,補充相關內容使詞條更完整,還能快速升級,趕緊來編輯吧!溶解曲線分析可以用來確定不同的反應產物...
所謂real-time Q-PCR技術,是指在PCR反應體系中加入螢光基因,利用螢光信號累積實時監測整個PCR進程,最後通過標準曲線對未知模板進行定量分析的方法。在 real-time ...
QPCR的英文全名是Real-time Quantitative PCR Detecting System。即實時螢光定量核酸擴增檢測系統,也叫實時定量基因擴增螢光檢測系統,簡稱QPCR。...
螢光定量PCR( realtime fluorescence quantitative PCR,RTFQ PCR) 是1996 年由美國Applied Biosystems 公司推出的一種新定量試驗技術,它是通過螢光染料或螢光標記的...
9. 9. Li p Q, Yang Z F,Chen J X, et al. Simultaneous detection of...A novel multiples real-time RT-PCR assay with FRET hybridization probes for...
所謂Real-Time PCR技術,是指在PCR反應體系中加入螢光基團,利用螢光信號累積實時監測整個PCR進程,最後通過標準曲線對未知模板進行定量分析的方法。利用螢光信號的變化...
即時聚合酶鏈鎖反應(Real-time polymerase chain reaction,簡稱 Real-time PCR、即時PCR),又稱定量即時聚合酶鏈鎖反應(Quantitative real time polymerase chain ...
2008年,博日公司隆重推出新一代PCR儀及相關產品,其中包括:LineGene3310/3320 Realtime PCR儀, GenePro、GeneQ、梯度LifeExpress基因擴增儀,化學發光檢測系統,離心機...
實時螢光定量PCR擴增的實驗檢測過程可分為:(1)樣品製備,抽提和濃縮目標RNA分子,並除去可能存在的抑制因子。(2)Real-time PCR,檢測PCR的產物使用螢光標記的寡核苷酸...
