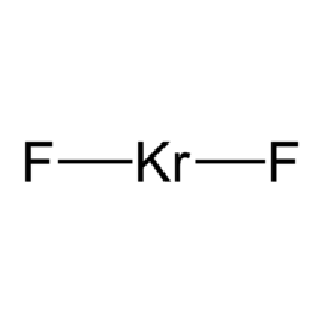二氟化氪,化學式KrF2,是氪的唯一已知氟化物。室溫下自發分解為氪和氟,在93℃時分解速率很快。僅在低於-30℃穩定,可長期在乾冰溫度(-78℃)下貯存。氧化性比氟強,遇水迅速分解,並能和其他氟化物形成多種加合物。
基本介紹
- 中文名:二氟化氪
- 英文名:Krypton difluoride
- 化學式:KrF2
- 分子量:121.7968
- CAS登錄號:13773-81-4
- 沸點:-80°C(分解)
- 水溶性:分解
- 密度:3.24 g/cm3
- 外觀:無色固體
- 套用:可用作氟化劑和氧化劑
物理性質,結構,化學性質,極強的氧化性,形成加和物,製備方法,
物理性質
性狀:無色固體,具有揮發性
生成熱:ΔHfΘ= +60.24kJ/mol
溶解性:1000g的無水氟化氫,約溶解16mol的二氟化氪
二氟化氪溶於無水氟化氫後,0℃時測得該溶液的核磁共振譜,表明二氟化氪的兩個氟原子是等同的,而且不會與溶劑中的氟發生交換,也就是說二氟化氪在溶液中並不發生電離
結構
KrF2為線型分子,對稱類型為D∞h,Kr—F鍵長為188.9pm
KrF2有兩種晶形:α-型(低溫型)和β-型(高溫型)。
α-型在低溫下穩定,為體心四方晶系;β-型在−80℃以上穩定。
化學性質
極強的氧化性
至今所知由單質氟合成的各種氟化合物中, KrF2是唯一通過吸熱反應而生成的,這一點具有極為重要的潛在意義。它意味著KrF2是一種比單質氟的氧化能力更強的物質,在測定它的紅外光譜時,甚至可以將吸收槽中氯化銀中的Cl-氧化為三氟化氯和五氟化氯。因而KrF2是一種異常強烈的氧化劑,其氟化-氧化能力超過氟化氙、鹵素氟化物和氟氧化物等。
- 可直接將氙氧化為六氟化氙:3KrF2 + Xe → XeF6 + 3Kr
- 在三氟化鈰存在下,可順利將PrF3轉化為PrF4,產率為56%;對於Pr6O11則可以100%地氟化為PrF4
KrF2無論是在酸性、中性或鹼性水溶液中都迅速分解,這與二氟化氙不同。放射分析證明,將用Kr-85標記的KrF2水解後,溶液中沒有放射性的Kr-85,因而無任何氪化合物留在水中。
形成加和物
KrF2能與很多路易斯酸形成加和物,加合體基本上是氟化物,如 KrF2·SbF5 、KrF2·XeF6等。KrF2生成加和物的機理與XeF2相同,也是F-的給予體,給出氟離子的能力弱於XeF2。KrF2的加和物也具有極強的氟化-氧化本領。
KrF2在-20℃時同五氟化銻生成組成為KrF2·2SbF5的加和物,其結構為[KrF]+[Sb2F11]-,這個加和物比KrF2穩定得多,蒸汽壓也比KrF2的低,因此可代替KrF2作為極強的氟化-氧化劑。它的熔點為50℃,熔化後很快分解為氪、氟和五氟化銻。
在加和物中氪以KrF+、Kr2F3+存在,它們都是極強的氟化-氧化試劑,能將金氧化為最高氧化態+5:
製備方法
- 放電合成法:在較高的的壓力下,對1:1或2:1比例的氟和氪混合物放電,可得到二氟化氪。由於單質氟有劇毒,因而改用含氟化合物如二氟二氯甲烷,在高頻放電下同氪反應,也可製得二氟化氪。如果反應過程採用循環法,產率可顯著提高。
- 高能輻射法:用能量為10MeV的質子流,在133K的溫度下輻照氪和氟的混合物,可得到二氟化氪。
- 光化學合成法:在一定溫度下,用適宜波長的紫外光照射氪和氟的混合物,亦可以合成二氟化氪。最佳的反應溫度是−196℃(77K)。實驗證明溫度對反應有很顯著的影響,溫度稍高時就不能得到KrF2,這也就說明早期用光化學方法合成氟化氪為什麼失敗。因為早期合成時間溫度為-60℃和室溫,高於-78℃,所以不能生成二氟化氪