低溫即指低於室溫的溫度。將物質的溫度降到低於環境溫度的操作稱為製冷或冷凍。一般說來,將局部空間溫度降低到一100℃稱為普通冷凍或普冷;降低到一100℃至4.2 K之間稱為深度冷凍或深冷;降低到4.2 K以下者稱為極冷。室溫以下的合成成為低溫合成
基本介紹
- 中文名:低溫合成
- 外文名:low-temperature synthesis
- 學科:化學合成
低溫的獲取
恆溫低溫浴
冷浴 | 溫度/℃ | 冷浴 | 溫度/℃ |
冰-水糊狀物 | 0 | 甲苯糊狀物 | -95 |
四氯化碳糊狀物 | -22.8 | 二硫化碳糊狀物 | -111.6 |
液氨 | -45~-33 | 甲基環己烷糊狀物 | -126.3 |
氯苯糊狀物 | -45.2 | 正戊烷糊狀物 | -130 |
氯仿糊狀物 | -63.5 | 異戊烷糊狀物 | -160.5 |
乾冰浴 | -78.5 | 液氧 | -183 |
乙酸乙酯糊狀物 | -83.6 | 液氮 | -196 |
製冷產生低溫
基本方法 | 目前所達到的最低溫度 |
液氧 | 正常沸點90K,減壓降溫到54K(三相點) |
液氦 | 正常沸點77K,減壓降溫到634K(三相點) |
液氖 | 正常沸點27K,減壓降溫到24K(三相點) |
液氫 | 正常沸點20K,減壓降溫到14K(三相點) |
液4He | 正常沸點4.2K,減壓降溫到0.84K |
液3He | 正常沸點3.2K,減壓降溫到0.3K |
稀釋製冷 | 1968年,5.5mK;1972年,3mK1987年,2mK |
波麥蘭丘克製冷 | 1.2mK(在低溫下沿溶解曲線絕熱壓縮3He固液混合物) |
順磁鹽絕熱去磁 | 1.9mK(順磁鹽硝酸鈰鎂的有序溫度) |
核絕熱去磁 | 5×10-8K(二極銅核去磁,核系統溫度) |
低溫恆溫器
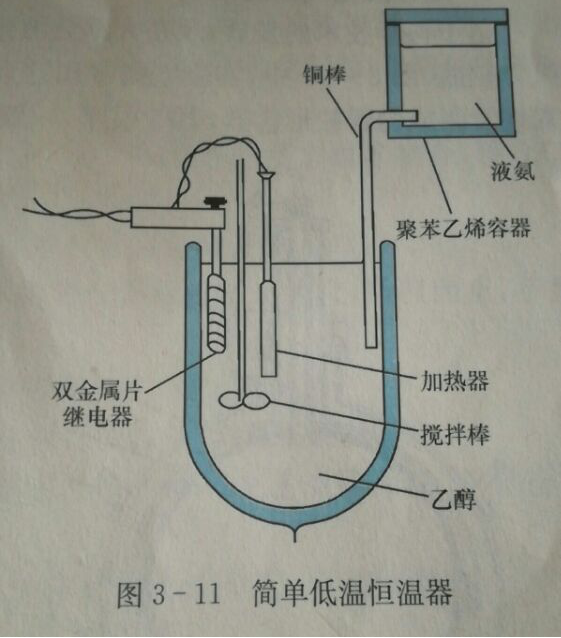 簡單的低溫恆溫器
簡單的低溫恆溫器低溫合成實例
許多在非水溶劑中進行的反應必須在低溫下進行,因為它們只在低溫下才呈液體狀態,如NH3、SO2、HF等,其中液氨是研究得最多,也是套用最廣的非水溶劑。例如:
液氨體系: Mg+2NH3(l)═══Mg(NH2)2 ↓+H2↑
液態S02體系:CaO+2S02(l)═══CaS205
PCI5+S02(l)═══POCl3+SOCl2
(2)低溫下稀有氣體化合物的合成
稀有氣體是氦、氖、氬、氪、氙、氡等六種元素的總稱。稀有氣體混合物本身就是在低溫下進行分離和提純的,它們的一些化合物也是在低溫下合成的,常採用的方法有低溫放電合成、低溫水解合成和低溫光化學合成。例如:
低溫放電合成:2F2+SICl4+2Xe ═══2XeCl2+SiF4
低溫水解合成: XeOF4+2H20═══Xe03+4HF
低溫光化學合成: Xe+F2═══XeF2
(3)低溫下揮發性化合物的合成
揮發性化合物由於其熔點、沸點都較低,且合成時副反應較多,因此它的合成與純化都需在低溫下進行。如在低溫條件下以丙二酸為原料製備二氧化三碳:
C3H404 ═════════C302+2H20
低溫合成技術的套用
稀有氣體化合物的合成
a.低溫下的放電合成
約斯特(Yost)等人於1933 年曾用放電法製備氟化氙,但未成功。基甚謝思鮑姆(Kirschenbaum)等人於1963 年用放電祛製備XeF4獲得成功。反應器的直徑為6.5cm,電極表面的直徑為2cm,相距7.5cm,將反應器浸人-78℃的冷卻槽中,然後將1體積的氙和2 體積的氟在常溫常壓下以136cm3/h的速度通人反應器;放電條件為(1100V,31mA)~(2 80 V,12mA)。歷時3h,耗14.20mmol氟和7.1mmol氙,生成了7.07mmol( 1.465g)的氟化氙。說明此反應為定量反應。為了測定產物的組成,用過量的汞和產物反應,生成HgF 並放出氙,證明產XeF4。反應按下式進行:XeF4+ 4Hg═══Xe+2Hg2F2
在低溫下XeF4與過量的O2F2反應時,則可被氧化成XeF6其反應為:
XeF4+02F2 ——→ XeF6+O2(在140K~195K溫度下)
b .低溫水解合成
最初製成XeF4時,就發現它的水解過程比較複雜。經過仔細研究,證明水解的最終產物不是Xe(Ⅳ)化合物,而是Xe(Ⅵ)化合物。其反應機理為XeF4水解時發生歧化反應,Xe(Ⅳ)一部分被氧化成Xe(Ⅵ)一部分被還原為單質氙。
3XeF4+6H2O═══2XeO+ XeO4 +12HF Xe0═══Xe + 1/2 O2
XeO4═══XeO3+1/2 O2
故總的反應式為: 8XeF4+6H2O═══XeO3+2Xe+ 1/2O2 +12HF
水解的最終產物經X 射線分析,確證為XeO3 。
XeF6 的水解機理比較簡單,無歧化反應產生: XeF6+ 3H2O═══XeO3+6HF
此外XeOF4 水解也可生成XeO3: XeOF4+2H2O═══XeO3 + 4HF
對比XeF4和XeF6的水解結果可以看出,XeF6水解時Xe(Ⅳ)全部變成XeO3轉化率最高;XeF4由於歧化反應,Xe(Ⅳ)只有1/3 轉化為XeO3,故製備XeO3, 以XeF6水解為宜。
XeF4和XeF6的水解反應極為劇烈,易引起爆炸。為了減慢和便於控制反應速度,可先用液氮冷卻氟化氙,然後加人水,這時便形成了凝固狀態,逐漸加熱使反應緩緩進行.直至加熱至室溫。水解完畢後,小心地蒸發掉氟化氫和過量的水,便可得到潮解狀的白色XeO3固體。
XeO4的製備也需要低溫,將高低酸鹽放人帶支管的玻璃儀器中,在室溫下緩慢滴入-5℃ 的濃硫酸,則生成XeO4氣體。將此氣體收集在液氮冷凝器中,呈黃色固體。然後進行真空升華,即得到純的四氧化氙,儲於-78℃的冷凝容器中。高氙酸鹽與濃硫酸的反應如下:
Na4XeO6+2H2SO4 ═══XeO4+2Na2SO4+2H2O
Ba2XeO6+2H2S04 ═══ XeO4+2BaSO4↓+2H2O
需要特別指出的是XeO4固體極不穩定,甚至在-40℃也發生爆炸,其反應式為:
Xe04═══Xe +202
因此需要在-78℃下保存。氣態的XeO4反而比較穩定,在室溫或稍高於室溫的溫度下徐徐分解為XeO3。
c.低溫光化學合成
Weeks 等於1962年在一600 下用紫外線照射氪氟混合物,沒有得到氟化氪,Streng於1966年將氪和氟(或F2O)按1:1摩爾比裝人硬質玻璃容器中,在常通常壓下,用日光照射五個星期,據信製得了KrF2,但此實驗未能被重複,趨向於被否定。這樣,光化學合成法製備KrF2就擱置下來。至1975年Slivnik降低反應溫度至-196℃在100mL的硬質玻璃反應器內,用紫外線照射氪、氟混合液體48h,確證獲得了4.7gKrF2。實驗證明溫度對反應的影響很顯著;溫度稍高就不能合成KrF2。側如,在-787℃時,氪、氟混合物在紫外線(200~470nm)展射下,不能生成氟化氪,這也就解釋了早期用光化學法合成氟化氪失敗的原因。因為早期時的溫度為-60℃和室溫,高-78℃,故不生成二氟化氪。
光化學合成KrF2的機理,首先是分子氟受激分解為原子氟,原子氟與氪生成KrF·自由基,然後KrF·和KrF·或F原子碰撞生成KrF2;故光源的波長對量子產率(KrF2的產量/W·h)有很大的影響。
例如,310nm時的量子產率最大。這是因為氟分子的吸收帶恰好在250~300nm區間,有利於氟受激分解為原子氟。體系中的雜質對量子產率的影響也很大。例如,在Kr(s)~F2((g)體系中,如含氧10%-15%則量子產事降低1~2倍,低的影響更大,當體系中含氙5%時,實際上不生成KrF2,主要生成XeF2,加BF3,可使量子產率增加一倍,這可能是BF3與KrF·自由基反應,生成的KrBF4,有利於KrF·的穩定和不致分解;另方面,BF3與生成KrF3,結合為KrF2·BF3可免於KrF2的光解。
低溫分離
(1)低溫下的分級冷凝
選擇這種操作時要讓意,混合氣體通過冷阱時的速度不能太快,否則分離效率受影響;還要注意的是當混合物中各組分沸點之差小於40℃ 時,通過分級冷疑達不到定量的分離,但可通過重複的分級冷擬實現分離。
 低壓分離柱
低壓分離柱