基本介紹
- 中文名:Gabriel合成
- 底物:鹵代烴與鄰苯二甲醯亞胺鹽
- 產物:伯胺
- 命名人:Siegmund Gabriel
- 領域:有機合成
傳統Gabriel合成
反應機理
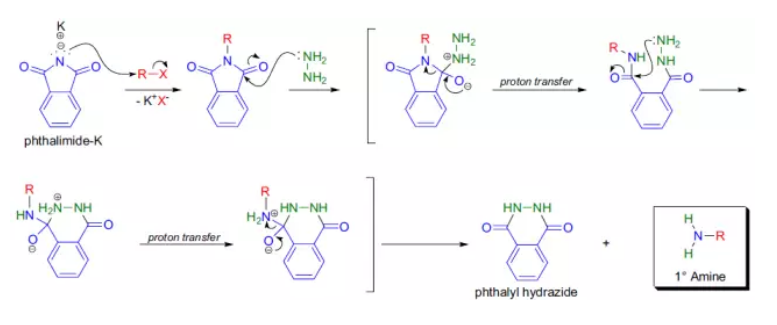
反應舉例
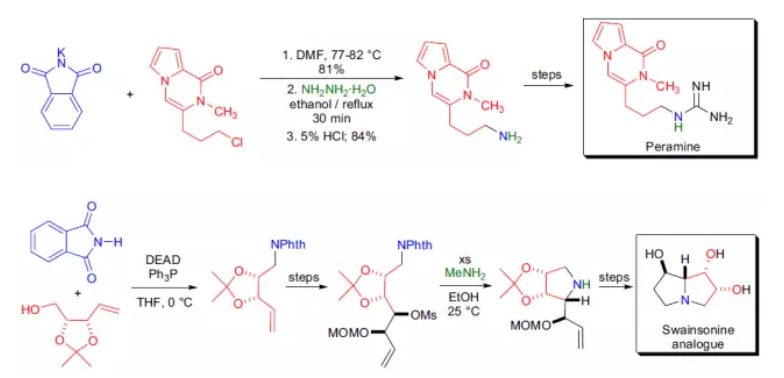


5.Williamson合成:醇在鹼(鈉,氫氧化鈉,氫氧化鉀)存在下與鹵代烴反應生成醚。6.Gabriel合成:將氨先製備成鄰苯二甲醯亞胺,利用氮上氫的酸性,先與氫氧化鉀生成鉀鹽,然後與鹵代烴作用,得N-烴基鄰苯二甲醯亞胺,肼解或酸水解即可...
Regitz重氮化物合成反應 Reimer-Tiemann反應 Reissert反應 Reissert吲哚合成反應 Ring-closing metathesis(RCM,閉環複分解反應)Ritter反應 Robinson增環反應 Robinson-Gabriel合成反應 Robinson-Schopf反應 Rosenmund還原反應 Rubottom氧化反應 Rupe...
Gabriel合成法(雙醯胺N負離子)118 Hinsberg反應(產生磺醯胺N負離子)118 Hantzsch合成法(合成吡啶同系物)118 Skraup合成法(N孤對電子對不飽和鍵加成、與苯環環合)119 Combes合成法(N孤對電子對不飽和鍵加成、與苯環環合)120 Conrad-...
621Robinson-Gabriel合成法(117)6224-甲基-5-乙氧基唑製備技術(120)63喹啉環合成技術(122)631Skraup喹啉合成法(122)632Friedlander喹啉合成法(123)633Combes喹啉合成法(123)634Conrad-...
5120DoeringLaFlamme丙二烯合成222 5121Eschenmoser偶聯反應222 5122EschenmoserTanabe碎片化反應223 5123Finkelstein 反應224 5124Fukuyama胺合成224 5125FürstPlattner規則225 5126Gabriel合成225 ...
。反應以法國化學家 Stéphane Marcel Delépine (1871-1965) 的名字命名。常用的鹵代烴為活潑鹵代烴,如烯丙型、苯甲型和 α-鹵代酮。例如,以2,3-二溴丙烯為原料,可製得2-溴烯丙胺。參見 化學反應列表 Gabriel伯胺合成 ...
1.3Gabriel合成法(7)1.4Gattermann-Koch反應(9)1.5GombergBachmann偶聯(10)1.6Heck反應(12)1.7HellVolhardZelinsky反應(13)1.8Hinsberg反應(15)1.9Hunsdriecker反應(18)1.10Koch-Haaf羰基化反應(19)1.11...
Gabriel胺合成156 LeuckartWallach反應 和EschweilerClarke反應158 Merrifield 固相多肽合成160 Petasis反應163 Ritter反應165 Staudinger反應167 【CO鍵】Nef反應169 Yamaguchi酯化170 Steglich酯化法和Keck改良法171 【CS鍵】Lawesson’s...
彼得·蓋布瑞爾(Peter Gabriel)生於1950年2月13日,出生地是英國倫敦,他是個音樂鬼才,不但是樂團主唱,而且鍵盤、敲擊樂、直笛、以及合成樂器都是拿手絕活。Peter Gabriel是1970年代紅極一時的搖滾樂團《創世紀》(Genesis)的團長,...
3.9.4 Gabriel合成法 89 3.9.5 Hofmann降解法 90 3.10 腈的製備 90 3.10.1 鹵代烴與氰化鈉的反應 90 3.10.2 氫氰酸與醛酮、烯烴或炔烴的加成反應 90 3.10.3 醯胺、肟的脫水反應 90 3.11 雜環化合物的製備 91 3.11...
17.11 Gabriel合成法 17.12 用醇製備 17.13 舍氮化合物的還原 17.14 醛、酮的還原氨(胺)化 17.15 從羧酸及其衍生物制胺 複習本章的指導提綱 英漢時照辭彙 第18章含氮芳香化合物芳香親核取代反應 (一)芳香硝基化台物 18...
14.8胺的製備方法二: 氨或胺的烷基化和Gabriel合成法 14.9胺的製備方法三: 醛、酮的還原胺化 14.10胺的醯基化與Hinsberg反應 14.11四級銨鹼和Hofmann消除反應 14.11.1四級銨鹼 14.11.2 Hofmann消除反應 14.12胺的氧化和Cope...
17.11 Gabriel合成法 17.12 用醇製備 17.13 含氮化合物的還原 17.14 醛、酮的還原氨(胺)化 17.15 從羧酸及其衍生物制胺 複習本章的指導提綱 英漢對照辭彙 第18章 含氮芳香化合物芳香親核取代反應 (一)芳香硝基化合物 18...
14.8胺的製備方法二: 氨或胺的烷基化和Gabriel合成法 14.9胺的製備方法三: 醛、酮的還原胺化 14.10胺的醯基化與Hinsberg反應 14.11四級銨鹼和Hofmann消除反應 14.12胺的氧化和Cope消除 14.13胺與亞硝酸的反應 14.14重氮甲烷...
Acetoacetic ester(乙醯乙酸乙酯)合成1 Blanc氯甲基化反應3 Cram規則4 Duff醛基化反應5 Enders腙烴基化反應6 Ene反應7 Eschenmoser亞甲基化反應9 Evans烴基化反應10 Frater-Seebach烴基化反應12 Friedel-Crafts反應12 Gattermann-Koch合成...
