基本介紹
發展歷史
反應內容
定義
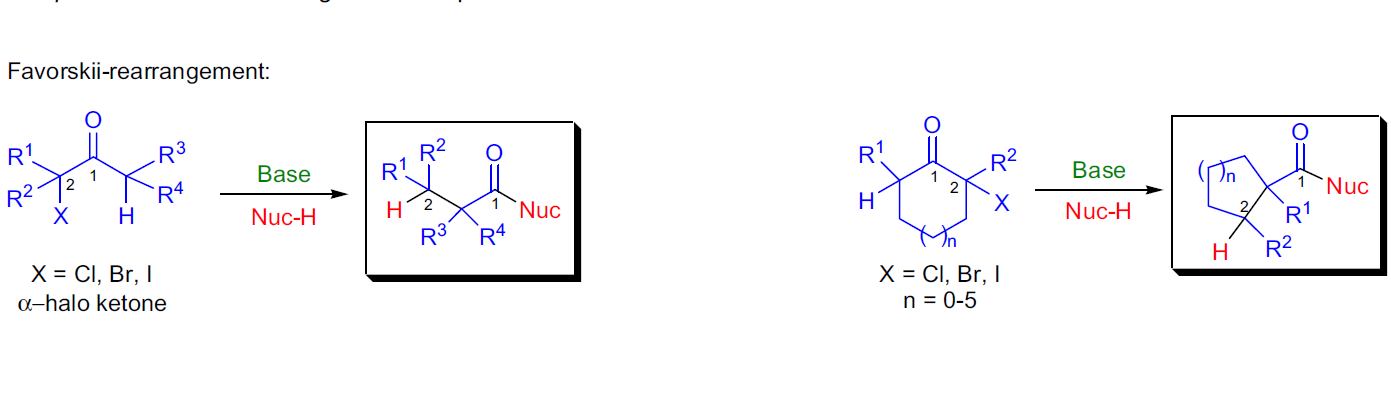
反應特徵
反應機理
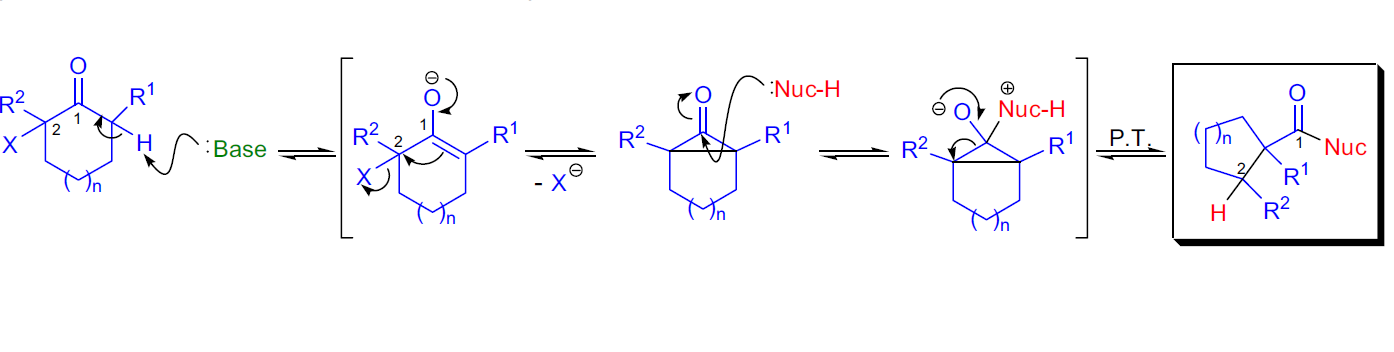
意義價值
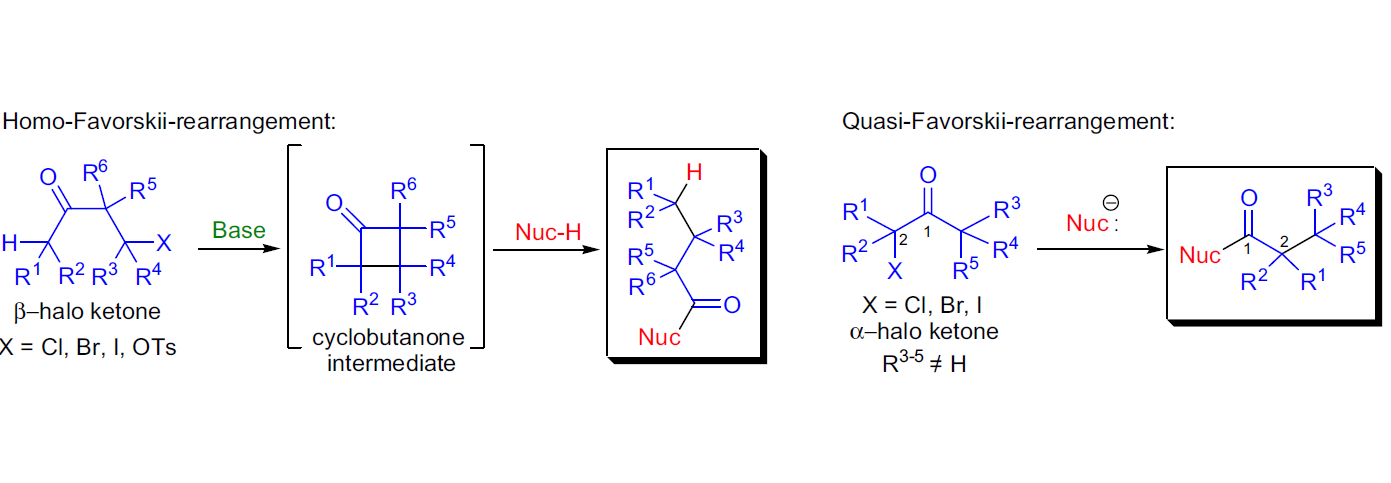
衍生反應
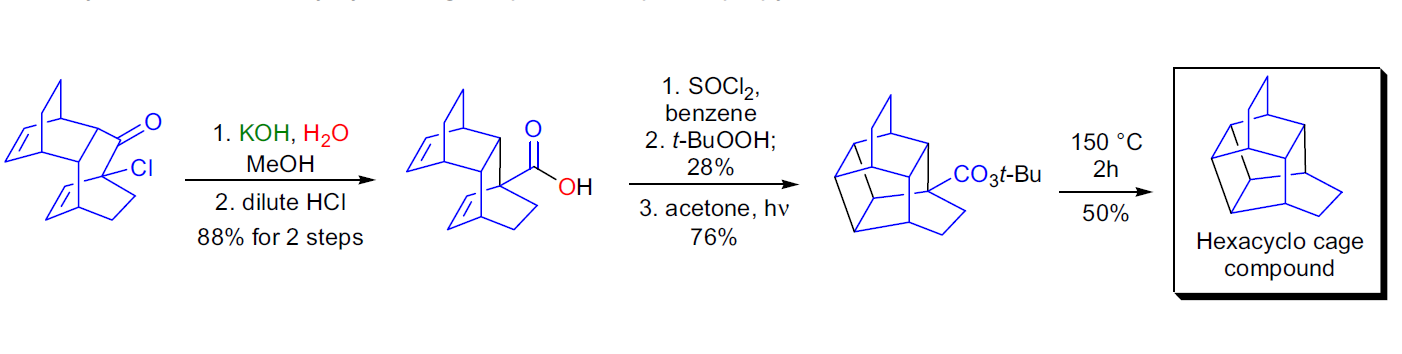
反應舉例
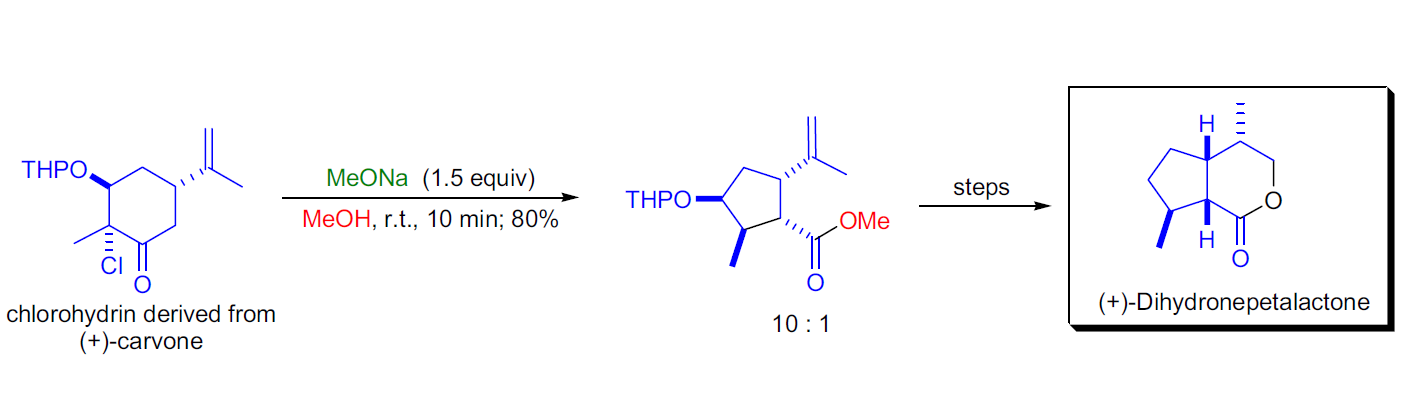
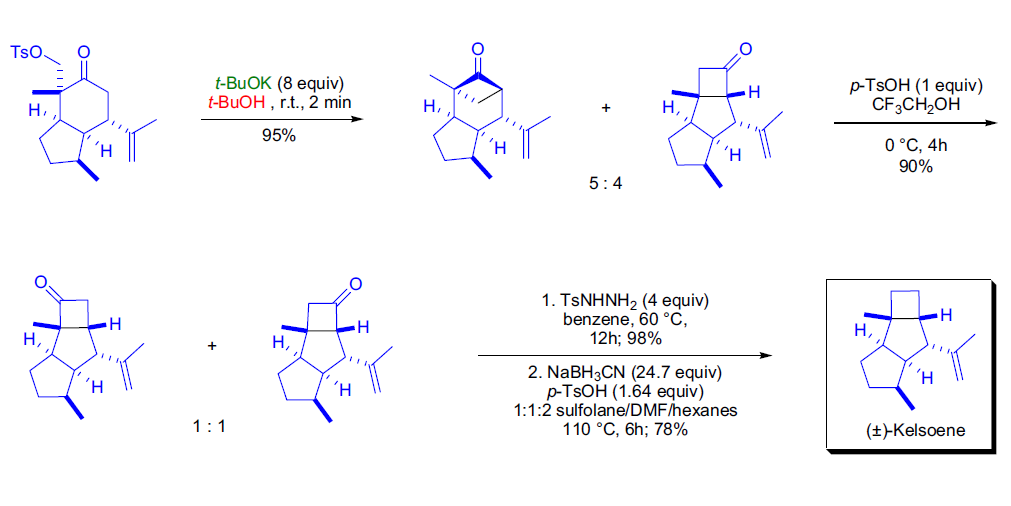
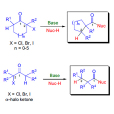
Favorskii重排一般指本詞條






Favorskii重排是指α-鹵代酮類在鹼性催化劑(ROK、RONa、NaOH等)存在下發生重排生成羧酸酯或羧酸)(NH3的存在使生成醯胺)的反應,酮羰基不含鹵素的一端的烴基重排至鹵素位置。該反應具有立體專一性,手性基團重排後構型不變。通式如下...
Favorskii重排反應(Favorskii重排),常誤寫為Favorski重排反應,是α-鹵代酮在鹼作用下重排為羧酸衍生物(如羧酸、酯和醯胺)的反應。環酮反應得到少一個碳的環烷基羧酸。使用的鹼可以是氫氧根離子、醇鹽負離子或胺,產物分別為羧酸、...
Meyer-Schuster重排反應(Meyer-Schuster rearrangement)酸催化的炔丙醇至α,β-不飽和酮的重排反應。反應中可用的酸催化劑可以是乙酸、硫酸或鹽酸等。鹼催化的類似反應為Favorskii反應。反應機理 本反應的機理始於質子化的醇以E1消除的方式...
一、Hydroperoxide 重排反應(氫過氧化物的重排)115 二、Baeyer-Villiger反應118 第二章親電重排反應124 第一節Favorskii重排反應126 第二節Stevens重排反應136 第三節Wittig重排反應143 第三章芳香族芳環上的重排反應150 第一節芳環上的...
第二十章Dienone��phenol重排反應(二烯酮�卜又嘏歐從Γ�)246 第二十一章Dimroth重排反應(迪姆羅特重排反應)258 第二十二章Favorskii重排反應(法沃斯基重排反應)270 第二十三章Ferrier重排反應(費里爾重排反應)287 第...
Favorskii反應(Favorskii reaction),又稱Favorski反應、Favorsky反應,末炔與羰基化合物在鹼性介質(如無水氫氧化鉀或氨基鈉)中發生反應,生成羰基加成產物炔醇。簡介 醚、液氨、乙二醇醚、四氫呋喃、二甲亞碸及二甲苯等可用作這個反應的...
若分子內還含有其他缺電子性親電基團的話,則可引起親電性重排反應,生成相應的重排產物。舉例:Favorskii重排反應 a-鹵代酮在鹼的作用下重排生成羧酸或其衍生物的反應稱為Favorskii重排反應,根據所用鹼的不同(苛性鹼、醇鹽或胺),可...
8.5Carroll重排(303)8.6Ciamician-Dennsted重排(304)8.7Claisen重排(306)8.8Cope重排(310)8.9Demjanov重排(312)8.10Dienone-Phenol(二烯酮-酚)重排反應(315)8.11Favorskii 重排反應(317)8.12Fries重排反應(320)8...
Favorskii反應282 Favorskii重排283 Fries重排289 Hofmann重排293 Lossen重排297 Meyer Schuster重排299 Payne重排301 Pinacol(頻哪醇)重排304 Rupe重排309 Claisen重排310 Sommelet Hauser重排(銨葉立德重排)316 Wagner Meerwein重排318 Zinin...
1.親核重排188 2.親電重排189 二、自由基反應機理190 三、周環反應機理190 第二節從碳原子到碳原子的重排191 一、Wagner-Meerwein重排191 二、Pinacol重排193 三、二苯基乙二酮-二苯基乙醇酸重排197 四、Favorskii重排199 五、Wolff...
Favorskii重排反應 Feist-Benary呋喃合成反應 Ferrier碳環化反應 Ferrier烯糖烯丙基重排反應 Fiesselman噻吩合成反應 Fischer-Speier酯化反應 Fischer吲哚合成反應 Fischer唑合成反應 Fleming-Kumada氧化反應 Friedel-Crafts反應 Friedlander喹啉合成...
Beckmann重排332 Brook重排和逆Brook重排334 Carroll重排335 Chan重排337 Claisen重排338 JohnsonClaisen 重排,Esche nmoserClaisen 重排和Ireland Claisen 重排341 Cope重排344 Curtius重排346 Demjanov重排348 Favorskii重排349 Ferr...
Favorskii重排74 第二節N卡賓75 Hofmann重排(降解)75 Lossen反應(洛森重排反應)76 Curtius反應76 Schmidt反應77 第三節O卡賓78 Baeyer-Villiger反應(氧化重排反應)78 Dakin反應79 第七章C、N正離子類80 第一節烷基C+80 一、由P製備...
陳德恆重排 /601 Claisen 重排 /603 Eschenmoser-Claisen 重排、Johnson-Claisen 重排和 Ireland-Claisen 重排 /607 Cope 重排 /612 Curtius 重排 /614 Demjanov 重排 /617 Favorskii 重排 /619 Fries 重排 /6...
一、Claisen重排反應215 二、Cope重排反應216 三、Fischer吲哚合成反應216 四、[2,3]Wittig重排217 本章小結217 第十章重排反應218 第一節親電性重排反應218 一、Favorskii重排218 二、Stevens重排反應219 三、Wittig重排反應220 四、...
第六章 重排反應 第一節 親核重排 一、Wagner-Meerwein重排 二、Pinacol重排 三、Beckmann重排 四、Hofmann重排 五、Baeyer-Villiger重排 第二節 親電性重排 一、Favorskii重排 二、Stevens重排 三、Benzil重排 第三節 其他重排 一、...
Favorskii 重排反應 Feist-Benary 呋喃合成反應 Ferrier 碳環化反應 Ferrier 烯糖烯丙基重排反應 Fiesselman 噻吩合成反應 Fischer 吲哚合成反應 Fischer *唑合成反應 Fleming-Kumada 氧化反應 Friedel-Crafts 反應 Friedlander 喹啉合成反應 F...
Ireland重排196 438Cope重排197 439DemjanovTiffeneau重排197 4310Dienonephenol(二烯酮酚)重排198 4311diπ甲烷重排198 4312Favorskii 重排199 4313Fries重排200 4314FritschWiechell...
