1,2,4-三氮唑和親二烯體(如烯胺)通過雜原子D-A加成脫去N2得到吡啶的反應。
吡啶是指苯環上含有一個氮原子的六元雜環化合物,其結構與苯非常相似,從生物電子等排理論來說,化巧和苯是一對生物電子等排體,兩者在很多方面是相似的。除作溶劑外,吡啶在工業上還可用作變性劑、助染劑,以及合成一系列產品(包括藥品、消毒劑、染料、食品調味料、粘合劑、炸藥等)的起始物。
基本介紹
- 中文名:Boger 吡啶合成
- 產物:吡啶
- 意義:重要的化工材料
- 領域:有機合成
反應原理,反應實例,吡啶及其衍生物,芳香性,物理性質,光譜性質,化學性質,
反應原理
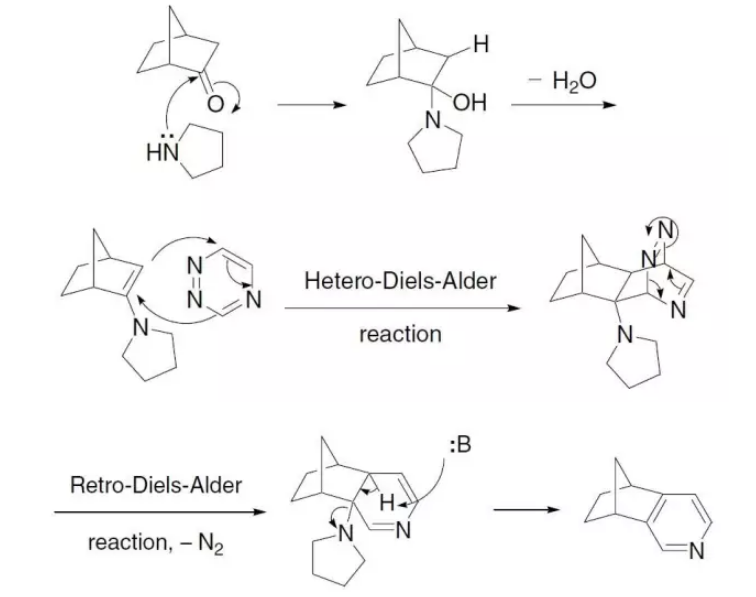 反應原理
反應原理反應實例
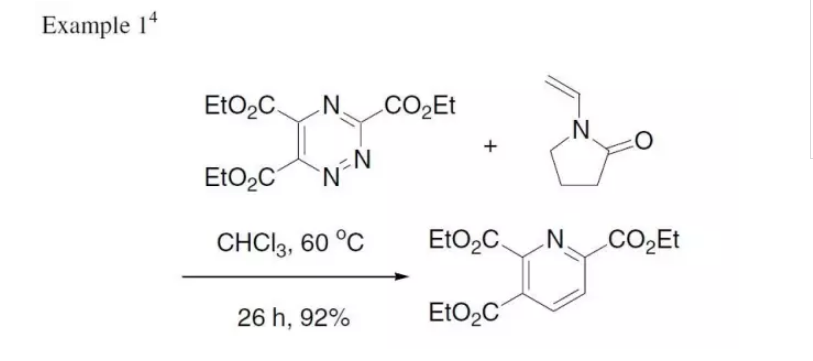 反應實例
反應實例吡啶及其衍生物
吡啶,有機化合物,是含有一個氮雜原子的六元雜環化合物。可以看做苯分子中的一個(CH)被N取代的化合物,故又稱氮苯,無色或微黃色液體,有惡臭。吡啶及其同系物存在於骨焦油、煤焦油、煤氣、頁岩油、石油中。吡啶在工業上可用作變性劑、助染劑,以及合成一系列產品(包括藥品、消毒劑、染料等)的原料。
2017年10月27日,世界衛生組織國際癌症研究機構公布的致癌物清單初步整理參考,吡啶在2B類致癌物清單中。
芳香性
吡啶的結構與苯非常相似,近代物理方法測得,吡啶分子中的碳碳鍵長為139pm,介於C-N單鍵 (147pm)和C=N雙鍵(128pm)之間,而且其碳碳鍵與碳氮鍵的鍵長數值也相近,鍵角約為120°,這說明吡啶環上鍵的平均化程度較高,但沒有苯完全。
吡啶環上的碳原子和氮原子均以sp2雜化軌道相互重疊形成σ鍵,構成一個平面六元環。每個原子上有一個p軌道垂直於環平面,每個p軌道中有一個電子,這些p軌道側面重疊形成一個封閉的大π鍵,π電子數目為6,符合4n+2規則,與苯環類似。因此,吡啶具有一定的芳香性。氮原子上還有一個sp2雜化軌道沒有參與成鍵,被一對孤對電子所占據,使吡啶具有鹼性。吡啶環上的氮原子的電負性較大,對環上電子云密度分布有很大影響,使π電子云向氮原子上偏移,在氮原子周圍電子云密度高,而環的其他部分電子云密度降低,尤其是鄰、對位上降低顯著。所以吡啶的芳香性比苯差。
在吡啶分子中,氮原子的作用類似於硝基苯的硝基,使其鄰、對位上的電子云密度比苯環降低,間位則與苯環相近,這樣,環上碳原子的電子云密度遠遠少於苯,因此象吡啶這類芳雜環又被稱為“缺π”雜環。這類雜環表現在化學性質上是親電取代反應變難,親核取代反應變易,氧化反應變難,還原反應變易。
物理性質
無色或微黃色液體,有惡臭。
熔點(℃): -41.6
沸點(℃): 115.2
相對密度(水=1): 0.9827
折射率:1.5067(25℃)
相對蒸氣密度(空氣=1): 2.73
飽和蒸氣壓(kPa): 1.33/13.2℃
閃點(℃): 17
引燃溫度(℃): 482
爆炸上限%(V/V): 12.4
爆炸下限%(V/V): 1.7
燃燒熱(定壓)(KJ/mol):2826.51
(定容)(KJ/mol):2782.97
比熱容(21℃,定壓)(KJ/kg.K):1.64
臨界溫度(℃):346.85
臨界壓力(MPa):6.18
電導率(25℃)(μS/cm):4
熱導率(20℃)(W/m.K):0.182
黏度(15℃)(mPa.S):1.038
(20℃)(mPa.S):0.952
(30℃)(mPa.S):0.829
蒸發熱(25℃)(KJ/mol):40.4277
熔化熱(KJ/mol):7.4133
生成熱(液體)(KJ/mol):99.9808
偶極距:2.22D 吡啶為極性分子,其分子極性比其飽和的化合物——哌啶大。這是因為在哌啶環中,氮原子 只有吸電子的誘導效應(-I),而在吡啶環中,氮原子既有吸電子的誘導效應,又有吸電子的共軛效應(-C)。
溶解性: 溶於水和醇、醚等多數有機溶劑。吡啶與水能以任何比例互溶,同時又能溶解大多數極性及非極性的有機化合物,甚至可以溶解某些無機鹽類,所以吡啶是一個有廣泛套用價值的溶劑。吡啶分子具有高水溶性的原因除了分子具有較大的極性外,還因為吡啶氮原子上的未共用電子對可以與水形成氫鍵。吡啶結構中的烴基使它與有機分子有相當的親和力,所以可以溶解極性或非極性的有機化合物。而氮原子上的未共用電子對能與一些金屬離子如Ag、Ni、Cu等形成配合物,而致使它可以溶解無機鹽類。 與水形成共沸混合物,沸點92~93℃。(工業上利用這個性質來純化吡啶。)
光譜性質
(1)吡啶的紅外光譜(IR):芳雜環化合物的紅外光譜與苯系化合物類似,在3070~3020cm-1處有C—H伸縮振動,在1600~1500cm-1有芳環的伸縮振動(骨架譜帶),在900~700cm-1處還有芳氫的面外彎曲振動。
(2)吡啶的核磁共振氫譜(HNMR):吡啶的氫核化學位移與苯環氫(δ7.27)相比處於低場,化學位移大於7.27,其中與雜原子相鄰碳上的氫的吸收峰更偏於低場。當雜環上連有供電子基團時,化學位移向高場移動,取代基為吸電性時,則化學位移向低場移動。
(3)吡啶的紫外吸收光譜(UV):吡啶有兩條紫外光譜吸收帶,一條在240~260nm(ε=2000),相應於π→π*躍遷(與苯相近)。另一條在270nm的區域,相應於n→π*躍遷(ε=450)。
化學性質
吡啶及其衍生物比苯穩定,其反應性與硝基苯類似。典型的芳香族親電取代反應發生在3、5位上,但反應性比苯低,一般不易發生硝化、鹵化、磺化等反應。吡啶是一個弱的三級胺,在乙醇溶液內,能與多種酸(如苦味酸或高氯酸等)形成不溶於水的鹽。工業上使用的吡啶,約含1%的2-甲基吡啶,因此可以利用成鹽性質的差別,把它和它的同系物分離。吡啶還能與多種金屬離子形成結晶形的絡合物。吡啶比苯容易還原,如在金屬鈉和乙醇的作用下還原成六氫吡啶(或稱哌啶)。吡啶與過氧化氫反應,易被氧化成N-氧化吡啶。
(1)鹼性和成鹽
吡啶不但可與強酸成鹽,還可以與路易斯酸成鹽。
此外,吡啶還具有叔胺的某些性質,可與鹵代烴反應生成季銨鹽,也可與醯鹵反應成鹽。
(2)親電取代反應
吡啶是“缺π”雜環,環上電子云密度比苯低,因此其親電取代反應的活性也比苯低,與硝基苯相當。由於環上氮原子的鈍化作用,使親電取代反應的條件比較苛刻,且產率較低,取代基主要進入3(β)位。
與苯相比,吡啶環親電取代反應變難,而且取代基主要進入3(β)位,可以通過中間體的相對穩定性來說明這一作用。
由於吸電性氮原子的存在,中間體正離子都不如苯取代的相應中間體穩定,所以,吡啶的親電取代反應比苯難。比較親電試劑進攻的位置可以看出,當進攻2(α)位和4(γ)位時,形成的中間體有一個共振極限式是正電荷在電負性較大的氮原子上,這種極限式極不穩定,而3(β)位取代的中間體沒有這個極不穩定的極限式存在,其中間體要比進攻2位和4位的中間體穩定。所以,3位的取代產物容易生成。
(3)親核取代反應
由於吡啶環上氮原子的吸電子作用,環上碳原子的電子云密度降低,尤其在2位和4位上的電子云密度更低,因而環上的親核取代反應容易發生,取代反應主要發生在2位和4位上。
吡啶與氨基鈉反應生成2-氨基吡啶的反應稱為齊齊巴賓(Chichibabin)反應,如果2位已經被占據,則反應發生4位,得到4-氨基吡啶,但產率低。如果在吡啶環的α位或γ位存在著較好的離去基團(如鹵素、硝基)時,則很容易發生親核取代反應。如吡啶可以與氨(或胺)、烷氧化物、水等較弱的親核試劑發生親核取代反應。
(4)氧化還原反應
由於吡啶環上的電子云密度低,一般不易被氧化,尤其在酸性條件下,吡啶成鹽後氮原子上帶有正電荷,吸電子的誘導效應加強,使環上電子云密度更低,更增加了對氧化劑的穩定性。當吡啶環帶有側鏈時,則發生側鏈的氧化反應。

