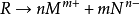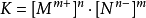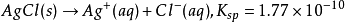離子積
形如這樣的一個電離方程式:
其中R為溶質,M和N分別為電離出來的
陽離子和
陰離子,其離子積可表示為:
與一般的平衡常數表達式相比,離子積常數的表達式少了關於反應物的項。這就限制了離子積常數隻適用於反應物是純液體或純固體的反應,因為在計算平衡常數時,純液體和純固體的
濃度視作1。
純液體的離子積
純液體的離子積一般用於
溶劑的自耦電離,如
水。水是一種極弱的電解質,它能
微弱地電離:
通常H3O簡寫為H。
水的離子積Kw=[H]·[OH],25度時,Kw=1×10^-14。溫度升高時,水的電離程度加大,Kw值也隨著上升。
難溶電解質的離子積
難溶電解質的離子積常數能很好地反映電解質的溶解程度,因此這一種常數又叫做
溶度積常數,符號為
Ksp。
即在25℃的AgCl的
飽和溶液中,銀離子濃度與氯離子濃度的乘積為1.77E-10。根據這一點,可以計算出AgCl的
溶解度。
在1“分子”
溶質電離出
離子數相同的情況下,K
sp越小的,
溶解度也越小。
水的離子積
原理
在一定溫度下,水中[H ]和[OH-]的乘積(Kw)是一個常數,這個常數叫做水的離子積(曾用名:
離子積常數)。水的離子積又叫水的自
電離常數,即為
水的電離[H2O(l) H +(aq) OH-(aq)]達到平衡後
平衡常數。
水是純液體,[H2O]可看作是一個常數,所以Kw=[H+ ][OH-]。Kw值跟溫度有關,在25℃,Kw=[H+ ][OH-]=1×10^-7×1×10^-7=1×10^-14。為了計算簡化,常常把這個值作為室溫下水的離子積。在物質的稀
水溶液中,[H2O]和純水的[H2O]幾乎相同,因此Kw也幾乎相等。這就是說,在任何酸性(或鹼性)溶液中,同時存在H 和OH-,只不過[H ]和[OH-]的相對大小不同而已。在
常溫下,[H +]和[OH-]的乘積等於1×10^-14。因此,水溶液的
酸鹼性只要用一種離子(H +或OH-)的濃度表示。
水是一種既能釋放
質子也能接受質子的
兩性物質。水在一定程度上也微弱地
離解,質子從一個
水分子轉移給另一個水分子,形成H3O+和OH-。
達到平衡時,可得水的離解常數Ki
或[H2O+][OH-]=Ki[H2O]
由於水的
離解度極小,[H2O]數值可以看作是一個常數,令K1[H2O]2等於另一新常數Kw,則
Kw稱為
水的離子積常數,簡稱水的離子積。上式表示在一定溫度時,水中
氫離子濃度與氫氧離子濃度的乘積為一常數(表3-1)。25℃時,由實驗測出在純水中[H3O+]和[OH-]各為1.0×10^-7mol/L。通常將
水合離子H3O+簡寫為H+,這樣,在常溫時:Kw=1.0×10^-7 × 1.0×10^-7=1.0×10^-14 [H+][OH-]=1.0×10^-14
離子積隨溫度變化
表3-1 不同溫度時水的離子積
溫度/℃ | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
離子積 | 1.2×10-15 | 3.0×10-15 | 6.8×10-15 | 1.0×10-14 | 1.5×10-14 | 2.9×10-14 | 5.5×10-14 | 9.6×10-14 | 1.6×10-13 | 2.5×10-13 | 3.8×10-13 | 5.5×10-13 |
由於水
離解時要吸收大量的熱,所以溫度升高,水的離解度和Kw也相應地增大。
水的離子積原理不僅適用於純水,也適用於一切稀的
水溶液。在任何稀的水溶液中,不論[H+]和[OH-]怎樣改變,它們的乘積總是小於等於Kw。
也就意味著有PH14的物質,當然前提是溫度足夠高。
溶液的PH值
PH值的引入
當向水中加入酸時,溶液中[H+]就會增大,設達到新的平衡時該溶液的[H+]為1.0×10-2mol/L,因[H+][OH-]=1.0×10-14,則
可見,在酸性溶液中,[H+]>1.0×10-7 mol/L,而[OH-]<1.0×10-7 mol·/L.
如果向純水中加入鹼時,溶液中[OH-]就會增大,設達到新的平衡時該溶液的[OH-]為1.0×10-2mol/L,同理計算出[H+]=1.0×10-12 mol/L。可見,在鹼性溶液中[OH-]>1.0×10-7mol/L,而[H+]<1.0×10-7 mol/L。由上述三種情況可知:
在
純水或
中性溶液中 [H+]=1.0×10-7 mol/L=[OH-]
在酸性溶液中[H+]>1.0×10-7 mol/L>[OH-]
在鹼性溶液中[H+]<1.0×10-7 mol/L<[OH-]
當然,[H+]或[OH-]都可用來表示溶液中的中性、酸性或
鹼性,但實際套用中多採用[H+]來表示。但是,在生物學與醫學上許多重要溶液的[H+]往往是一個很小的數值,而且帶有負指數,用[H+]表示溶液的
酸鹼性不方便。例如,人的血液[H+]為0.0000000398mol·L-1,即3.98×10-8 mol·L-1,血液究竟是酸性還是鹼性,不容易看清楚。索侖生(Sorensen)首先提出用PH值表示水溶液的酸鹼性。
PH值的定義
它的數學表示式為:pH=-lg[H+]
Pα+=lgαH+
必須注意,PH值每相差一個單位時,其[H+]相差10倍;PH值相差二個單位時,[H+]相差100倍;依此類推。
在純水或
中性溶液中, [H+]=1.0×10-7 mol/L PH=7
在酸性溶液中, [H+]>1.0×10-7 mol/L PH<7 ,PH越小,則酸性越強。
在鹼性溶液中, [H+]<1.0×10-7 mol/L PH>7,PH越大,則鹼性越強。
POH值的定義和二者關係
和PH相仿,[OH-]和KW也可用它們的負對數來表示,即
pOH=-lg[OH-]
pKw=-lgKw
由於在25℃時,[H+][OH-]=KW =1.0×10-14
-lg[H+]-lg[OH-]=-lgKw=-lg1.0×10-14
所以
pH+pOH=pKw=14
水溶液中[H+],[OH-],PH,
POH值與溶液
酸鹼性的關係如表3-2。
表3-2 [H+],[OH-],PH,POH值與溶液酸鹼性的關係
[H+] | 1 | 10-1 | 10-2 | 10-3 | 10-4 | 10-5 | 10-6 | 10-7 | 10-8 | 10-9 | 10-10 | 10-11 | 10-12 | 10-13 | 10-14 |
PH | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
[OH-] | 10-14 | 10-13 | 10-12 | 10-11 | 10-10 | 10-9 | 10-8 | 10-7 | 10-6 | 10-5 | 10-4 | 10-3 | 10-2 | 10-1 | 1 |
POH | 14 | 13 | 12 | 11 | 10 | 9 | 8 | 7 | 6 | 5 | 4 | 3 | 2 | 1 | 0 |
由左到右酸性逐漸減弱 鹼性逐漸增強
在實際套用中,PH值一般只限於0-14範圍內。當 [H+]或[OH-]大於1時,就不再採用PH值,而仍用[H+]或[OH-]表示溶液的
酸鹼性。
必須注意,用PH值表示的是溶液的
酸度或有效酸度而不是酸的濃度。酸度或有效酸度是指溶液中H+濃度,嚴格地說是指H+的
活度,是指已
離解部分酸的濃度。酸的濃度也稱總酸度或
分析濃度,它是指在1升溶液中所含酸的
物質的量,包括已離解和未離解兩部分酸的總濃度,其大小要用
滴定分析來確定。酸度或有效酸度則用
PH試紙或
PH計來測定。
潛在酸度是指未離解部分的濃度,即總酸度與有效酸度之差。例如,0.01mol·L-1HCL和0.01 mol·L-1HOAc的濃度相同,但有效酸度不同。0.01 mol·L-1HCL溶液總酸度為0.01mol·L-1,其有效酸度[H+]也是相同數值,25℃時,總酸度為0.01 mol·L-1的HOAc溶液,其有效酸度[H+]則僅為4.2×10-4mol·L-1。
試題舉例
例1 分別求出0.1mol.L-1
HCl溶液和0.01mol.L-1 HOAc溶液(
註:Ac是乙醯基(結構為-COCH3,完整的單詞為acetyl))的pH值,已知其[H+]分別為0.01mol.L-1和4.2*10-4mol.L-1。
解:HCl溶液的pH=-lg0.01=-lg10-2=2.0
HOAc溶液的pH=-lg(4.2*10-4)
=[0.62+(-4)]
=3.38
例2 已知某溶液的pH=4.60,計算該溶液的
氫離子濃度。
解:-lg[H+]=pH=4.60
lg[H+]=-4.60=-5+0.40
[H+]=2.512*10-5mol.L-1
一些弱酸弱鹼的離子積常數(常溫)
弱酸
醋酸 Ka=1.76×10^-5;
Kb=5.68×10^-10
Ka2=5.61×10^-11
Ka2=6.23×10^-8
Ka3=2.2×10^-13
Kb1=1.33×10^-12
Kb2=1.6 ×10^-7
Kb3=4.54×10^-2
草酸 Ka1=3.5×10^-2 Ka2=4×10^-6
(註:Ka與Kb的積是Kw)
弱鹼
一水合氨 Kb=1.8×10^-5
註:10-X及10^-X 表示10的負X次冪
溶度積與離子積的區別
1、固體物質的溶解度是指在一定的溫度下,某物質在100克溶劑里達到飽和狀態時所溶解的克數。在未註明的情況下,通常溶解度指的是物質在水裡的溶解度。氣體的溶解度通常指的是該氣體(其壓強為1
標準大氣壓)在一定溫度時溶解在1體積水裡的體積數。
2、難溶電解質在水中會建立一種特殊的動態平衡。 儘管難溶電解質無法溶解,但仍有一部分陰陽離子進入溶液,同時進入溶液的陰陽離子又會在固體表面沉積下來。當這兩個過程的速率相等時,難溶電解質的溶解就達到平衡狀態,固體的量不再減少。 這樣的平衡狀態叫沉澱溶解平衡,其平衡常數叫溶度積。
3、濃度指某物種在總量中所占的分量。