基本介紹
- 中文名:離子水合作用
- 外文名:ion hydration 或 hydration of ions
- 所屬學科:化學
- 作用類型:離子-偶極作用
- 作用對象:水分子、離子
- 形成的結構:離子對、水分子包圍離子
引言
結合方式
離子對
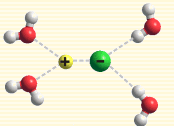
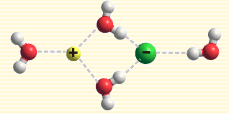
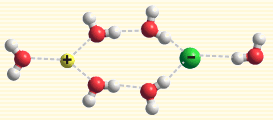
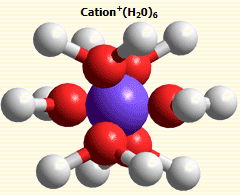
水分子包圍離子
焓變
- 正負離子被拉開,這個過程中焓升高;
- 水分子與水分子之間的吸引變弱,這個過程中焓升高;
- 水分子和離子結合,這個過程中焓降低。
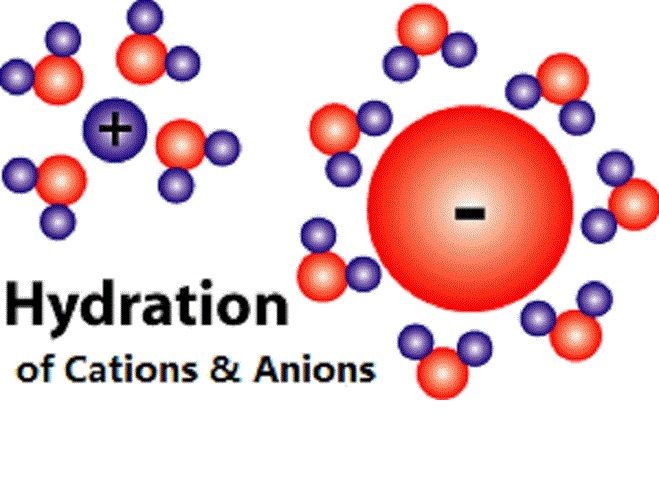




離子水合作用指的是離子和水分子之間的靜電作用(屬於離子-偶極作用)。當離子進入水中時,這種靜電作用就使水分子朝離子圍攏過來,最終使水分子與離子以特定的方式結合——以離子對的形式或水分子包圍離子的形式。離子水合作用可使體系...
離子水合是指離子與水分子相互作用並在離子周圍形成水化膜的過程。在電解質水溶液中,離子帶有正電荷或負電荷,而水分子為極性分子,它們之間必然存在靜電引力。當水分子與離子間相互作用能大於水分子間的氫鍵鍵能時,水的結構就遭到破壞,...
水合作用(Hydration)溶質的分子或離子與溶劑的分子相結合的作用稱為溶劑化作用,生成水合分子(水合離子),這一過程放出熱量。對於水溶液來說,這種作用稱為水合作用,大部分屬於化學變化,但是水合作用下如果過程中只有離子鍵的斷裂,而...
水合反應( hydrated reaction),也叫作水化。是無機化學中指物質溶解在水裡時,與水發生的化學作用。一般指溶質分子(或離子)和水分子發生作用,形成水合分子(或水合離子)的過程。例子 如無水硫酸銅與水作用生成五水硫酸銅:CuSO₄...
初級水合水是靠配位鍵與離子成鍵(因此,稱為化學水合),結合牢固,此水分子失去平動自由度,常伴隨離子一起移動,此即水合配離子。次級水合水是通過靜電作用(離子一偶極作用)在水合配離子上再結合的水分子。由於相距較遠,結合力...
分子或離子與水結合而形成水合物或水合離子的過程。物質在水中的溶解或離解,主要是通過水化而引起的。在有機化學中也指分子中不飽和鍵在催化劑作用下與水分子化合的反應。如乙烯與水化合成乙醇。又稱水合。水與另一物質分子化合成為...
離子水不包括生理鹽水等添加有其他物質的水。簡介 失去電子或得到電子原子和分子稱離子。水在電離時會產生水合離子,我們稱這種水為離子水。離子水可分為正離子水和負離子水,負離子水亦稱飲用離子水,正離子水亦稱美容(消炎)離子水。...
水在電離時會產生水合離子,我們稱這種水為離子水。離子水可分為正離子水和負離子水,負離子水亦稱飲用離子水,正離子水亦稱美容(消炎)離子水。無論是正離子水還是負離子水,其本質還是水,除了電子得失和物理、化學性質發生極大變化...
水化數(hydration number),水合作用術語。水化層中水分子的數目。hydration number 在溶液中的離子,其靜電力可影響它附近的水結構。在緊鄰離子的周圍形成原水化層,其中的水分子(偶極子)圍繞中心離子按電場方向排列,可隨中心離子一起...
這種相互作用造成氫上的部分正電荷增加,使得配位水分子酸性變得更強。根據電荷轉移的規模,建立如下的水解平衡:上述平衡顯示了非絡合水介質中三種類型的配體:水合離子、羥基、和氧橋配體。水解度取決於幾個因素,包括電荷密度和金屬電負性...
水合數是指在溶液中與離子締合的水分子數。在一級(原)水合層中與離子牢固締合的水分子數稱為一級水合數或原水合數。有多種方法可以得到離子水合數。例如,當離子在電場中移動時,總是有一水合殼隨其一起移動,根據該水合殼的體積...
有些金屬元素的水合離子又能同水分子發生質子傳遞反應,即羥基化作用(或水解作用),生成以羥基為配位體的絡合物。在這些絡合物中有的形成單核的羥基絡合物,有的則生成多核的。在金屬離子中除第一、二主族元素的金屬離於與羥基結合的...
《兩性離子多肽前藥基的納米藥物傳遞系統》是依託浙江大學,由袁哲凡擔任項目負責人的青年科學基金項目。項目摘要 將靶向型兩性離子多肽前藥與疏水鏈段通過“頭-頭”相連的方式製備模型前藥。前藥經自組裝技術形成納米粒子,以兩性離子水合...
由於靜電的作用,在結垢系統中能破壞分子間的電子結合力,改變晶體結構,促使硬垢疏鬆,並且會增大水偶極子的偶極距,增強其與鹽類離子的水合能力,從而提高水垢的溶解速率,使已經產生的水垢能逐漸剝蝕、脫落,從而達到除垢之目的。3.殺菌...
水合作用的實質是水分子整體進入礦物晶格,從而使礦物體積增大的作用。疏水水合作用水中存在非極性分子時,水的氫鍵網會發生重排。為了保證氫鍵的數目,水分子會在非極性溶質表面有序的形成籠狀排列。形成多面體(十二面體)水籠。這些多面體...
陰離子交換是指土壤或礦物中帶正電荷的膠體表面吸附的陰離子與溶液中陰離子的可逆交換作用。通常這種交換作用遵守質量作用定律。土壤中的水合氧化物表面與層狀矽酸鹽礦物邊面斷鍵處帶有正電荷,根據雙電層理論,為了保持電中性,在這些正...
水合氫離子指的是氫離子被水分子吸引生成的物質,通常用H₃O⁺表示。所以水的電離可以用以下方程式表示2H₂O=H₃O⁺+OH⁻。水合氫離子是最簡單的氧鎓(釒羊)(Oxonium)。氫原子在失去電子後,剩餘由1個質子構成的核,即...
常用的離子締合物萃取體系 (1)金屬陽離子的離子締合物 水合金屬陽離子與適當的配位劑作用,形成沒有或很少配位水分子的配陽離子.然後與陰離子締合,形成疏水性的離子締合物。(2)金屬配陰離子或無機酸根的離子締合物 許多金屬離子能...
ionic hydration 離子水化 ; 離子水合作用 ; [無化] 離子水合 ; 離子水化作用 direct hydration 直接水合 ; 直接水合法 hydration catalyst 水合催化劑 selective hydration 選擇性水化 Topochemical hydration 局部水化 hydration systems ...
鹽析結晶是指在鹽溶液體系中,加入某種電解質鹽析劑, 這種加入的鹽析劑,其離子的水合作用比原溶液中其它鹽較強, 它使溶液中自由水分子數減小,從而提高溶液中欲結晶物質在溶液中的有效濃度,使欲結晶物質在溶液中結晶析出, 這就是...
④水的電滲析,由於離子的水合作用和形成雙電層,在直流電場作用下,水分子也可從淡化室向濃縮室遷移;⑤水的極化電離,有時由於工作條件不良,會強迫水電離為氫離子和氫氧根離子,它們可透過交換膜進入濃縮室;⑥水的壓滲,由於濃縮室...
其實對於強電解質來說,溶解和電離是難以截然分開的,因為離子的擴散就是電離。不過對於弱電解質說來,首先是擴散成分子(吸熱),然後在水分子作用下,化學鍵被破壞而電離成為自由離子(水合的)(這裡總體表現是吸熱還是放熱要看破壞化學...
正是水結構的易變性及氫鍵網路把水分子聚集在一起的集團作用,賦予水一系列對生命具有重要意義的特性。因素 1、無機離子:生命體系中大量存在的無機離子的靜電荷,使水分子圍繞其周圍徑向排列,形成有序的離子水化層。有序度隨距離增大...
在缺乏礦物質的啤酒釀造液中會加入氯化鈣,因為鈣離子是啤酒釀造過程中最具影響性的礦物質之一,它會影響麥芽汁的酸性並對酵母作用的發揮起到影響。而且氯化鈣能給釀造出的啤酒帶來甜味。其他方面 水合氯化鈣固體可作為相變儲能材料使用。...
由此可知,極化能力很弱的陽離子如第一主族的金屬離子Li⁺、Na⁺、K⁺、Rb⁺、Cs+和第二主族的金屬離子Ca、Sr、Ba不能使水分子的O―H鍵斷裂,因此通常說這些離子不發生水解反應,而只以水合離子的形式存在於水溶液中。強酸...
正是水結構的易變性及氫鍵網路把水分子聚集在一起的集團作用,賦予水一系列對生命具有重要意義的特性。影響因素 無機離子 生命體系中大量存在的無機離子的靜電荷,使水分子圍繞其周圍徑向排列,形成有序的離子水化層。有序度隨距離增大而...
對於金屬元素而言,其電極電勢是處於基態的原子與水溶液中的水合離子的電勢差。它的大小取決於金屬原子離子化的傾向及其它因素。由金屬晶體到水合離子有三個過程:一、金屬由固態轉變為氣態原子, 其升華熱為S ;二、金屬氣態原子失去電子,...
