基本介紹
- 中文名:陽極極化曲線
- 外文名:anodic polarization curve
- 領域:電子工程
- 表示方式:EA°—A
分類
- 濃差極化
- 歐姆極化
- 活化極化
極化曲線的測定
恆電位法
靜態法
動態法
恆電流法
電極
電勢
電流密度

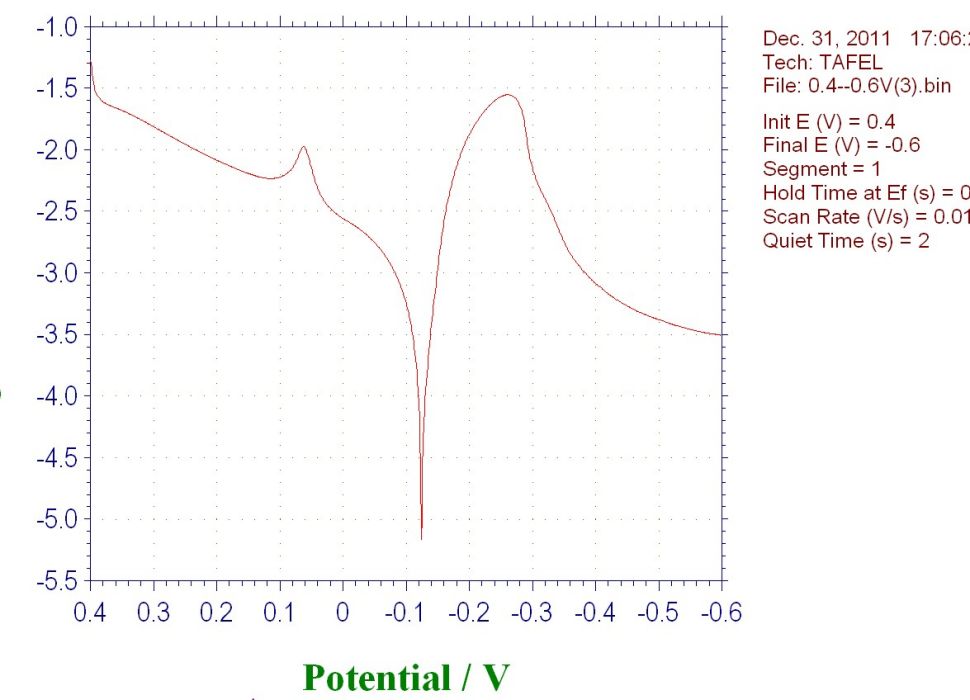

陽極極化曲線表示陽極電極電位(E)與陽極電極上電流密度(i)之間變化關係的曲線。EA°—A表示陽極極化曲線,電位向正的方向變化。EC°—C表示陰極極化曲線,電位向負的方向變化。極化曲線愈陡,說明電位偏移程度愈大,極化愈強...
極化曲線法又稱塔菲爾(Tafel)線外推法,是測定腐蝕速率的方法。英文名稱:method of polarization curve 說明:一種測定腐蝕速率的方法。做法是將金屬樣品製成電極浸入腐蝕介質中,測量穩態的伏安(E~I)數據,作log|I|~E圖,將陰、陽極極化曲線的直線部分延長,所得交點對應的即為logIcor,由腐蝕電流Icor除以事先...
6.1.2 電極極化 6.2 電化學腐蝕的測定方法 6.2.1 腐蝕速度電化學測量方法 6.2.2 極化曲線的測量 6.2.3 電化學腐蝕的測定 6.3 氧化鋁濃度和分子比對電化學腐蝕的影響 6.3.1 陽極極化曲線特徵 6.3.2 A12O3濃度對金屬陽極電化學腐蝕的影響 6.3.3 分子比金屬陽極電化學腐蝕的影響 6.3.4 添加元素...
極化電阻是極化曲線在△E=0(即在腐蝕電位Ecorr處)切線的斜率。定義 某一電位下極化電阻是極化曲線在該電位處切線的斜率。線性極化電阻只適用於極化曲線線性區域的極化測量。電極上有(淨)電流流過時,電極電勢偏離其平衡值,此現象稱作極化。根據電流的方向又可分為陽極化和陰極化。極化是指腐蝕電池作用一經開始...
強極化腐蝕速度測定、trong oiarixation corrosion ratemeasurement將金屬在電解質溶液中的極化曲線外推測定金屬腐蝕速度的一種電化學方法。對於活化控制的腐蝕體系。根據極化電流.與電位之間的塔菲爾關係,經變換可得:igfa-lglk } (}.一Ek)/6a;lgl}=1glk t [F:一F )}r.}。式中I。和I,.分別為陽極和陰極極化...
大多數金屬在中性和鹼性溶液中,以及少數正電性金屬在含有溶解氧和弱酸性溶液中的腐蝕,都屬於氧去極化腐蝕。(2)如果腐蝕金屬在溶液中的電位較負,並處於活性溶解狀態,而氧的傳輸速度又有限,則金屬腐蝕速度將由氧的極限擴散電流密度大小所決定,陽極極化曲線和陰極極化曲線相交在氧的擴散控制區。因此,在一定的電位...
陽極保護是指將被保護金屬作為陽極,進行陽極氧化而使金屬鈍化的保護方法。陽極保護的關鍵是建立和保持鈍態,因此不是陽極極化曲線具有明顯的鈍化特徵的腐蝕體系都一定能實現陽極保護,還必須對陽極保護的主要參數進行分析。定義 將被保護的金屬設備與外加直流電源的正極相連,在一定的電解質溶液中將金屬進行陽極極化達到...
腐蝕極化圖 腐蝕極化圖指的是把腐蝕電池中,陰陽極過程理論極化曲線繪製在同一個電位一電流坐標上作出的圖。套用:從該圖中可以定出該體系的腐蝕電位和最大的腐蝕電流。從陰陽極的起始電位差值可說明腐蝕傾向。從曲線斜率大小可說明腐蝕反應的難易程度,分析腐蝕控制因素。腐蝕極化圖解分析是腐蝕研究中的重要手段。
為增大陽極接觸面積,採用經常清筐,使電解過程中破裂下來的WC片及時去除,避免影響導電性。腐蝕過程 如圖《活化-鈍化腐蝕過程》為活化一鈍化金屬如鐵、鉻、鎳及其合金在一定介質中採用恆電位法測得的典型陽極極化曲線示意圖。它標誌了金屬活化、鈍化的各特性點和特性區。由圖可知,從金屬的腐蝕電位E起,隨著電位增加...
套用 測定陽極極化曲線一般要用恆電位法。因為在測陽極極化曲線的時候,有可能陽極會出現鈍化現象的,這樣的話就會有相同電流下不同的電位,即不是單值函式。改成恆電流就看不到這種鈍化現象的出現,表征出來的曲線就不能反應真實的電極過程。因此在測可鈍化金屬的極化曲線時應採用恆電位法,不能用恆電流法。
鈍化曲線 各種金屬電化學鈍化的難易,可以通過測定其鈍化曲線即陽極極化曲線來確定。圖示為恆電位法穩態側定的典型的金屬陽極極化曲線。曲線的AB段表明,電流(金屬的電化溶解速度)隨極化電位的提高而增大,金屬正常電化溶解。當極化電位提高超過B點時,電流反而陡降至C點,這說明金屬已發生鈍化。在CD段里,金屬始終...
用電化學方法也可以使金屬鈍化, 把金屬作為陽極, 加上適當電壓, 陽極電勢就向正的方向移動, 如同時記錄其電流變化, 即可得到陽極極化曲線(如下圖1:陽極極化曲線圖所示)。在曲線AB段上金屬出現正常的陽極溶解;當電勢達到B點時,由於在金屬表面上開始形成鈍化膜(一般是氧化膜或氧的吸附層, 金屬溶解速度隨...
極化曲線 表示電極電位與極化電流或極化電流密度之間的關係曲線。如電極分別是陽極或陰極,所得曲線分別稱之為陽極極化曲線(anodic polarization curve)或陰極極化曲線(cathodic polarization curve)。超電位的套用 超電位的存在提高電解槽電壓,從而增大電耗,是其不利的一面,但某些電化冶金生產過程,如典型的有鋅電解...
可以推算這兩種金屬連線在一起時的電偶腐蝕。測量陰極區和陽極區的極化,可以研究局部腐蝕。測量腐蝕系統的陰、陽極極化曲線,可以指示腐蝕的控制因素、緩蝕劑的作用類型等。在電極過程動力學的基礎研究方面,從極化曲線可以推算交換電流、速率常數、擴散係數。從曲線斜率可推算參與反應的電子數,進而研究反應機理。
低碳鋼在熱濃鹼溶液中應力腐蝕斷裂機理屬於沿晶陽極溶解型,活化途徑是預先存在的,由於介質的濃度及溫度使這種鋼的陽極極化曲線如圖1所示,應力腐蝕斷裂電位位於活化一鈍化轉變的範圍內。鹼脆的物理圖像如圖2所示,必須有垂直於裂紋的拉應力存在,才能使膜破壞而使裂紋尖端位於活化區。在實驗室進行熱濃鹼液的應力腐蝕...
陽極鈍化電位 陽極鈍化電位對黃銅表面鈍化膜半導體性能的影響 目的:研究黃銅在不同陽極鈍化電位下形成的鈍化膜的半導體性能。方法:通過動電位極化曲線獲取黃銅在硼酸鹽緩衝溶液中的維鈍電位區間,並選取3個鈍化電位值對黃銅進行鈍化處理,採用電化學阻抗譜和Mott-Schottky半導體理論研究陽極鈍化電位對鈍化膜半導體性能的影響...
3.1 金氰化溶解的陽極過程動力學特性 3.1.1 陽極極化曲線 3.1.2 氰化物濃度的影響 3.1.3 pH的影響 3.1.4 溫度的影響 3.1.5 電極轉速的影響 3.2 氧在金電極上陰極還原的動力學特性 3.2.1 氧的陰極還原反應 3.2.2 pH的影響 3.2.3 氧濃度的影響 3.2.4 溫度的影響 3.2.5 電極轉速的...
可抑制氫氣的析出。解超電勢的含義和塔費爾方程。塔費爾方程 是計算1Gr18Nil2Mo2Ti不鏽鋼在H_3PO_4體系中腐蝕速度,以及CT、廠對腐蝕速度的影響,採用的介質是摸擬濕法磷酸生產溶液,測定了該材料在四種不同溶液中的陽極極化曲線,確定了塔費爾方程中的a,B係數和電極過程的動力學基本參數α,β及自腐電流i_(corr)
實驗11 陰極陽極極化曲線的測定 實驗12 一級反應速率常數的測定——蔗糖的轉化 實驗13 乙酸乙酯皂化反應速率常數及反應活化能的測定 實驗14 丙酮碘化反應速率常數的測定 實驗15 B-Z化學振盪反應 實驗16 溶液表面張力的測定 《實驗1液體飽和蒸汽壓的測定》課後作業 《實驗2 凝固點降低法測定物質的相對分子質量》課後...
實驗7 電化學綜合實驗一 陽極極化曲線的測量 實驗8 電化學綜合實驗二 電化學交流阻抗譜的測定 實驗9 雷諾實驗 實驗10 流體能量的轉換——伯努利方程 實驗11 流體力學綜合實驗一 離心泵特性測定 實驗12 流體力學綜合實驗二 流體流動阻力測定 實驗13 邊界層實驗 實驗14 流體流速和流量的測量及畢託管校正實驗 實驗15 ...
晶間腐蝕試驗 (intergranular corrosion test)在特定介質條件下檢驗金屬材料晶間腐蝕敏感性的加速金屬腐蝕試驗方法,目的是了解材料的化學成分、熱處理和加工工藝是否合理。其原理是採用可使金屬的腐蝕電位處在恆電位陽極極化曲線特定區間的各種試驗溶液,利用金屬的晶粒和晶界在該電位區間腐蝕電流的顯著差異加速顯示晶間腐蝕...
(1)金屬腐蝕是腐蝕體系中陰、陽極共軛反應的結果。對於一個可能鈍化的金屬腐蝕體系,金屬的腐蝕電位能否落在鈍化區,不僅取決於陽極極化曲線上鈍化區範圍的大小,還取決於陰極極化曲線的形狀和位置。(2)金屬在腐蝕介質中自鈍化的難易程度不僅與金屬本性有關,同時還受金屬電極上還原過程的條件所控制,較常見的有電...
陽極保護主要用於保護鋼、不鏽鋼和鈦等在濃硫酸和磷酸等強介質中的腐蝕。活性-鈍性金屬在陽極極化時,即電流導入而產生電位變化時,其極化曲線中有顯著的活化、鈍化和過鈍化區(見圖),對於這種情況,可利用穩壓電源將電位控制在鈍化區間,使腐蝕電流值降到最低限度。選擇材料 適用於罐體保護的犧牲陽極一般選擇電流...
不同溫度離子滲氮後的陽極極化曲線(NaCI的質量分數為3%),如圖1所示,經500℃×10h滲氮,即能提高腐蝕電位,而450℃滲氛時,Cr的氮化物析出被抑制,而形成含有無特徵的“S-相”單相層,比未處理的不鏽鋼有更寬的純化電位,具有優良的耐腐蝕性能,而且硬度高(約1600HV),可獲得同時改善耐磨和耐蝕的滲氮層,該...
實驗30陽極極化曲線的測定75 實驗31陰極極化曲線的測定78 實驗32電位-pH曲線的測定80 實驗33氫超電位的測定83 實驗34電動勢法測定化學反應的熱力學函式變化值85 第4章表面及膠體88 實驗35電導法測定表面活性劑的臨界膠束濃度88 實驗36溶液吸附法測定矽膠比表面90 實驗37活性炭比表面的測定91 實驗38溶液表面張力的...
實驗三 線性極化法測定金屬腐蝕速度 實驗四 電阻法測定金屬腐蝕速度 實驗五 充電曲線法測定金屬的腐蝕速度 實驗六 鈍化金屬陽極極化曲線的測定 實驗七 恆電流法測定陰極極化曲線 實驗八 電偶腐蝕中電位序的測定 實驗九 緩蝕劑的評選及緩蝕效率測定 實驗十 極化曲線法評選緩蝕劑 實驗十一 線性極化法評定緩蝕...
實驗31陽極極化曲線的測定73 實驗32陰極極化曲線的測定75 實驗33電位pH曲線的測定77 實驗34氫超電位的測定80 實驗35電動勢法測定化學反應的熱力學函式變化值82 第4章表面及膠體85 實驗36電導法測定水溶液表面活性劑的臨界膠束濃度85 實驗37溶液吸附法測定矽膠比表面87 實驗38溶液表面張力的測定88 實驗39黏度法測定...
實驗2.10陽極極化曲線的測定 實驗2.11表面活性劑臨界膠束濃度CMC的測定 實驗2.12最大泡壓法測定溶液表面張力 實驗2.13蔗糖水解反應速率常數的測定 實驗2.14乙酸乙酯皂化反應速率常數的測定 實驗2.15氫氧化鐵溶膠的製備與電泳 實驗2.16磁化率的測定 實驗2.17B-Z振盪反應 第3章基本測量原理與技術 3.1溫度的測量...
