活化-鈍化腐蝕是一種陽極鈍化過程,陽極鈍化是作為陽極的金屬或化合物在電流作用下,不同程度地失去轉入溶液的能力。一般認為陽極鈍化是陽極表面生成一層緻密的氧化物(或其他化合物)薄膜,這層薄膜覆蓋著金屬,隔離了陽極與溶液,阻礙了金屬的繼續氧化溶解,但它仍具有導電作用。
基本介紹
- 中文名:活化-鈍化腐蝕行為
- 外文名:Activation-passivation corrosion behavior
- 所屬學科:電化學
- 實質:陽極鈍化過程
反應簡介
腐蝕過程
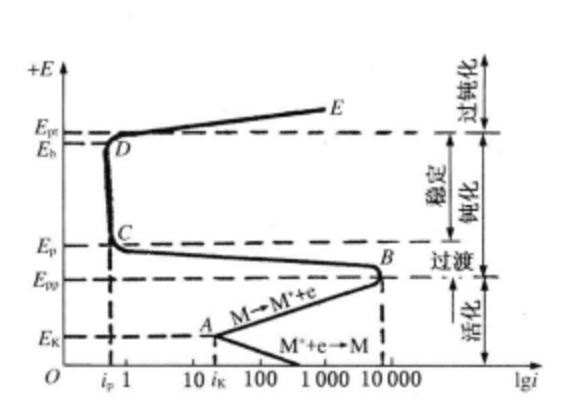

活化-鈍化腐蝕是一種陽極鈍化過程,陽極鈍化是作為陽極的金屬或化合物在電流作用下,不同程度地失去轉入溶液的能力。一般認為陽極鈍化是陽極表面生成一層緻密的氧化物(或其他化合物)薄膜,這層薄膜覆蓋著金屬,隔離了陽極與溶液,阻礙了金屬的繼續氧化溶解,但它仍具有導電作用。

活化-鈍化腐蝕是一種陽極鈍化過程,陽極鈍化是作為陽極的金屬或化合物在電流作用下,不同程度地失去轉入溶液的能力。一般認為陽極鈍化是陽極表面生成一層緻密的氧化物(或其他化合物)薄膜,這層薄膜覆蓋著金屬,隔離了陽極與溶液,阻礙...
鈍化後金屬的腐蝕速度有大幅度的降低,體現鈍態下金屬具有耐蝕性高的特性。陽極鈍化和化學鈍化本質上是一樣的,因為這些現象的發生都是由於在原先活化溶解著的金屬表面發生了某種突變,這種突變使得陽極溶解過程不再服從塔菲爾規律,其溶解...
金屬在酸性溶液中的陽極鈍化,是由於外加電流使金屬由活化態進入鈍化態。但是在腐蝕過程中,人們十分重視在沒有任何外加極化的情況下,金屬表面上產生的自鈍化現象及其發生條件。這種鈍化是由於腐蝕介質中氧化劑(去極化劑)的還原引起的,...
金屬表面的薄膜就是鈍化膜。一些金屬或合金在活化電位處或者在弱陽極極化情況下出現一層簡單阻礙層從而降低了腐蝕速率,根據鈍化的定義這種情況不屬於鈍化。鈍化膜結構非常薄,厚度測量在1~10 nm之間。鈍化現象 由於陽極反應受到阻礙而使...
《根際環境中五氯酚存在形態及活化/鈍化作用機制研究》是依託浙江大學,由汪海珍擔任項目負責人的青年科學基金項目。項目摘要 以五氯酚(PCP)為目標污染物,對根際環境中有機農藥污染物殘留特性、存在形態、遷移轉化和結合機理等展開深入研究...
陽極保護與覆蓋層保護聯合使用,只需要鈍化覆蓋不嚴的地方,臨界鈍化電流大大減小,投資費用大大減少;由於陽極面積大大減小,活化後重新鈍化也容易。陽極保護與緩蝕劑聯合保護,能降低臨界電流密度,減少投資費用。例如硝酸銨、尿素混合液中...
第一,證實了弱磁場是一種具有廣闊套用前景的活化已鈍化零價鐵活性的方法。無外置弱磁場條件下,不同條件製備的老化鐵除Se(IV)的反應活性呈現不同程度的降低或升高。外置弱磁場能夠提升對應體系反應速率,提升倍數達到4.6-39.6倍。此...
3.5 濃差極化控制下的腐蝕動力學方程式 3.6 腐蝕速度的電化學測定方法 3.7 混合電位理論的套用 第4章 析氫腐蝕與吸氧腐蝕 4.1 析氫腐蝕 4.2 吸氧腐蝕 第5章 金屬的鈍化 5.1 鈍化現象與陽極鈍化 5.2...
3.5.1再活化傾向和弗萊德(Flade)電位052 3.5.2過鈍化052 3.5.3氯離子對鈍化膜的破壞053 3.5.4實驗電位-pH圖054 思考題與習題054 第4章局部腐蝕055 4.1概述055 4.2電偶腐蝕056 4.2.1電偶腐蝕傾向與電偶序057 4.2.2...
在腐蝕初期,腐蝕產生的Sn4+水解會促進點蝕的生長。在腐蝕後期,鋼中裸露的析出物以及Cu2+增多,基體表面Cu還原沉積導致陰極活化,促進陽極基體發生鈍化反應,使腐蝕過程得到抑制。此外,鐵素體不鏽鋼晶粒尺寸過小或過大都將使含Cu、Sn鐵...
通過提高可鈍化金屬的電位使其進入鈍態而達到保護目的的,稱為陽極保護。陽極保護是利用陽極極化電流使金屬處於穩定的鈍態,其保護系統類似於外加電流陰極保護系統,只是極化電流的方向相反。只有具有活化 - 鈍化轉變的腐蝕體系才能採用陽極...
研究了酸性介質中碳鋼在NO2-作用下活化-鈍化轉變與晶界溶解的關係。Q235、L80、N80和X65碳鋼在HNO3-NaNO2溶液、HAc-NaNO2溶液、HCl-NaNO2溶液和CO2-NaNO2溶液中活化-鈍化轉變與晶界溶解之間的關係密切,晶界溶解是H+和NO2-共同作用的...
