物理性質
利用重結晶可提純固體物質。某些金屬或合金重結晶後可使
晶粒細化,或改變晶體結晶,從而改變其性能。
提純法
實驗目的
1、 學習重結晶法提純固體
有機化合物的原理和方法。
2、 掌握抽濾、熱過濾操作和菊花形濾紙的摺疊方法。
實驗原理
意義:從有機合成反應分離出來的固體粗產物往往含有未反應的原料、副產物及雜質,必須加以分離純化,重結晶是分離提純純固體化合物的一種重要的、常用的分離方法之一。
原理:利用混合物中各組分在某種溶劑中溶解度不同或在同一溶劑中不同溫度時的溶解度不同而使它們相互分離。
固體有機物在溶劑中的溶解度隨溫度的變化易改變,通常溫度升高,溶解度增大;反之,則溶解度降低。對於前一種常見的情況,加熱使溶質溶解於溶劑中,當溫度降低,其溶解度下降,溶液變成過飽和,從而析出結晶。由於被提純化合物及雜質的溶解度的不同,可以分離純化所需物質。
適用範圍:它適用於產品與雜質性質差別較大、產品中雜質含量小於5 %的體系。
儀器和藥品
一般過程
重結晶提純法的一般過程:
選擇溶劑 溶解固體 趁熱過濾去除雜質 晶體的析出
晶體的收集與洗滌 晶體的乾燥
1、溶劑選擇
在進行重結晶時,選擇理想的溶劑是一個關鍵,理想的溶劑必須具備下列條件:
(1)不與被提純物質起化學反應。
(2)在較高溫度時能溶解多量的被提純物質;而在室溫或更低溫度時,只能溶解很少量的該種物質。
(3)對雜質溶解非常大或者非常小(前一種情況是要使雜質留在母液中不隨被提純物晶體一同析出;後一種情況是使雜質在熱過濾的時候被濾去)。
(4)容易揮發(溶劑的沸點較低),易與結晶分離除去。
(5)能結出較好的晶體。
(6)無毒或毒性很小,便於操作。
(7)價廉易得。
經常採用以下試驗的方法選擇合適的溶劑:
取0.1g目標物質於一小試管中,滴加約1mL溶劑,加熱至沸。若完全溶解,且冷卻後能析出大量晶體,這種溶劑一般認為可以使用。如樣品在冷時或熱時,都能溶於1mL溶劑中,則這種溶劑不可以使用。若樣品不溶於1mL沸騰溶劑中,再分批加入溶劑,每次加入0.5mL,並加熱至沸。總共用3mL熱溶劑,而樣品仍未溶解,這種溶劑也不可以使用。若樣品溶於3mL以內的熱溶劑中,冷卻後仍無結晶析出,這種溶劑也不可以使用。
2、固體物質的溶解
原則上為減少目標物遺留在母液中造成的損失,在溶劑的沸騰溫度下溶解混合物,並使之飽和。為此將混合物置於燒瓶中,滴加溶劑,加熱到沸騰。不斷滴加溶劑並保持微沸,直到混合物恰好溶解。在此過程中要注意混合物中可能有不溶物,如為脫色加入的活性炭、紙纖維等,防止誤加過多的溶劑。
溶劑應儘可能不過量, 但這樣在熱過濾時,會因冷卻而在漏斗中出現結晶, 引起很大的麻煩和損失。綜合考慮,一般可比需要量多加20%甚至更多的溶劑。
3、雜質的除去
熱溶液中若還含有不溶物,應在熱水漏斗中使用短而粗的玻璃漏斗趁熱過濾。過濾使用菊花形濾紙。溶液若有不應出現的顏色,待溶液稍冷後加入活性炭,煮沸5分鐘左右脫色,然後趁熱過濾。活性炭的用量一般為固體粗產物的1%-5%。
4、晶體的析出
將收集的熱濾液靜置緩緩冷卻 (一般要幾小時後才能完全),不要急冷濾液,因為這樣形成的結晶會很細、表面積大、吸附的雜質多。有時晶體不易析出,則可用玻棒摩擦器壁或加入少量該溶質的結晶,引入晶核,不得已也可放置冰櫃中促使晶體較快地析出。
5、晶體的收集和洗滌
把結晶通過抽氣過濾從母液中分離出來。濾紙的直徑應小於布氏漏斗內徑!!抽濾後打開安全瓶活塞停止抽濾,以免倒吸。用少量溶劑潤濕晶體,繼續抽濾,乾燥。
6、晶體的乾燥
純化後的晶體,可根據實際情況採取自然晾乾,或烘箱烘乾。
實驗內容
實驗步驟
將3 g粗製的乙醯苯胺及計量的水加入250mL的三角燒瓶中,加熱至沸騰,直到乙醯苯胺溶解(若不溶解可適量添加少量熱水,攪拌並熱至接近沸騰使乙醯苯胺溶解)。取下燒瓶稍冷後再加入計量的活性炭於溶液中,煮沸5-10分鐘。趁熱用熱水漏斗和菊花濾紙進行過濾,用一燒杯收集濾液。在過濾過程中,熱水漏斗和溶液均套用小火加熱保溫以免冷卻。濾液放置徹底冷卻,待晶體析出,抽濾出晶體,並用少量溶劑(水)洗滌晶體表面,抽乾後,取出產品放在表面皿上晾乾或烘乾,稱量。
注意事項
1、 用活性炭脫色時,不要把活性炭加入正在沸騰的溶液中。
2、濾紙不應大於布氏漏斗的底面。
3、在熱過濾時,整個操作過程要迅速,否則漏斗一涼,結晶在濾紙上和漏斗頸部析出,操作將無法進行。
4、洗滌用的溶劑量應儘量少,以避免晶體大量溶解損失。
5、停止抽濾時先將抽濾瓶與抽濾泵間連線的橡皮管拆開,或者將安全瓶上的活塞打開與大氣相通,再關閉泵,防止水倒流入抽濾瓶內。
影響效果因素
重結晶的效果與溶劑選擇大有關係,最好選擇對主要化合物是可溶性的,對雜質是微溶或不溶的溶劑,濾去雜質後,將溶液
濃縮、冷卻,即得純制的物質。混合在一起的兩種鹽類,如果它們在一種溶劑中的溶解度隨溫度的變化差別很大,例如
硝酸鉀和
氯化鈉的混合物,硝酸鉀的溶解度隨溫度上升而急劇增加,而溫度升高對氯化鈉溶解度影響很小。則可在較高溫度下將混合物溶液蒸發、濃縮,首先析出的是氯化鈉晶體,除去氯化鈉以後的母液再濃縮和冷卻後,可得純硝酸鉀。重結晶往往需要進行多次,才能獲得較好的純化效果。
 重結晶
重結晶技術
眾所周知,重結晶是有機合成中一項非常基本,但是又非常重要的技術,它原理簡單、使用方便,但是真的要做好重結晶,不是那么容易的事,尤其是溶劑的選擇,以及在出現乳化現象時的處理等等都有很深的學問,這裡轉一個關於重結晶技術的文章,希望對大家有所幫助!
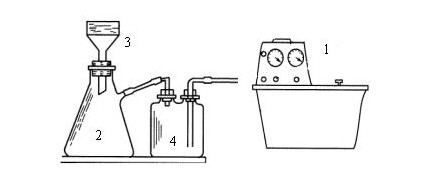 重結晶減壓過濾裝置
重結晶減壓過濾裝置原理
固體混合物在溶劑中的溶解度與溫度有密切關係。一般是溫度升高,溶解度增大。若把固體溶解在熱的溶劑中達到飽和,冷卻時即由於溶解度降低,溶液變成過飽和而析出晶體。利用溶劑對被提純物質及雜質的溶解度不同,可以使被提純物質從
過飽和溶液中析出。而讓雜質全部或大部分仍留在溶液中(若在溶劑中的溶解度極小,則配成飽和溶液後被過濾除去),從而達到提純目的。
討論
關於可以套用重結晶法的討論:
假設一固體混合物由9.5克被提純物A和0.5克雜質B組成,選擇某溶劑進行重結晶,室溫時A、B在此溶劑中的溶解度分別為SA和SB,通常存在下列三種情況:
 布氏漏斗
布氏漏斗(1)室溫下雜質較易溶解(SB>SA)。設在室溫下SB=2.5克/100ml,SA=0.5克/100ml,如果A在此沸騰溶劑中的溶解度為 9.5克/100ml,則使用100ml溶劑即可使混合物在沸騰時全溶。若將此濾液冷卻至室溫時可析出A9g(不考慮操作上的損失)而B仍留在母液中,A 損失很小,即被提純物回收率達到94%。如果A在此沸騰溶劑中的溶解度為47.5克/100ml,則只要使用20ml溶劑即可使混合物在沸騰時全溶,這時濾液可析出A9.4克,B仍可留在母液中,被提純物的回收率高達99%。
由此可見,如果雜質在冷時的溶解度大而產物在冷時的溶解度小,或溶劑對產物的溶解性能隨溫度的變化大,這兩方面都有利於提高回收率。
(2)雜質較難溶解(SB chang),可以將A完全溶解後直接過濾,將B過濾掉。
(3)兩者溶解度相等(SA=SB)。設在室溫下皆為2.5克/100ml,若也用100ml溶劑重結晶,仍可得到純A7克。但如果這時雜質含量很多,則用重結晶分離產物就比較困難。在A和B含量相等時,重結晶就不能用來分離產物了。
從上述討論總可以看出,在任何情況下,雜質的含量過多都是不利的(雜質太多還會影響結晶速度,甚至妨礙結晶的生成)。一般重結晶只適用於純化雜質含量在5%以下的固體有機混合物。
選擇溶劑的條件
(1)所選溶劑不與被提純物質起化學反應
 設備
設備(2)在較高溫度時能溶解大量的被提純物質;而在室溫或更低溫度時,只能溶解很少量的該種物質。使被提純物質熱易溶,冷難溶。
(3)對雜質的溶解非常大或者非常小(前一種情況是使雜質留在母液中不隨被提純物晶體一同析出;後一種情況是使雜質在熱過濾時被濾去)
(4)容易揮發(溶劑的沸點較低),易與結晶分離除去
(5)能給出較好的晶體
(6)無毒或毒性很小,便於操作
(7)價廉易得,回收率高。
(8)適當時候可以選用混合溶劑
溶解
選擇好溶劑後進行溶解
通過試驗結果或查閱溶解度數據計算被提取物所需溶劑的量,在將被提取物晶體置於錐形瓶中,加入較需要量稍少的適宜溶劑,加熱到微微沸騰一段時間後,若未完全溶解,可再添加溶劑,每次加溶劑後需再加熱使溶液沸騰,直至被提取物晶體完全溶解(但應注意,在補加溶劑後,發現未溶解固體不減少,應考慮是不溶性雜質,此時就不要再補加溶劑,以免溶劑過量)。
相關知識
結晶
在結晶和重結晶純化化學試劑的操作中,溶劑的選擇是關係到純化質量和回收率的關鍵問題。選擇適宜的溶劑時應注意以下幾個問題:
 重結晶的水晶
重結晶的水晶1. 選擇的溶劑應不與欲純化的化學試劑發生
化學反應。例如
脂肪族鹵代烴類化合物不宜用作鹼性化合物結晶和重結晶的溶劑;醇類化合物不宜用作酯類化合物結晶和重結晶的溶劑,也不宜用作
胺基酸鹽結晶和重結晶的溶劑。
2. 選擇的溶劑對欲純化的化學試劑在熱時應具有較大的溶解能力,而在較低溫度時對欲純化的化學試劑的溶解能力大大減小。
3. 選擇的溶劑對欲純化的化學試劑中可能存在的雜質或是溶解度甚大,在欲純化的化學試劑結晶和重結晶時留在母液中,在結晶和重結晶時不隨晶體一同析出;或是溶解度甚小,在欲純化的化學試劑加熱溶解時,很少在熱溶劑溶解,在熱過濾時被除去。
4. 選擇的溶劑沸點不宜太高,以免該溶劑在結晶和重結晶時附著在晶體表面不容易除盡。
 重結晶控制系統
重結晶控制系統用於結晶和重結晶的常用溶劑有:水、甲醇、乙醇、異丙醇、丙酮、乙酸乙酯、氯仿、冰醋酸、二氧六環、
四氯化碳、苯、石油醚等。此外,
甲苯、
硝基甲烷、
乙醚、
二甲基甲醯胺、
二甲亞碸等也常使用。二甲基甲醯胺和
二甲基亞碸的
溶解能力大,當找不到其它適用的溶劑時,可以試用。但往往不易從溶劑中析出結晶,且沸點較高,晶體上吸附的溶劑不易除去,是其缺點。乙醚雖是常用的溶劑,但是若有其它適用的溶劑時,最好不用乙醚,因為一方面由於乙醚易燃、易爆,使用時危險性特別大,應特別小心;另一方面由於乙醚易沿壁爬行揮發而使欲純化的
化學試劑在瓶壁上析出,以致影響結晶的
純度。
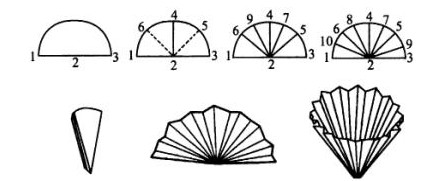 重結晶濾紙疊法1
重結晶濾紙疊法1在選擇溶劑時必須了解欲純化的化學試劑的結構,因為
溶質往往易溶於與其結構相近的溶劑中―“相似相溶”原理。極性物質易溶於
極性溶劑,而難溶於
非極性溶劑中;相反,非極性物質易溶於非極性溶劑,而難溶於極性溶劑中。這個溶解度的規律對實驗工作有一定的指導作用。如:欲純化的化學試劑是個非極性化合物,實驗中已知其在
異丙醇中的溶解度太小,異丙醇不宜作其結晶和重結晶的溶劑,這時一般不必再實驗極性更強的溶劑,如甲醇、水等,應實驗極性較小的溶劑,如丙酮、二氧六環、苯、石油醚等。適用溶劑的最終選擇,只能用試驗的方法來決定。下表可供選擇溶劑時參考。
物質的類別 | 溶解度大的溶劑 |
烴(疏水性) | 烴、醚、鹵代烴 |
鹵代烷 | 醚、醇、烴 |
酯 | 酯 |
酮 | 醇、二氧環己烷、冰醋酸 |
酚 | 乙醇、乙醚等有機溶劑 |
醯胺 | 醇、水 |
低級醇 | 水 |
高級醇 | 有機溶劑 |
鹽(親水性) | 水 |
若不能選擇出一種單一的溶劑對欲純化的化學試劑進行結晶和重結晶,則可套用
混合溶劑。混合溶劑一般是由兩種可以以任何比例互溶的溶劑組成,其中一種溶劑較易溶解欲純化的化學試劑,另一種溶劑較難溶解欲純化的化學試劑。一般常用的混合溶劑 有:乙醇和水、乙醇和乙醚、乙醇和丙酮、乙醇和氯仿、二氧六環和水、乙醚和
石油醚、氯仿和石油醚等等,最佳複合溶劑的選擇必須通過預試驗來確定。
注意事項
一、溶劑量的多少,應同時考慮兩個因素。溶劑少則收率高,但可能給
熱過濾帶來麻煩,並可能造成更大的損失;溶劑多,顯然會影響回收率。故兩者應綜合考慮。一般可比需要量多加20%左右的溶劑(有人認為一般可比需要量多20—100%的溶劑)。
 重結晶方晶
重結晶方晶二、可以在溶劑沸點溫度時溶解固體,但必須注意實際操作溫度是多少,否則會因實際操作時,被提純物晶體大量析出。但對某些晶體析出不敏感的被提純物,可考慮在溶劑沸點時溶解成飽和溶液,故因具體情況決定,不能一概而論。例如,本次實驗在100℃時配成飽和溶液,而熱過濾操作溫度不可能是100℃,可能是 80℃也可能是90℃。那么在考慮加多少溶劑時,應同時考慮熱過濾的實際操作溫度。
三、為了避免溶劑揮發及可燃性溶劑著火或有毒溶劑中毒,應在錐形瓶上裝置回流冷凝管,添加溶劑可從冷凝管的上端加入。
四、若溶液中含有色雜質,則應加活性炭脫色,應特別注意活性炭的使用。
五、趁熱過濾
(1)若為易燃溶劑,則應防止著火、防止溶劑揮發。
(2)應注意
濾紙的摺疊方法及操作要領(包括漏斗的預熱、濾紙的熱水潤濕等);應洗淨
抽濾瓶,注意濾紙的大小、濾紙的潤濕等操作,開始不要減壓太甚,以免將濾紙抽破(在熱溶劑中,濾紙強度大大下降)。
六、結晶
(1)將濾液在室溫或保溫下靜置使之緩緩冷卻(如濾液已析出晶體,能加熱使之溶解),析出晶體,再用冷水來充分冷卻。必要時,進一步用冰水或冰鹽水等冷卻(要視具體情況而定,若使用的溶劑在冰水或冰鹽水裡能析出結晶,就不能採用此步驟)。
(2)有時因為濾液中有
焦油狀物質或膠狀物存在,使的結晶不易析出,或有的時候因形成過飽和溶液也不析出晶體,這種情況下,可使用玻棒摩擦器壁以形成粗糙面,使的溶質分子成定向排列而形成結晶的過程較在平滑面上迅速和容易;或投入晶種(同一物質的晶體,如果無此物質的晶體,用玻棒蘸一些溶液稍乾後即會析出晶體),來供給定型晶核,使的晶體迅速形成。
(3)有的時候被提純化合物呈油狀析出,雖然本油狀物經長時間靜置或足夠冷卻後也可固化,但這樣固體往往含有較多的雜質(雜質在油狀物里常較在溶劑中的溶解度大;其次,析出的固體裡還包含一部分母液),其純度不高。用大量的溶劑稀釋,雖然可防止油狀物生成,但這會使產物大量損失。
這時候可將析出油狀物的溶液重新加熱溶解,然後是慢慢冷卻。當油狀物析出時便劇烈攪拌混合物,使油狀物在均勻分散狀況下固化,但最好是要重新選擇溶劑,使其得到晶形產物。
(1)裝置中各儀器的名稱和用途介紹。
(2)減壓過濾程式介紹:剪裁合符規格的濾紙放入漏斗中→用少量溶劑潤濕濾紙→開啟水泵並關閉安全瓶上的活塞,將濾紙吸緊→打開安全瓶上的活塞,再關閉水泵→藉助玻棒,將待分離物分批倒入漏斗中,並用少量濾液洗出粘附在容器上的晶體,一併倒入漏斗中→再次開啟水泵並關閉安全瓶上的活塞進行減壓過濾直至漏斗頸口無液滴為止→打開安全瓶上的活塞,再關閉水泵→用少量溶劑潤濕晶體→再次開啟水泵並關閉安全瓶上的活塞進行減壓過濾直至漏斗頸口無液滴為止(必要時可用玻塞擠壓晶體,此操作一般進行1—2次)。
如重結晶溶劑沸點較高,在用原溶劑至少洗滌一次後,可用低沸點的溶劑洗滌,使最後的結晶產物易於乾燥(要注意該溶劑必須是能和第一種溶劑互溶而對晶體是不容或微溶的)。
抽濾所得母液若有用,可移至其它容器內,再作回收溶劑及純度較低的產物。
八、結晶的乾燥
在測定熔點前,晶體必須充分乾燥,否則測定的熔點會偏低。固體乾燥的方法很多,要根據重結晶所用溶劑及結晶的性質來選擇:
(1)空氣涼乾(不吸潮的低熔點物質在空氣中乾燥是最簡單的乾燥方法)。
(2)烘乾(對空氣和溫度穩定的物質可在烘箱中乾燥,烘箱溫度應比被乾燥物質的熔點低15~20℃。
(3)用濾紙吸乾(此方法易將濾紙纖維污染到固體物上)
(4)置於乾燥器中乾燥
實驗
重結晶提純法
一、實驗目的:
通過實驗讓學生能熟練掌握用水、有機溶劑及混合溶劑重結晶純化固體
有機物質的各項具體
的操作方法,其中包括以下幾點:
(1)樣品的溶解,突出用易燃的有機溶劑時溶解樣品應採用儀器裝置及安全注意事項。
(2)過濾及熱過濾;菊花濾紙的折法。
(3)結晶及用活性炭脫色。
(4)抽濾:布氏漏斗、抽濾瓶、安全瓶、循環水泵等的安裝及使用。
(5)產品的乾燥,包括風乾(自然晾乾)和烘乾(使用烘箱、紅外乾燥)時儀器的使用
及注意事項。
二、基本原理
固體有機物在溶劑中的溶解度與溫度有密切關係。一般是溫度升高, 溶解度增大。利
用溶劑對被提純物質及雜質的溶解度不同,可以使被提純物質從過飽和溶液中析出,而讓雜
質全部或大部分仍留在溶液中,或者相反,從而達到分離、提純之目的。
三、操作要點及說明
重結晶提純法的一般過程為:
1.選擇適宜的溶劑
在選擇溶劑時應根據“相似相溶”的一般原理。溶質往往溶於結構與其相似的溶劑中。
還可查閱有關的文獻和手冊,了解某化合物在各種溶劑中不同溫度的溶解度。也可通過實驗
來確定化合物的溶解度。即可取少量的重結晶物質在試管中,加入不同種類的溶劑進行預試。
適宜溶劑應符合的條件:見曾紹瓊書P61。
2.將待重結晶物質製成熱的飽和溶液
制飽和溶液時,溶劑可分批加入,邊加熱邊攪拌,至固體完全溶解後,再多加2O%左
右(這樣可避免熱過濾時,晶體在漏斗上或漏斗頸中析出造成損失)。切不可再多加溶劑,
否則冷後析不出晶體。
如需脫色,待溶液稍冷後,加入活性炭(用量為固體1-5%),煮沸5-10min(切不
可在沸騰的溶液中加入活性炭,那樣會有暴沸的危險。)
3.趁熱過濾除去不溶性雜質
趁熱過濾時,先熟悉熱水漏斗的構造,放入菊花濾紙(要使菊花濾紙向外突出的稜角,
緊貼於漏斗壁上),先用少量熱的溶劑潤濕濾紙(以免乾濾紙吸收溶液中的溶劑,使結晶析
出而堵塞濾紙孔),將溶液沿玻棒倒入,過濾時,漏斗上可蓋上表面皿(凹面向下)減少溶
劑的揮發,盛溶液的器皿一般用錐形瓶(只有
水溶液才可收集在燒杯中)。
3.結晶
1)將濾液在室溫或保溫下靜置使之緩緩冷卻(如濾液已析出晶體,可加熱使之溶解),析出晶體,再用冷水充分冷卻。必要時,可進一步用冰水或冰鹽水等冷卻(視具體情況而定,若使用的溶劑在冰水或冰鹽水中能析出結晶,就不能採用此步驟)。
(2)有時由於濾液中有
焦油狀物質或膠狀物存在,使結晶不易析出,或有時因形成過飽和溶液也不析出晶體,在這種情況下,可用玻棒摩擦器壁以形成粗糙面,使溶質分子成定向排列而形成結晶的過程較在平滑面上迅速和容易;或者投入晶種(同一物質的晶體,若無此物質的晶體,可用玻棒蘸一些溶液稍乾後即會析出晶體),供給定型晶核,使晶體迅速形成。
(3)有時被提純化合物呈油狀析出,雖然該油狀物經長時間靜置或足夠冷卻後也可固化,但這樣的固體往往含有較多的雜質(雜質在油狀物中常較在溶劑中的溶解度大;其次,析出的固體中還包含一部分母液),純度不高。用大量溶劑稀釋,雖可防止油狀物生成,但將使產物大量損失。
這時可將析出油狀物的溶液重新加熱溶解,然後慢慢冷卻。一當油狀物析出時便劇烈攪拌混合物,使油狀物在均勻分散的狀況下固化,但最好是重新選擇溶劑,使其得到晶形產物。
4.抽濾
抽濾前先熟悉布氏漏斗的構造及連線方式,將剪好的濾紙放入,濾紙的直徑切不可大於
漏斗底邊緣,否則濾紙會折過,濾液會從折邊處流過造成損失,將濾紙潤濕後,可先倒入部
分濾液(不要將溶液一次倒入)啟動水循環泵,通過緩衝瓶(安全瓶)上二通活塞調節
真空度,開始真空度可低些,這樣不致將濾紙抽破,待濾餅已結一層後,再將餘下溶液倒入,此
時真空度可逐漸升高些,直至抽“乾”為止。
停泵時,要先打開放空閥(二通活塞),再停泵,可避免倒吸。
5.結晶的洗滌和乾燥
用溶劑沖洗結晶再抽濾,除去附著的母液。抽濾和洗滌後的結晶,表面上吸附有少量溶
劑,因此尚需用適當的方法進行乾燥。固體的乾燥方法很多,可根據重結晶所用的溶劑及結
晶的性質來選擇,常用的方法有以下幾種:空氣晾乾的;烘乾(紅外燈或烘彩);用濾紙吸
乾;置於乾燥器中乾燥。
四、思考題
1.重結晶法一般包括哪幾個步驟?各步驟的主要目的如何?
答:一般包括:(1)選擇適宜溶劑,製成熱的飽和溶液。(2)
熱過濾,除去不溶性雜質(包
括脫色)。(3)冷卻結晶、抽濾,除去
母液。(4)洗滌乾燥,除去附著母液和溶劑。
2.重結晶時,溶劑的用量為什麼不能過量太多,也不能過少?正確的應該如何?
答:過量太多,不能形成熱飽和溶液,冷卻時析不出結晶或結晶太少。過少,有部分待結
晶的物質熱溶時未溶解,熱過濾時和不溶性雜質一起留在濾紙上,造成損失。考慮到熱過濾
時,有部分溶劑被
蒸發損失掉,使部分晶體析出留在波紙上或漏斗頸中造成結晶損失,所以
適宜用量是製成熱的飽和溶液後,再多加20%左右。
3.用活性炭脫色為什單要待固體物質完全溶解後才加入?為什麼不能在溶液沸騰時加入?
答:活性炭可吸附有色雜質、樹脂狀物質以及均勻分散的物質。因為有色雜質雖可溶於沸
騰的溶劑中,但當冷卻析出結晶體時,部分雜質又會被結晶吸附,使得產物帶色。所以用活
性炭脫色要待固體物質完全溶解後才加入,並煮沸5-10min。要注意活性炭不能加入已沸
騰的溶液中,以免溶液暴沸而從容器中衝出。
4.使用有機溶劑重結晶時,哪些操作容易著火?怎樣才能避免呢?
答:有機溶劑往往不是易燃就是有一定的毒性,也有兩者兼有的,操作時要熄滅鄰近的一
切明火,最好在通風櫥內操作。常用三角燒瓶或圓底燒瓶作容器,因為它們瓶口較窄,溶劑
不易發,又便於搖動,促使固體物質溶解。若使用的溶劑是低沸點易燃的,嚴禁在石棉網上
直接加熱,必須裝上回流冷凝管,並根據其沸點的高低,選用熱浴,若固體物質在溶劑中溶
解速度較慢,需要較長時間,也要裝上回流冷凝管,以免溶劑損失。
5.用水重結晶
乙醯苯胺,在溶解過程中有無油狀物出現?這是什麼?
答:在溶解過程中會出現油狀物,此油狀物不是雜質。乙醯苯胺的熔點為114℃,但當乙
醯苯胺用水重結晶時,往往於83℃就熔化成液體,這時在水層有溶解的乙醯苯胺,在熔化
的乙醯苯胺層中含有水,故油狀物為未溶於水而已熔化的乙醯苯胺,所以應繼續加入溶劑,
直至完全溶解。
6 、使用布氏漏斗過濾時,如果濾紙大於漏斗瓷孔面時,有什麼不好?
答:如果濾紙大於漏斗瓷孔面時,濾紙將會折邊,那樣濾液在抽濾時將會自濾紙邊沿吸入
瓶中,而造成晶體損失。所以不能大,只要蓋住瓷孔即可。
7.停止抽濾前,如不先拔除橡皮管就關住水閥(泵)會有什麼問題產生?
答:如不先拔除橡皮管就關水泵,會發生水倒吸入抽濾瓶內,若需要的是濾液問題就大了。
8.某一
有機化合物進行重結晶,最適合的溶劑應該具有哪些性質?
答:(1)與被提純的有機化合物不起化學反應。(2)對被提純的有機物應具有熱溶,冷
不溶性質。(3)雜質和被提純物質,應是一個熱溶,一個熱不溶。(4)對要提純的有機物能
在其中形成較整齊的晶體。(5)溶劑的沸點,不宜太低(易損),也不宜太高(難除)。(6)
價廉易得無毒。
9.將溶液進行熱過濾時,為什麼要儘可能減少溶劑的揮發?如何減少其揮發?
答:溶劑揮發多了,會有部分晶體熱過濾時析出留在濾紙上和漏斗頸中,造成損失,若用有機溶劑,揮發多了,造成浪費,還污染環境。
為此,過濾時漏斗應蓋上表面皿(凹面向下),可減少溶劑的揮發。盛溶液的容器,一般用錐形瓶(水溶液除外),也可減少溶劑的揮發。
10.在布氏漏斗中用溶劑洗滌固體時應該注意些什麼?
答:用重結晶的同一溶劑進行洗滌,用量應儘量少,以減少溶解損失。如重結晶的溶劑的熔點較高,在用原溶劑至少洗滌一次後。可用低沸點的溶劑洗滌,使最後的結晶產物易於乾燥,(要注意此溶劑必須能和第一種溶劑互溶而對晶體是不溶或微溶的
做有機試驗經常要純化產物或試劑。但是
過柱子太麻煩,我經常偷懶用重結晶,碰到幾個問題拉出來大家討論:
1’ 選溶劑該有個什麼順序,不能每個常用溶劑都試一遍把!
2‘什麼時候考慮用混合溶劑?
3’用混合溶劑時 (比如乙醇加水) 加多少水才合適?
4‘重結晶的產率如何提高?
5’微量的產物,比如 100mg左右可不可以重結晶?
6‘重結晶時經常得到油狀液,並不析出晶體,如何解決?
出現油比較麻煩,一般可以加
晶種,或冷凍,可能會有效。出現油狀油的一個原因:那就是在蒸發溶劑的時候蒸發的太多了,將會出現油狀,解決的辦法很簡單是在加一些溶解性比較好的溶劑讓其全部溶解,再來進行結晶析出。油狀物有時可通過抽氣的辦法析出固體濃縮得到油狀物也可能是本身熔點太低,加入CH2Cl2冷抽試試。
如果你的油狀物能溶於乙醚,可用乙醚將其溶解後轉移至研缽中進行研磨,隨著乙醚的不斷揮發,油狀物會漸漸凝為固體。原因有二:1-溶劑不斷在減少。2-研磨中產生大量玻璃微屑成為晶種而誘導
析晶。
“石油醚熱提-冷卻法”也是我用來對付油狀物的方法,加入石油醚,沸騰,傾出上清液,底部油繼續加入石油醚熱提取,直至石油醚層無色,則基本提取完全。冷卻後一般會析出晶體。。(在此過程中還可加入活性炭脫色效果會更好,有一缺點就是冷卻後剩餘樣品和活性炭在一起會變的很硬)(很多人認為這種方法比較好)
另外成油的一個原因是降溫太快。
我對付油狀物曾經傷透腦筋。今天,我總結一下我曾經使用過的方法:
1.首先分析油狀物的可能物性,(水溶,油溶大?)一般來講,油狀物是聚合物或者大分子色素等等,用石油醚提取雜質的方法一般對油溶性大的某些結構非常好使。但是,對於聚合物(樹脂狀的粘稠東東)石油醚法不是很好用的,甚至得不償失,提純沒搞好,所要的藥品損失了很多。所以,這是可採用的方法是:①採用
水蒸汽蒸餾方法提純 ②用活性炭或者是硅藻土在熱溶劑中吸附 ③過柱子 ④如果你做的是鹼性,可以製成硫酸或鹽酸鹽有些有利於成固體。 一般,過柱子很麻煩,且損失也不小,如果能有活性炭或者硅藻土吸附就爽歪歪了,方法是用良溶劑熱容試一試,如果有不溶的雜誌和色素等,加入硅藻土或者純淨海泡石,然後過濾,再考慮選用合適的重結晶溶劑。硅藻土還有助濾效果,如果你過濾時曾經遇到過有細小雜質堵塞濾紙的情況,加入硅藻土,一般就OK,過濾不再便秘。
我這些都來自實驗室和工業一線的結合經驗。希望各位要繼續探討更細緻的問題,徹底解決各種難題。我又帶來一個問題:
如果我的藥品是鹽酸鹽,這個小東西容易在空氣中吸潮而造成“油狀”(不做成鹽酸鹽這個東西的熔點幾十度),剛從乙醚石油醚的混合溶劑中出來,還沒等看夠晶體形狀就立即油狀了,以上方法都用了,不好使,如何對付請高手討論。
1.與“相似相溶“背道而馳就行,大極性東西,用中等極性溶劑結晶;小極性東西,用大極性溶劑。這樣,有一半以上的情況是適合。
2.先試:石油醚(正己烷)和乙醚與乙酸乙酯、乙醇、水,再試:丙酮、甲醇、乙腈、苯、氯仿、乙酸、吡啶等。如果還不行的話,就只好混合。乙醚可以利用(1)揮發性;(2)延玻璃向上爬而使固體析出特性。丙酮如果不與水配伍,應加以乾燥。
3.混合溶劑法:用過量熱良溶劑溶、過濾、加熱,緩慢加入不良溶劑到有渾濁,加熱到澄清。靜置等待。
4.用分級結晶法。積累母液過柱。
5.可以,做過的最小量為10mg。
6.不好辦。第一建議用其他純化方法。假如一定要用
結晶法,以下經驗有一定幫助:a.過柱預純化,粗分離後結晶;b.石油醚熱提-冷析法;c.選低沸點的溶劑如乙醚;d.晶種的取得,用玻璃棒沾一滴溶液,揮乾。e.不要輕易冷凍,用讓溶劑自然揮發的方法。
.關於用乙醚結晶。回流乙醚時,要加一冷凝管。不斷從上口加乙醚,直至混濁消失,有時是因為溶解的較慢,而不是不能溶,所以要有耐心。如果加入很多乙醚還有少量沉澱不溶,則將其濾去,濾液濃縮至有固體析出,再加熱,加入少量乙醚使澄清。自然放冷,可得晶型較好的結晶。過濾。用少量乙醚洗晶體。洗滌液合併入
母液,在盛母液的瓶口蒙一層濾紙,或塞一團衛生紙,讓乙醚自然揮發,而不能落入灰塵。每天早晨看一眼,直到有滿意數量的晶體出來,別太貪了,揮發乾了就又要重來了:)我曾經用此法成功拆分了左旋和右旋的生物鹼。當然了,這是我運氣比較好.
如果物質對熱不穩定,是不是就不能用重結晶了方法?
用低溫法分離可不可以啊?
對熱不穩定的話,首選層析法。也可以用重結晶,不加熱,讓溶劑自然揮發濃縮。另外,“對熱不穩定“這件事挺複雜的。應該認真分析並驗證你的結論。我以前有個化合物,被認為對光和熱極其敏感,旋蒸時20度以下,避光,隔膜泵減壓旋乾!但後來發現,那個化合物根本沒那么嬌氣,是實驗者自己嚇唬自己:)
在重結晶中冷卻速度會加大地影響產品的純度,應此在冷卻是經常採用逐級冷卻的辦法,而起在其過程中藥伴隨著輕微的攪拌有利於晶體的形成。
在產品析不出來時可以在溶液中滴加一種產品不容的試劑讓其慢慢的析出
怎樣將少量固體取出瓶子,分兩種情況
(1)旋轉蒸發之後,固體就呈透明狀,粘在瓶壁中,其無法用刮刀刮下。解決方法是:用易溶溶劑(如果丙酮)重新溶解,並且加入一些不良溶劑(如己烷),重新旋乾,固體把以較好的形態析出,或以第2種情況存在;
(2)旋轉蒸發之後,固體呈現白色非透明狀,粘在瓶壁中,可用刮刀刮下,但因為靜電原因無法取出來。解決方法:用少量易溶溶劑來重新溶解,將溶液轉移到表面皿或扁平的樣品瓶里,將它們放到一個更大的容器里,蓋上張濾紙防止其落上灰塵,讓溶劑自然揮乾。
另外,應準確稱量轉移前後的瓶重,以確定樣品是否完全轉移。
這裡的不良溶劑和重結晶的不良溶劑是一個意思。
用滴管就行,液體大概0.5ml*3次。
微量固體有時靜電很強,來源我不知道。
如果產品中的雜質與產品極性相差較大,可將樣品研碎然後用一與雜質極性相近的溶劑加熱回流,過濾乾燥然後檢測,雜質往往可去掉。
把大家的東西總結了一把,有時間我在把自己的東西加進去
1’ 選溶劑該有個什麼順序?
與“相似相溶“背道而馳就行了,大極性的東西,用中等極性的溶劑結晶;小極性的東西,用大極性的溶劑。這樣,有一半以上的情況是適合的。
先試:石油醚(正己烷)、乙醚、乙酸乙酯、乙醇、水,再試:丙酮、甲醇、乙腈、苯、氯仿、乙酸、吡啶等。如果還不行,就只好混合了。乙醚可以利用其(1)
揮發性;(2)延玻璃向上爬而使固體析出的特性。丙酮如不與水配伍,應加以乾燥。
2‘什麼時候考慮用混合溶劑?
關於用混合溶劑結晶有一些特別需要注意的地方。【溶解性好的溶劑(S),溶解性不好的溶劑(U)】。在圓底燒瓶中先用S來進行溶解,接上回流冷凝管再進行加熱直至其全部溶解,然後從冷凝管的上部開始滴加U,直到油一點點渾濁後停止滴加,然後再滴加S至其剛好澄清,然後撤走熱源,讓它慢慢冷卻結晶析出。這樣析出來的晶體非常漂亮,並且也不會附再壁上。當然這樣的晶體不能用來做X-
衍射(因為不是
單晶)。
3’用混合溶劑時 (比如乙醇加水) 加多少水才合適?
用過量熱的良溶劑溶解,過濾,加熱,緩慢加入不良溶劑至有渾濁,加熱至澄清。靜置等待。
4‘重結晶的產率如何提高?
用分級結晶法。積累的母液過柱
5’微量的產物,比如 100mg左右可不可以重結晶?
可
6‘重結晶時經常得到油狀液,並不析出晶體,如何解決?
.不好辦。
首先建議用其他純化方法。如果一定要用結晶法,以下經驗可能有幫助:(1)過柱預純化,粗分離後再結晶;(2)石油醚熱提-冷析法:“石油醚熱提-冷卻法”也是用來對付油狀物的方法,。是將待精製品加入熱的石油醚中,攪拌使之溶解,有些不溶物沉在下面。傾出上層清夜於另一燒杯中,然後再向
樣品中加入石油醚,加熱攪拌傾出清夜,依次下去。(在此過程中還可加入活性炭脫色效果會更好,有一缺點就是冷卻後剩餘樣品和活性炭在一起會變的很硬)直至石油醚層無色,則基本提取完全,冷卻後一般會析出晶體;(3)選低沸點的溶劑如乙醚;(4)
晶種的取得,用玻璃棒沾一滴溶液,揮乾。(5)不要輕易冷凍,用讓溶劑自然揮發的方法。
出現油狀油一個原因:那就是你在蒸發溶劑的時候蒸發的太多了,會出現油狀,解決的辦法很簡單就是在加一些溶解性比較好的溶劑讓其全部溶解,在來進行結晶讓其析出。
另外成油的一個原因是降溫太快。
發粘一般是另外一種東西,找一個能溶解粘物的,但又與產物不溶的洗滌、分散後,再濾,如果要母液的話,可以蒸餾分離,通常乙醚和丙酮最常用。
怎樣將少量固體取出瓶子,分兩種情況:
(1)旋轉蒸發後,固體呈透明狀,粘在瓶壁上,無法用刮刀刮下。解決方法:用
易溶溶劑(如丙酮)重新溶解,並加入一些不良溶劑(如己烷),重新旋乾,固體將以較好的形態析出,或以第二種情況存在;
(2)旋轉蒸發後,固體呈白色非透明狀,粘在瓶壁上,可以用刮刀刮下,但由於靜電原因無法取出來。解決方法:用少量易溶溶劑重新溶解,將溶液轉移到表面皿或扁平的樣品瓶中,把它們放到一個更大的容器里,蓋上張濾紙防止落上灰塵,讓溶劑自然揮乾。
另外,應準確稱量轉移前後的瓶重,以確定樣品是否完全轉移。
如果雜質的量不是很大,可以試試結晶除去。
反相柱分不掉的雜質,也可以試試用另一種分離機制色譜方法除去,比如凝膠柱。
 重結晶
重結晶 重結晶減壓過濾裝置
重結晶減壓過濾裝置 布氏漏斗
布氏漏斗 設備
設備 重結晶的水晶
重結晶的水晶 重結晶控制系統
重結晶控制系統 重結晶濾紙疊法1
重結晶濾紙疊法1 重結晶方晶
重結晶方晶
