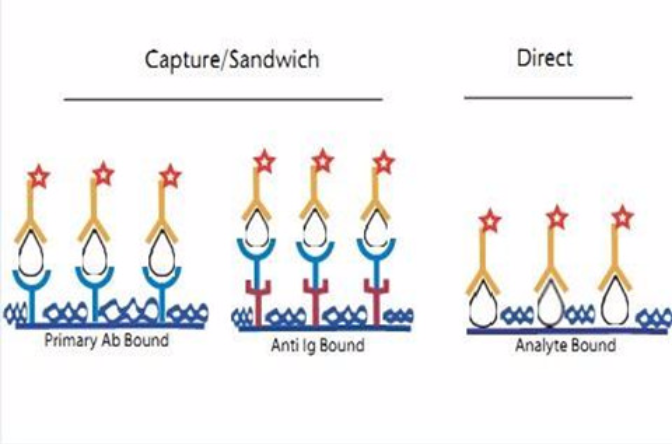
原理
1971年Engvall和Perlmann發表了酶聯免疫吸附劑測定(enzyme linked immunosorbent assay,ELISA)用於IgG定量測定的文章,使得1966年開始用於抗原定位的酶標抗體技術發展成液體標本中微量物質的測定方法。這一方法的基本原理是:①使
抗原或抗體結合到某種固相載體表面,並保持其
免疫活性。②使抗原或抗體與某種酶連線成酶標抗原或抗體,這種酶標抗原或抗體既保留其免疫活性,又保留酶的活性。在測定時,把受檢標本(測定其中的抗體或抗原)和酶標抗原或抗體按不同的步驟與固相載體表面的抗原或抗體起反應。用洗滌的方法使固相載體上形成的
抗原抗體複合物與其他物質分開,最後結合在固相載體上的酶量與標本中受檢物質的量成一定的比例。加入
酶反應的底物後,底物被
酶催化變為有色產物,產物的量與標本中受檢物質的量直接相關,故可根據
顏色反應的深淺有無定性或定量分析。由於酶的催化效率很高,故可極大地放大反應效果,從而使測定方法達到很高的敏感度。
 酶聯免疫實驗 洗板 工具
酶聯免疫實驗 洗板 工具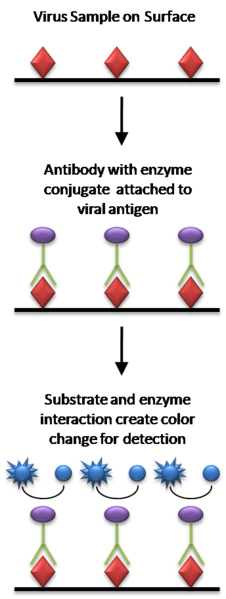
分類方法
夾心法
將具有專一性的抗體固著(coating)於塑膠孔盤上,完成後洗去多餘抗體;
加入待測檢體,檢體中若含有待測的抗原,則其會與塑膠孔盤上的抗體進行專一性鍵結;
洗去多餘待測檢體,加入另一種對抗原專一的一次抗體,與待測抗原進行鍵結;
洗去多餘未鍵結一次抗體,加入帶有酶的二次抗體,與一次抗體鍵結;
洗去多餘未鍵結二次抗體,加入酶底物使酵素呈色,以肉眼或儀器讀取呈色結果。
間接法
間接法常用於檢測抗體,一般的操作步驟為:
將已知的抗原固著於塑膠孔盤上,完成後洗去多餘的抗原;
加入待測檢體,檢體中若含有待測的一次抗體,則其會與塑膠孔盤上的抗原進行專一性鍵結;
洗去多餘待測檢體,加入帶有酶的二次抗體,與待測的一次抗體鍵結;
洗去多餘未鍵結二次抗體,加入酶底物使酶呈色,藉儀器(ELISA reader)測定塑膠盤中的吸光值(OD值),以評估有色終產物的含量即可測量待測抗體的含量。
競爭法
競爭法是一種較少用到的ELISA檢測機制,一般用於檢測小分子抗原,其操作步驟為:
將具有專一性的抗體固著於塑膠孔盤上,完成後洗去多餘抗體;
加入待測檢體,使檢體中的待測抗原與塑膠孔盤上的抗體進行專一性鍵結;
加入帶有酶的抗原,此抗原也可與塑膠孔盤上的抗體進行專一性鍵結,由於塑膠孔盤上固著的抗體數量有限,因此當檢體中抗原的量越多,則帶有酶的抗原可鍵結的固著抗體就越少,亦即,兩種抗原皆競相與塑膠孔盤上抗體鍵結,即所謂競爭法之由來;
洗去檢體與帶有酶的抗原,加入酶底物使酶呈色,當檢體中抗原量越多,代表塑膠孔盤內留下之帶有酶的抗原越少,顯色也就越淺。
當需要偵測無法獲得兩種以上單一性抗體的抗原,或是不易得到足夠的
純化抗體以固著於孔盤上時,一般會考慮使用競爭法ELISA。
進展
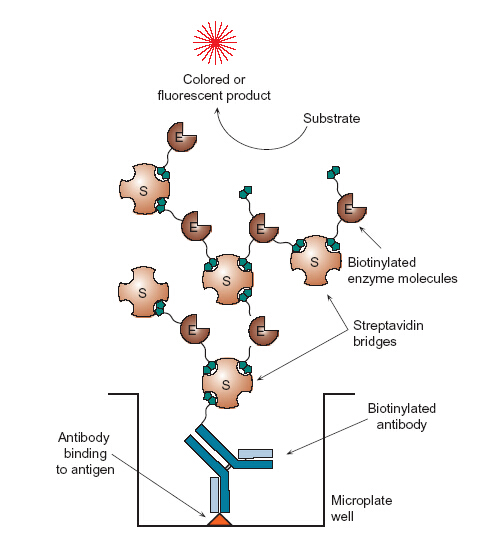
親和素是一種
糖蛋白,一分子親和素可以與四個生物素小分子發生專一親和作用,類似抗原與抗體親和。它們之間的作用力是目前已知最強的非共價作用。80年代後,隨著
生物素-親合素系統(BAS)作用被發現,這一親和作用被結合套用到ELISA技術上,大大提高了後者反應的靈敏性與專一性。
生物素很易與蛋白質(如抗體等)以
共價鍵結合。這樣,結合了酶的親和素分子與結合有特異性抗體的生物素分子產生反應,既起到了多級放大作用,又由於酶在遇到相應底物時的
催化作用而呈色,達到檢測未知抗原(或抗體)分子的目的。
結果判斷
定性測定 定性測定的結果判斷是對受檢標本中是否含有待測抗原或抗體作出"有"或"無"的簡單回答,分別用"陽性"、"陰性"表示。"陽性"表示該標本在該測定系統中有反應。"陰性"則為無反應。用定性判斷法也可得到
半定量結果,即用
滴度來表示反應的強度,其實質仍是一個定性試驗。在這種半定量測定中,將標本作一系列稀釋後進行試驗,呈陽性反應的最高
稀釋度即為滴度。根據滴度的高低,可以判斷標本反應性的強弱,這比觀察不稀釋標本呈色的深淺判斷為強陽性、弱陽性更具定量意義。
在間接法和夾心法ELISA中,陽性孔呈色深於陰性孔。在競爭法ELISA中則相反,陰性孔呈色深於陽性孔。
定量測定
ELISA操作步驟複雜,影響反應因素較多,特別是固相載體的包被難達到各個體之間的一致,因此在定量測定中,每批測試均須用一系列不同濃度的參考
標準品在相同的條件下製作
標準曲線。測定大分子量物質的夾心法ELISA,標準曲線的範圍一般較寬,曲線最高點的吸光度可接近2.0,繪製時常用半對數值,以檢測物的濃度為橫坐標,以吸光度為縱坐標,將各濃度的值逐點連線,所得曲線一般呈S形,其頭、尾部曲線趨於平坦,中央較呈直線的部分是最理想的檢測區域。
測定小分子量物質常用競爭法,其標準曲線中吸光度與受檢物質的濃度呈負相關。標準曲線的形狀因試劑盒所用模式的差別而略有不同。ELISA測定的標準曲線注意圖中橫坐標為
對數關係,這更有利於測定系統的表達。
 酶聯免疫實驗 洗板 工具
酶聯免疫實驗 洗板 工具