簡介
軟硬酸鹼理論簡稱HSAB(Hard-Soft-Acid-Base)理論,是一種嘗試解釋酸鹼反應及其性質的現代理論。它目前在化學研究中得到了廣泛的套用,其中最重要的莫過於對配合物穩定性的判別和其反應機理的解釋。軟硬酸鹼理論的基礎是酸鹼電子論,即以電子對得失作為判定酸、鹼的標準。
理論
將酸和鹼根據性質的不同各分為軟硬兩類的理論。
the theory of hard and soft acids and bases
理論原理
在軟硬酸鹼理論中,酸、鹼被分別歸為“硬”、“軟”兩種。“硬”是指那些具有較高電荷密度、較小半徑的粒子(離子、原子、分子),即
電荷密度與粒子半徑的比值較大。“軟”是指那些具有較低電荷密度和較大半徑的粒子。“硬”粒子的極化性較低,但極性較大;“軟”粒子的極化性較高,但極性較小。 此理論的中心主旨是,在所有其他因素相同時,“軟”的酸與“軟”的鹼反應較快速,形成較強鍵結;而“硬”的酸與“硬”的鹼反應較快速,形成較強鍵結。 大體上來說,“硬親硬,軟親軟”生成的化合物較穩定。
分類
將酸和鹼根據性質不同分為軟硬兩類的理論。1963年由R.G. 皮爾孫提出。1958 年 S.阿爾蘭德、J.查特和N.R.戴維斯根據某些
配位原子易與 Ag
+、Hg
2+、Pt
2+ 配位;另一些則易與Al
3+、Ti
4+配位,將金屬離子分為兩類。
 軟硬酸鹼理論
軟硬酸鹼理論a類金屬離子包括鹼金屬 、
鹼土金屬、Ti
4+、Fe
3+、Cr
3+、H
+;
b 類金屬離子包括Cu
+、Ag
+、Hg
2+、Pt
2+。皮爾孫在前人工作的基礎上提出以軟硬酸鹼來區分金屬離子和
配位原子:
硬酸 包括a類金屬離子(
鹼金屬、鹼土金屬、Ti、Fe、Cr、H)
硬鹼包括F
-、OH
-、H
2O、NH
3、O
2-、CH
3COO
-、PO
43-、SO
42-、CO
32-、ClO
4-、NO
3-、ROH等
軟酸 包括b類金屬離子Cu+、Ag+、Hg2+、Pt2+、Au+;
Cd
2+; Pd
2+、Hg
2+及MO等
 軟硬酸鹼理論
軟硬酸鹼理論軟鹼包括I
-、SCN
-、CN
-、CO、H
-、S
2O
32-、C
2H
4、RS
-、S
2-等
交界酸 包括Fe2+、Co2+、Ni2+; Zn2+、Pb2+、Sn2+、Sb3+、Cr2+、Bi3+ 、Cu2+等,
交界鹼 包括N3-、Br- 、NO2-、N2 、SO32-等
表:軟硬酸鹼分類
反應規律
“硬酸優先與
硬鹼結合,軟酸優先與
軟鹼結合。”
 軟硬酸鹼理論
軟硬酸鹼理論這雖然是一條經驗規律,但套用頗廣:
①取代反應都傾向於形成硬 - 硬、軟 - 軟的化合物。
②軟-軟、硬-硬化合物較為穩定,軟 - 硬化合物不夠穩定。
③硬溶劑優先溶解硬
溶質,軟溶劑優先溶解軟溶質,許多
有機化合物不易溶於水 ,就是因為水是
硬鹼。
④ 解釋
催化作用。有機反應中的弗里德-克雷夫茨反應以無水氯化鋁(AlCl
3)做催化劑,AlCl
3是硬酸,與RCl中的硬鹼Cl
-結合而活化。
————————————————————————————————————————————
用軟硬酸鹼理論解釋為什麼AgCl不溶於水,而AgF溶於水 :
鹵化銀中,Ag
+是軟酸,與Cl
-(交界鹼)、Br
-、I
-(
軟鹼)鍵合較水強,這些鹽溶解度就小;但Ag
+ 與F
-(硬鹼)鍵合較水弱,AgF溶解度就大。
用軟硬酸鹼理論如何解釋硫酸中與羥基相連的S是硬酸還是軟酸 :
1、中心S是+6價,正電荷越高,即硬酸。
2、硫酸是一種很穩定的酸,而硬硬結合或軟軟結合的產物一般都很穩定。
重要性
主要用於討論金屬離子的配合物體系;預言反應方向;預言配合物穩定性;合理解釋Goldschmidt規則。
缺點:但是軟硬酸鹼理論也有局限,如軟鹼CN-和硬酸Fe3+和軟酸Ag+都很容易反應.
簡史
將酸和鹼根據性質的不同各分為軟硬兩類的理論。1963年由R.G.皮爾孫提出。本理論適用於說明多種化學現象,如酸鹼反應、金屬和
配位體間的作用、
配離子形成(見
配位化學),
共價鍵和離子鍵的形成等。
1958年S.阿爾蘭德、J.查特和N.R.戴維斯根據某些配位原子易與Ag、Hg、Pt配位,而另一些配位原子易與Al、Ti等配位,將金屬離子和配位原子分成a和b兩類。
 軟硬酸鹼理論
軟硬酸鹼理論b類金屬離子包括較重的、低氧化數的過渡元素Cu、Ag、Hg、Pt。
a類金屬離子的特性隨氧化數升高而加強,它優先與體積小、電負性大的原子結合;
b類金屬離子形成化合物的穩定性,因配位原子的電負性增大而減弱:C≈S>I>Br>Cl>N>O>F
此順序幾乎(不是全部)和 a類金屬離子形成化合物的穩定性順序相反(見表),如與水相比,硫醚R2S (R為烷基)與b類金屬離子Hg、Pt、Pd等配位傾向較強。這個經驗性總結有助於判斷
配位化合物的穩定性。
皮爾孫在前人工作的基礎上提出以軟硬酸鹼來區分a類和b類金屬離子和配位原子。硬酸包括 a類金屬離子,
硬鹼包括H2O、F等;軟酸包括b類金屬離子,
軟鹼包括H、I等;交界酸包括 Fe、Cu,交界鹼包括NO娛、SO娫 等(表1)。 皮爾孫提出酸鹼反應的規律為:硬酸優先與硬鹼結合,軟酸優先與軟鹼結合。這是一個很有用的經驗規則。
化學反應
軟硬酸鹼理論可說明多種化學現象。
取代反應
酸鹼取代作用傾向於形成硬-硬、軟-軟化合物:HI(g)+F(g)→HF(g)+I(g) ΔH=-263.6kJ/mol
式中g為氣態。H是硬酸,優先與
硬鹼F結合,反應放熱。
雙取代反應也傾向於生成硬-硬、軟-軟化合物,反應放熱,如Li、Be是硬酸(Be比Sr硬),F是硬鹼,I是
軟鹼,反應如下: LiI+CsF→LiF+CsI Δ
H=-65.7kJ/mol
BeI2+SrF2→BeF2+SrI2 ΔH=-200.8kJ/mol
化合物的穩定性
軟-軟、硬-硬化合物較為穩定。如軟酸Cu易與
軟鹼CN生成穩定的
配位化合物(簡稱配合物)Cu(CN)
+,其
穩定常數lg
β2=24,此值大於Cu與
硬鹼NH
3配合物Cu(NH
3)
2+的穩定常數(lg
β2=10.8);又如軟酸Cd與軟鹼CN的配合物Cd(CN)+的穩定常數lg
β4=18.9,大於Cd與硬鹼NH3配合物Cd(NH
3)的穩定常數(lg
β4=6.92);軟鹼I易與軟酸I
2、Ag形成穩定的I
3-、AgI,而硬鹼卻不能形成穩定的I
2F、AgF。
一般軟-硬化合物不夠穩定,如CH2F2易分解:2CH2F2(g)─→CH4(g)+CF4(g)
硬酸Mg、Ca、Sr、Ba、Al等在自然界的礦物都是與
硬鹼O、F、CO、SO等的化合物,而軟酸Ag、Hg等主要是與
軟鹼S等的化合物。
高
氧化數金屬的化合物都是氧化物和氟化物,屬硬-硬化合物,如OsO
4、Mn
2O
7、IF
7、OsF
6;而某些低氧化數的金屬與軟鹼的化合物比較穩定,如Mn(CO)
5Cl。
溶解度
物質的溶解也是
溶質和溶劑間的酸鹼反應。常用的
硬鹼溶劑水和氨,較易溶解硬酸-硬鹼的化合物,如LiCl、MgSO
4、KNO
3…;而
軟鹼溶劑如苯等,易溶解軟酸Br
2、I
2。
軟酸Ag與硬鹼F的化合物易溶於水,而軟酸Ag與軟鹼Br、I的化合物難溶。Ag與硬鹼NH
3配合物的
穩定常數lg
β2=7.4。對軟酸Ag來說,鹼的軟性減弱順序是:硬溶劑優先溶解硬溶質,軟溶劑優先溶解軟溶質。許多有機化合物不易溶於水,就是因為水是硬鹼。
 軟硬酸鹼理論
軟硬酸鹼理論金屬的電極電勢
M(s)→M(aq)+ne
式中s為固態;aq為水溶液。金屬離子化傾向取決於三個過程的能量: M(s)→M(g) (升華)
M(g)→M(g)+ne (電離)
M(g)+ne→M(aq)+ne (水合)
式中g為氣態。金屬的升華、電離都是吸熱過程,水合是放熱過程。從能量角度看,反應的推動力是水合能。若M是硬酸,則較易與
硬鹼(水)結合,金屬的電極電勢偏高;若M是軟酸,與水的結合力較弱,金屬的電勢相應偏低。對於軟酸(如Ag),如加入
軟鹼(如 Br等),因發生軟-軟結合,使金屬的標準電極電勢有所降低,如:在液氨溶劑中,由於NH
3不如H
2O強,使某些硬酸的電勢有所升高,而有些軟酸的電勢有所降低(與在水中的電極電勢比),如表。
 軟硬酸鹼理論
軟硬酸鹼理論異性雙基配體的配位情況 常見到的異性雙基配體(見
配位化合物)有 SCN、SeCN、 OCN、CNO、CN、S
2O
3…等,它們與何種原子配位,也可以利用硬-硬、軟-軟結合規則來判斷:Fe是硬酸,將與SCN中“硬端”——N原子結合成Fe(NCS)
3,其他如表所示。
類聚作用 酸或鹼的接受或給予原子的
酸鹼性受形成配合物時
配位體軟、硬性的影響。一般軟配位體傾向於使酸、鹼變軟,而硬的配位體趨向於使硬性增強。如【CoF(NH
3)
5】比【CoI(NH
3)
5】穩定,因
硬鹼NH3加強了Co的硬性,使之更易與強鹼F結合。反之,若用
軟鹼CN代替硬鹼NH
3,加強了Co的軟性,使 【Co(CN)
5I】穩定,而【Co(CN)
5F】則不能形成。
加合反應熱效應 表2是水溶液中的幾個酸鹼反應實例,前六個都是硬酸-硬鹼的結合,Δ
H(
焓變)的絕對值都不大,
TΔ
S(
T為溫度;Δ
S為熵變)是較大的正值,其正向反應的推動力是
TΔ
S;軟酸-軟鹼結合的Δ
H為負值,
TΔ
S也是較小的值。
在
水溶液中,軟酸-
軟鹼、硬酸-
硬鹼類型的結合,其Δ
H和
TΔ
S值的差別與
水合作用有關。H2O是硬性物,硬鹼、硬酸原先都有強烈的水合作用,當硬酸和硬鹼加合時,排擠出原先的水分子,使混亂度增高,即Δ
S增大;而軟酸、軟鹼原先的水合較弱,當較酸和軟鹼發生加合時,放熱明顯,愈軟,放熱愈多。例如,Hg是軟酸,它與軟鹼CH
3加合得CH
3Hg,後者與軟鹼RS加合,放熱更多。
催化反應
有機化學中的弗里德-克雷夫茨反應以無水氯化鋁AlCl
3作催化劑。AlCl
3是硬酸,與RCl中的
硬鹼Cl結合而活化:R與苯核作用:硬酸H與AlCl3中的硬鹼Cl結合:其他硬酸如SnCl
4、FeCl
3也有類似於AlCl
3的作用。
 軟硬酸鹼理論
軟硬酸鹼理論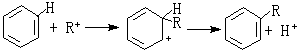 軟硬酸鹼理論
軟硬酸鹼理論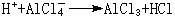 軟硬酸鹼理論
軟硬酸鹼理論金屬催化劑中毒問題,也可從軟硬酸鹼規則來理解。一般零
氧化數的金屬都是軟酸,易與
軟鹼反應而中毒。如鐵(軟酸)催化劑,易與軟鹼如一氧化碳、硫、磷、砷等發生不可逆反應而引起鐵中毒;
硬鹼如氧、水與鐵發生可逆反應,不會引起鐵中毒。
取代反應的速率
一般形成軟酸-
軟鹼化合物的
反應速率較高。CH
3Cl是軟酸CH
3和
硬鹼Cl的化合物,其中的CH
3能與軟鹼RS、I、S
2O
3、R
3P等發生較快的取代反應,而與硬鹼RO、R
3N、F、SO娸等的取代反應速率較低:CH
3Cl+RS→CH
3SR+Cl
CH3Cl+RO→CH3OR+Cl
前一個反應的速率是後者的100倍。
又如HI和AgF都是軟-硬化合物。HI中的I(軟鹼)與Ag(軟酸)發生快反應。同理,AgF 中的F(硬鹼)與Al(硬酸)也發生快反應:HI+Ag→AgI+H
3AgF+Al→AlF3+3Ag
為了統一酸鹼軟硬標度,皮爾孫以H(質子)作為硬酸、CH
3Hg(甲基汞離子)作為軟酸的實驗標準來測定它們與鹼(B)反應的平衡常數,以決定鹼的相對反應性能:硬酸H的參比平衡常數對數值lg
K1的改變趨勢與軟酸CH
3Hg的參比平衡常數對數值lg
K1的改變趨勢恰好相反(表3)。這表明:酸鹼軟硬標度既與鹼本身的性質有關,也和與之結合的酸的特性有關。 同理,可用標準
硬鹼和標準
軟鹼為參比,測定與酸的相對反應性質。
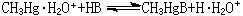 軟硬酸鹼理論
軟硬酸鹼理論參考書目
R.G.Pearson,Journal of Chemical Education,45,pp.581~587、643~648,1968.

 軟硬酸鹼理論
軟硬酸鹼理論 軟硬酸鹼理論
軟硬酸鹼理論 軟硬酸鹼理論
軟硬酸鹼理論 軟硬酸鹼理論
軟硬酸鹼理論 軟硬酸鹼理論
軟硬酸鹼理論 軟硬酸鹼理論
軟硬酸鹼理論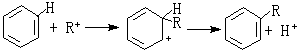 軟硬酸鹼理論
軟硬酸鹼理論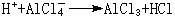 軟硬酸鹼理論
軟硬酸鹼理論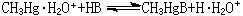 軟硬酸鹼理論
軟硬酸鹼理論
 軟硬酸鹼理論
軟硬酸鹼理論 軟硬酸鹼理論
軟硬酸鹼理論 軟硬酸鹼理論
軟硬酸鹼理論 軟硬酸鹼理論
軟硬酸鹼理論 軟硬酸鹼理論
軟硬酸鹼理論 軟硬酸鹼理論
軟硬酸鹼理論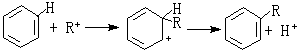 軟硬酸鹼理論
軟硬酸鹼理論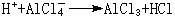 軟硬酸鹼理論
軟硬酸鹼理論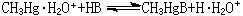 軟硬酸鹼理論
軟硬酸鹼理論