簡介
任何一種物質都存在三種相態——
氣相、
液相、
固相。三相呈平衡態共存的點叫三相點。液、氣兩相呈平衡狀態的點叫臨界點。在臨界點時的溫度和壓力稱為臨界溫度和臨界壓力(水的臨界溫度和臨界壓力分別為374℃和21.7MPa)。不同的物質其臨界點所要求的壓力和溫度各不相同。
高於臨界溫度和臨界壓力而接近臨界點的狀態稱為超臨界狀態。處於超臨界狀態時,氣液兩相性質非常接近,以至於無法分辨,所以超臨界水是非協同、非極性溶劑。
超臨界狀態概述
根據理想氣體狀態方程PV=nRT,在一定溫度下,一定量的理想氣體的體積V與其壓力P成反比。若以P作縱坐標,V作橫坐標作圖可得一條反比曲線,稱為
等溫線。對於任一溫度,均可畫出一條等溫線,因此不同溫度下的理想氣體的等溫線是一組形狀大致相同的反比曲線。但對於實際氣體,由於分子間存在作用力,它是可以液化的,其等溫線與理想氣體等溫線就可能出現較大偏差。安德魯(Andrews T)在1869年根據實驗繪製了CO
2的等溫線,如下圖所示,它與理想氣體的等溫線迥然不同。
 CO2的氣液平衡圖
CO2的氣液平衡圖從圖中可以看出,在低溫(小於30.98℃)時,CO
2的等溫線均出現了一段水平線段,即體積變化而壓力保持不變,說明CO
2在進行液化。隨著溫度升高,水平線段逐漸變短,說明CO
2液化過程逐漸變短。當溫度升到30.98℃時,等
溫線的水平部分縮成一點,在此溫度以上,CO
2的等溫線逐漸接近理想氣體的
等溫線,這時無論加多大壓力,CO
2均不能
液化。故這一點稱為CO
2的臨界點,
對應的溫度和壓力稱為臨界溫度和臨界壓力。它們是物質的特徵參數。高於臨
界溫度時,無論給該物質的氣態施加多大壓力也不會使之液化。
溫度和壓力均處於臨界點以上的氣體稱為超臨界流體(supercritical fluid)。它既具有
氣體的性質,可以很容易地壓縮或
膨脹,又像
液體一樣,具有較大的密度,但它的
黏度比液體小,有較好的流動性和熱傳導性能。超臨界流體的
介電常數隨壓力改變而急劇變化,通過控制超臨界流體的溫度和壓力,可以方便地改變它的密度大小和溶劑性質,使得它在化學反應和分離方面得到了非常廣泛的套用,發展了如超臨界流體萃取、
超臨界流體色譜和超臨界化學反應等新的分離和反應技術,其中超臨界流體萃取套用得最為廣泛。例如,在高壓條件下,使超臨界流體與物料接觸,使物料中的有效成分溶於超臨界流體中(相當於
萃取),分離後,降低超臨界流體的壓力,有效成分析出。如果有效成分不止一種,採用逐級降壓,可使多種成分分步析出。利用此方法人們成功地從咖啡豆中除去咖啡因,從菸草中除去尼古丁,從大豆或玉米胚芽中分離出甘油酯,從藥用植物厚朴酚中分離出厚朴酚與和厚朴酚。
超臨界流體不僅可用於從天然產物中提取有效成分,而且是很好的反應介質,如將反應物和催化劑都溶解在超臨界流體中,可使非均相反應變成均相反應,不僅加快化學反應速率,還可利用各種物質在超臨界流體中的溶解度不同,把未反應的物質、產物、催化劑乃至副產物等逐一分離開來。
超臨界流體
定義
溫度及壓力均處於臨界點以上的液體叫超臨界流體(supercritical fluid)。
性質
它基本上仍是一種氣態,但又不同於一般氣體,是一種稠密的氣態。其
密度比一般氣體要大兩個數量級,與液體相近。它的
粘度比液體小,但擴散速度比液體快(約兩個數量級),所以有較好的流動性和傳遞性能。它的介電常數隨壓力而急劇變化(如介電常數增大有利於溶解一些極性大的物質)。
套用原理
物質在
超臨界流體中的溶解度,受壓力和溫度的影響很大。可以利用升溫,降壓手段(或兩者兼用)將超臨界流體中所溶解的物質分離析出,達到
分離提純的目的(它兼有
精餾和
萃取兩種作用)。例如在高壓條件下,使超臨界流體與物料接觸,物料中的高效成分(即
溶質)溶於超臨界流體中(即萃取)。分離後降低溶有溶質的超臨界流體的壓力,使溶質析出。如果有效成分(溶質)不止一種,則採取逐級降壓,可使多種溶質分步析出。在分離過程中沒有相變,能耗低。
套用
如超臨界四流體萃取(supercrtical fluid extraction),
超臨界流體色譜(supercritical fluid chromatography)和超臨界流體中的化學反應等,但以
超臨界流體萃取套用得最為廣泛。很多物質都有
超臨界流體區,但由於CO
2的臨界溫度比較低(364.2K),
臨界壓力也不高(7.28MPa),且無毒,無臭,無公害,所以在實際操作中常使用CO
2超臨界流體。如用超臨界CO
2從咖啡豆中除去咖啡因,從菸草中脫除
尼古丁,從大豆或玉米胚芽中分離甘油酯,對花生油、棕櫚油、大豆油脫臭等。又例如從紅花中提取
紅花甙及紅花醌甙(它們是治療高血壓和肝病的有效成分),從月見草中提取月見草油(它們對心血管病有良好的療效)等。使用
超臨界技術的唯一缺點是涉及高壓系統,大規模使用時其工藝過程和技術的要求高,設備費用也大。但由於它優點甚多,仍受到重視。
自從1869年Andrews首先發現臨界現象以來,各種研究工作陸續開展起來,其中包括1879年Hannay和Hogarth測量了固體在
超臨界流體中的溶解度,1937年Michels等人準確地測量了CO
2近
臨界點的狀態等等。在
純物質相圖上,一般流體的氣-液平衡線有一個終點——臨界點,此處對應的溫度和壓力即是臨界溫度(T
c)和
臨界壓力(P
c)。當流體的溫度和壓力處於T
c和P
c之上時,那么流體就處於超臨界狀態(supercritical狀態,簡稱SC 狀態)。超臨界流體的許多物理化學性質介於氣體和液體之間,並具有兩者的優點,如具有與液體相近的
溶解能力和傳熱係數,具有與氣體相近的黏度係數和
擴散係數。同時它也具有區別於
氣態和液態的明顯特點:
(1)可以得到處於氣態和液態之間的任一密度;
(2)在
臨界點附近,壓力的微小變化可導緻密度的巨大變化。
由於黏度、
介電常數、擴散係數和溶解能力都與密度有關,因此可以方便地通過調節壓力來控制
超臨界流體的物理化學性質。與常用的
有機溶劑相比,超臨界流體特別是SC CO
2、SC H
2O還是一種環境友好的溶劑。正是這些優點,使得超臨界流體具有廣泛的套用潛力,超臨界流體萃取分離技術已得到了廣泛的醫藥方面套用。
超臨界流體萃取
定義
超臨界流體萃取(Supercritical Fluid extrac-ion,SPE)是一項新型提取技術,
超臨界流體萃取技術就是利用超臨界條件下的氣體作
萃取劑,從液體或固體中萃取出某些成分並進行分離的技術。
超臨界條件下的氣體,也稱為
超臨界流體(SF),是處於臨界溫度(T
c)和臨界壓力(P
c)以上,以流體形式存在的物質。通常有二氧化碳(CO
2)、
氮氣(N
2)、氧化二氮(N
2O)、
乙烯(C
2H
4)、
三氟甲烷(CHF
3)等。
基本原理
超臨界流體萃取的基本原理:當氣體處於超臨界狀態時,成為性質介於液體和氣體之間的單一
相態,具有和液體相近的密度,粘度雖高於氣體但明顯低於液體,
擴散係數為液體的10~100倍,因此對物料有較好的滲透性和較強的
溶解能力,能夠將物料中某些成分提取出來。並且
超臨界流體的密度和介電常數隨著密閉體系壓力的增加而增加,
極性增大,利用程式升壓可將不同極性的成分進行分部提取。提取完成後,改變體系溫度或壓力,使超臨界流體變成普通氣體逸散出去,物料中已提取的成分就可以完全或基本上完全析出,達到提取和分離的目的。
物質的其中四種狀態(固態、液態、
氣態和超臨界狀態)(還有其他形態)隨著它的溫度和壓力而改變。以CO
2為例,CO
2在
三相點上,固、液、氣三相共存的溫度T(tr)為-56.4℃(217K),壓力P(tr)為5.2×10
5Pa。CO
2的蒸氣壓線終止於
臨界點C(T
c=31.3℃,P
c=7.38×10
6Pa,ρ
c=0.47 g/cm
3)。超過臨界點以上,液氣兩相的界面消失,成為
超臨界流體(SF)。SF的擴散係數(10
-1~10
-4cm
2/s)比一般液體的擴散係數(10
-2~10
-5cm
2/s)高一個數量級,而它的粘度(10
-2~10
-4N·s/m
2)要低於一般液體(10
-1~10
-3N·s/m
2)一個數量級。與液-液萃取系統相比,SF系統具有較快的
質量傳遞和萃取速度。因此能有效地穿入固體樣品的空隙中進行萃取分離。SF的密度隨著溫度和壓力改變,導致它的
溶解度參數(solubility parameter)的改變。在較低的密度下,SF-CO
2的溶解度參數接近
己烷;在較高的密度下,它可接近氯仿。因此控制SF的密度(溫度和壓力),可獲得所需要的溶劑強度。這種能力使得SF可任意改變溶劑強度而適合於不同的溶質。一般而論,SF能有效地溶解非極性固體,它亦能按
溶質的極性做選擇性的萃取,這在分離和分析化學的領域用途很廣。
CO2具有較低的臨界溫度和壓力,且價格便宜,無毒,具有較低的活性,因此SF-CO2常被用來萃取非極性和略有極性的物質。
在超臨界狀態下,流體兼有氣 液兩相的雙重特點,既具有與氣體相當的高
擴散係數和低粘度,又具有與液體相近的密度和對物質良好的
溶解能力。其密度對溫度和壓力變化十分敏感,且與溶解能力在一定壓力範圍內出成比例,故可通過控制溫度和壓力改變物質的溶解度。
超臨界流體已用於藥物的提取合成分析及加工。
 CO2的氣液平衡圖
CO2的氣液平衡圖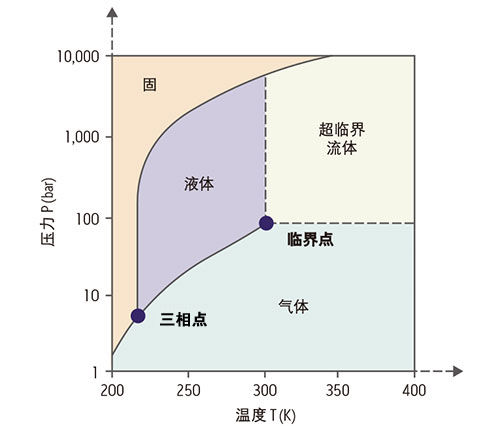
 CO2的氣液平衡圖
CO2的氣液平衡圖