基本介紹
- 中文名:苯惡洛芬
- 外文名:Oraflex
- 中文別名:苯惡丙酸,氧苯惡唑丙酸
- 英文別名:Benoxaprofen; Coxigon; Opren;
- CAS:51234-28-7
- 分子式:C16H12ClNO3
- 分子量:301.7244
基本信息,合成路線,光譜數據,
基本信息
中文名稱 苯惡洛芬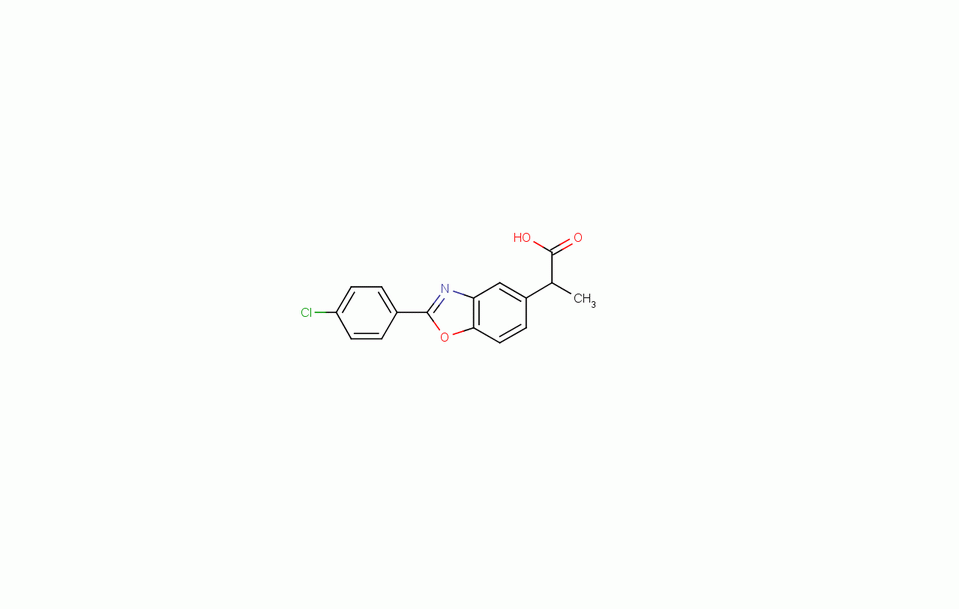 分子結構
分子結構
 分子結構
分子結構英文名稱 Oraflex
英文別名 Benoxaprofen; Coxigon; Opren; Uniprofen; ; 2-[2-(4-chlorophenyl)-1,3-benzoxazol-5-yl]propanoic acid
CAS號 51234-28-7
EINECS號 257-069-7
分子式 C16H12ClNO3
分子量 301.7244
InChI InChI=1/C16H12ClNO3/c1-9(16(19)20)11-4-7-14-13(8-11)18-15(21-14)10-2-5-12(17)6-3-10/h2-9H,1H3,(H,19,20)
密度 1.362g/cm3
密度 1.362g/cm3
沸點 446.2°C at 760 mmHg
閃點 223.6°C
蒸汽壓 9.61E-09mmHg at 25°C
合成路線
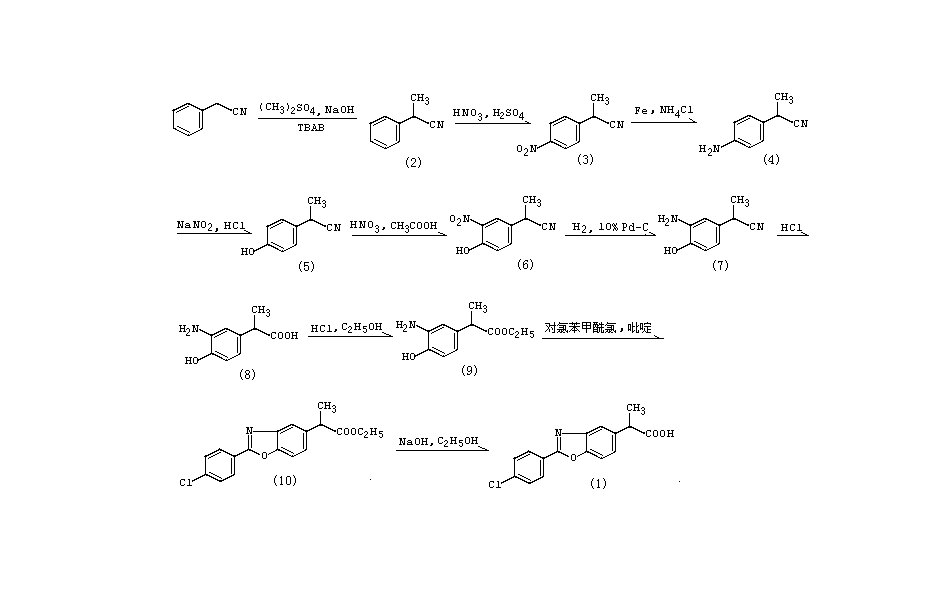
一、2-甲基丙腈(2)的製備
在反應瓶中,加入苯乙腈87g(0.74mol)、50%氫氧化鈉溶液300g(3.75mol)和溴化四正丁基銨(TBAB)1g,劇烈攪拌下,於室溫下滴加硫酸二甲酯95g(0.75mol),滴畢,繼續攪拌4h。反應畢,滴加苯甲醛15ml(0.14mol)後,加入苯和水適量,分出有機層,水層用苯提取,合併有機層,依次用稀鹽酸、水洗滌,無水硫酸鈉乾燥,回收溶劑後,減壓蒸餾,收集bp78~80℃/0.267~0.4kPa餾份,得(2)70.2g(72%)。 苯惡洛芬
苯惡洛芬
在反應瓶中,加入苯乙腈87g(0.74mol)、50%氫氧化鈉溶液300g(3.75mol)和溴化四正丁基銨(TBAB)1g,劇烈攪拌下,於室溫下滴加硫酸二甲酯95g(0.75mol),滴畢,繼續攪拌4h。反應畢,滴加苯甲醛15ml(0.14mol)後,加入苯和水適量,分出有機層,水層用苯提取,合併有機層,依次用稀鹽酸、水洗滌,無水硫酸鈉乾燥,回收溶劑後,減壓蒸餾,收集bp78~80℃/0.267~0.4kPa餾份,得(2)70.2g(72%)。
 苯惡洛芬
苯惡洛芬二、2-(4-硝基苯基)丙腈(3)的製備
在乾燥反應瓶中,加入濃硝酸275ml,濃硫酸275ml,攪拌,冷卻至0~5℃,緩慢滴加(2)111.4g(0.85mol)(滴加溫度控制在10℃左右,不超過20℃),滴畢,繼續攪拌1~1.5h。反應畢,將反應液倒入碎冰1.2g中,攪拌,析出固體,過濾除去油狀物[該油狀物為2-(2-硝基苯基)丙腈],得粗品(3)。用乙醇-水重結晶,得精品(3)68.8g(46%),mp74~76℃。
在乾燥反應瓶中,加入濃硝酸275ml,濃硫酸275ml,攪拌,冷卻至0~5℃,緩慢滴加(2)111.4g(0.85mol)(滴加溫度控制在10℃左右,不超過20℃),滴畢,繼續攪拌1~1.5h。反應畢,將反應液倒入碎冰1.2g中,攪拌,析出固體,過濾除去油狀物[該油狀物為2-(2-硝基苯基)丙腈],得粗品(3)。用乙醇-水重結晶,得精品(3)68.8g(46%),mp74~76℃。
三、2-(4-氨基苯基)丙腈(4)的製備
在反應瓶中,加入0.78mol/L氯化銨溶液36ml(0.072mol)、粗鐵粉12g(0.21mol),升溫至95℃,加入(3)12.7g(0.072mol),保溫攪拌1.5h。反應畢,冷卻,用10%碳酸鈉溶液調至pH弱鹼性,加苯適量,過濾。濾液靜置,分出有機層,用5%鹽酸提取數次,合併鹽酸提取液,用10%碳酸鈉溶液調至pH弱鹼性,析出固體,過濾,乾燥,得(4) 10.1g(96.2%),mp48~49℃。若mp達不到48~49℃,可減壓蒸餾,收集bp130~131℃/0.12kPa餾分。 四、2-(4-羥基苯基)丙腈(5)的製備
在反應瓶中,加入(4)73g(0.5mol),濃鹽酸125ml,攪拌。冷卻至0~5℃後,於1~2h內滴加亞硝酸鈉36.2g(0.525mol)和水60ml的溶液,滴畢,於5~10℃攪拌20min後,將反應液倒入濃硫酸250ml和水2.5L的溶液中,加熱回流6min。反應畢,冰浴冷卻,用乙醚提取數次,合併有機層,再用2mol/L氫氧化鈉溶液提取數次,合併氫氧化鈉提取液,冰浴冷卻,用濃鹽酸調至pH2~3,用乙醚提取,合併有機層,用飽和氫氧化鈉溶液洗滌,無水硫酸鈉乾燥,回收溶劑後,減壓蒸餾,收集bp118~122℃/16.7Pa餾份,得 (5)59.58g(81%)。固化後mp42~46℃。 五、2-(3-硝基-4-羥基)丙腈(6)的製備
在乾燥反應瓶中,加入12mol/L硝酸8ml,攪拌,於7~10℃在45min內滴加(5) 7.79g (0.053mol)和冰乙酸10ml的溶液(在此過程中,另加冰乙酸10ml),滴畢,繼續保溫攪拌0.5h,再於-10~-15℃攪拌0.5h。反應畢,加水90ml,析出黃色固體,過濾,乾燥,得(6)8.43g(82%),mp78~81℃。
在反應瓶中,加入(4)73g(0.5mol),濃鹽酸125ml,攪拌。冷卻至0~5℃後,於1~2h內滴加亞硝酸鈉36.2g(0.525mol)和水60ml的溶液,滴畢,於5~10℃攪拌20min後,將反應液倒入濃硫酸250ml和水2.5L的溶液中,加熱回流6min。反應畢,冰浴冷卻,用乙醚提取數次,合併有機層,再用2mol/L氫氧化鈉溶液提取數次,合併氫氧化鈉提取液,冰浴冷卻,用濃鹽酸調至pH2~3,用乙醚提取,合併有機層,用飽和氫氧化鈉溶液洗滌,無水硫酸鈉乾燥,回收溶劑後,減壓蒸餾,收集bp118~122℃/16.7Pa餾份,得 (5)59.58g(81%)。固化後mp42~46℃。 五、2-(3-硝基-4-羥基)丙腈(6)的製備
在乾燥反應瓶中,加入12mol/L硝酸8ml,攪拌,於7~10℃在45min內滴加(5) 7.79g (0.053mol)和冰乙酸10ml的溶液(在此過程中,另加冰乙酸10ml),滴畢,繼續保溫攪拌0.5h,再於-10~-15℃攪拌0.5h。反應畢,加水90ml,析出黃色固體,過濾,乾燥,得(6)8.43g(82%),mp78~81℃。
六、2-(3-氨基-4-羥基苯基)丙腈(7)的製備
在高壓釜中,加入(6)38.4g(0.2mol)、無水乙醇250ml和10%Pd/C 2g,於室溫、60Pa氫壓下通氫氫化3.8h。反應畢,過濾,回收催化劑(套用),濾液減壓回收溶劑,冷卻,析出固體,過濾,乾燥,得(7)32.4g(100%),mp110℃。
在高壓釜中,加入(6)38.4g(0.2mol)、無水乙醇250ml和10%Pd/C 2g,於室溫、60Pa氫壓下通氫氫化3.8h。反應畢,過濾,回收催化劑(套用),濾液減壓回收溶劑,冷卻,析出固體,過濾,乾燥,得(7)32.4g(100%),mp110℃。
七、2-(3-氨基-4-羥基苯基)丙酸(8)的製備
在反應瓶中,加入(7)10g (0.06mol)、濃鹽酸100ml,加熱攪拌回流2.25h。反應畢,冷卻,用2mol/L氫氧化鈉溶液調至pH5,析出固體,過濾,乾燥得粗品(8)。用甲醇重結晶,得精品(8)6.0g(54%),mp167~169℃。 八、2-(3-氨基-4-羥基苯基)丙酸乙酯(9)的製備
在乾燥反應瓶中,加入(8)13.82g(0.076mol)、無水乙醇50ml、通入乾燥氯化氫氣體至飽和後,加熱攪拌回流5.5h。反應畢,減壓回流溶劑,冷卻,向剩餘油狀物中加入水50ml,用10%碳酸氫鈉溶液調至pH8後,用乙醚提取數次,無水硫酸鈉乾燥,過濾,濾液回收溶劑後,減壓蒸餾,收集bp154~156℃/333Pa餾份,得(9)8.43g(53%)。固化後,mp79~82℃,IR(KBr):1728(C=O)cm。
在反應瓶中,加入(7)10g (0.06mol)、濃鹽酸100ml,加熱攪拌回流2.25h。反應畢,冷卻,用2mol/L氫氧化鈉溶液調至pH5,析出固體,過濾,乾燥得粗品(8)。用甲醇重結晶,得精品(8)6.0g(54%),mp167~169℃。 八、2-(3-氨基-4-羥基苯基)丙酸乙酯(9)的製備
在乾燥反應瓶中,加入(8)13.82g(0.076mol)、無水乙醇50ml、通入乾燥氯化氫氣體至飽和後,加熱攪拌回流5.5h。反應畢,減壓回流溶劑,冷卻,向剩餘油狀物中加入水50ml,用10%碳酸氫鈉溶液調至pH8後,用乙醚提取數次,無水硫酸鈉乾燥,過濾,濾液回收溶劑後,減壓蒸餾,收集bp154~156℃/333Pa餾份,得(9)8.43g(53%)。固化後,mp79~82℃,IR(KBr):1728(C=O)cm。
九、2-(4-氯苯基)-α-甲基-5-苯並惡唑乙酸乙酯(10)的製備
在乾燥反應瓶中,加入對氯苯甲醯氯3.35g(0.019mol)、於攪拌下滴加(9)4.4g(0.021mol)和乾燥吡啶15ml的溶液,滴畢,於100℃攪拌1h後,減壓回收溶劑後,於240℃繼續攪拌10min。反應畢,冷卻,得粗品(10)。用乙醇重結晶,得白色結晶(10)7.5g(90%),mp59~61℃,IR (KBr):1730(C=0)cm。
在乾燥反應瓶中,加入對氯苯甲醯氯3.35g(0.019mol)、於攪拌下滴加(9)4.4g(0.021mol)和乾燥吡啶15ml的溶液,滴畢,於100℃攪拌1h後,減壓回收溶劑後,於240℃繼續攪拌10min。反應畢,冷卻,得粗品(10)。用乙醇重結晶,得白色結晶(10)7.5g(90%),mp59~61℃,IR (KBr):1730(C=0)cm。
十、苯惡洛芬(1)的合成
在反應瓶中,加入(10)7.85g(0.024mol)、氫氧化鈉5g(0.125mol)的90%乙醇溶液955ml,於室溫下攪拌4.5h。反應畢,減壓回收溶劑後,冷卻,將剩餘粘稠油狀物溶於水50ml中,過濾,向濾液中加入濃鹽酸10ml,攪拌,過濾,濾餅水洗至pH7,乾燥,得粗品(1)。用乙醇重結晶,得白色固體精品(1)3.15g(44%),mp189~190℃。
在反應瓶中,加入(10)7.85g(0.024mol)、氫氧化鈉5g(0.125mol)的90%乙醇溶液955ml,於室溫下攪拌4.5h。反應畢,減壓回收溶劑後,冷卻,將剩餘粘稠油狀物溶於水50ml中,過濾,向濾液中加入濃鹽酸10ml,攪拌,過濾,濾餅水洗至pH7,乾燥,得粗品(1)。用乙醇重結晶,得白色固體精品(1)3.15g(44%),mp189~190℃。
光譜數據
IR (KBr):1701(C=O), 1250, 1220, 880cm-l。
13C-NMR (CDCl3-CD3SOCD3):175.8, 161.8, 149.2, 141.7, 137.7, 137.1,128.7, 128.3, 125.1, 124.8, 118.4, 109.9, 44.9, 18.50
MS:m/z (%) 301(M+, 50), 256(基峰)
13C-NMR (CDCl3-CD3SOCD3):175.8, 161.8, 149.2, 141.7, 137.7, 137.1,128.7, 128.3, 125.1, 124.8, 118.4, 109.9, 44.9, 18.50
MS:m/z (%) 301(M+, 50), 256(基峰)