定義
芳香性六隅體。指大多數
芳香族化合物的六個π電子的閉合環,其芳香性與此有關。
最早認為芳香性應包括較大的共振能;對光、熱的穩定性;不易發生加成反應;易發生取代反應等。現在認為是維持產生環電流的能力。
具體內容
1865年
F.A.凱庫勒首先提出苯的正六邊形結構的假設,即六個碳原子形成一個單鍵、雙鍵交替排列的正六邊形。這個假設成功地把碳四價理論套用於苯,但它無法解釋六個碳等價的現象,也無法解釋苯的低氫化熱。以後又有不少學者用各種不同的模型來解釋苯的特性,但都不能很圓滿地解釋上述苯的特性。為了表示苯分子中六個π電子的共軛及其穩定性,文獻中經常用正六邊形加入一個圓圈來表示,這就是芳六重組。根據芳六重組理論,萘只有一個芳六重組,為使兩個式子對稱,假定六重組中的兩個電子可以從一個環中流到另一個環中。
後來,E.克萊爾等人的大量工作證明,與脂肪族異構體相類似,線型(g)和角型(e)的苯並芳香烴的性質也不同。如果並環數目相同,但芳六重組數目不同,則芳六重組數目越多的異構體,其分子的共振能就越大,紫外吸收的波長就越短,其局部的雙鍵特徵往往就越明顯。例如化合物e的共振能比g大7~12千卡,e的中心環上的雙鍵具有明顯的不飽和性質。化合物d、f、i、j、k的紫外吸收光譜波長λ越來越短。
如果並環的數目增多,但芳六重組的數目保持不變,則類苯的特性減少,整個化合物雖仍有芳香性,但穩定性卻降低,紫外光譜出現有規則的紅移。例如化合物 h、l、m,它們的紫外吸收波長明顯地紅移,並且波長的倒數與並環數之間的關係遵循同系線性規律。
芳香性的概念最初只是與苯及其衍生物的性質聯繫在一起。隨著有機化學的發展, 很快就發現某些非苯系的高度不飽和的有機化合物( 如
雜環化合物) 具有和苯相似的芳香性。這說明芳香性並非苯及其衍生物所特有。從本質上來說明“ 芳香性” 產生的原因, 無論在理論上和實踐上都有著重要的意義。本世紀二十年代初期, 阿密特和魯濱遜從電子理論出發, 注意到只有具有6π電子的共扼環狀體系才具有特殊的芳香穩定性。這種6π電子體系稱為芳香電子六隅體( sextet ) 。
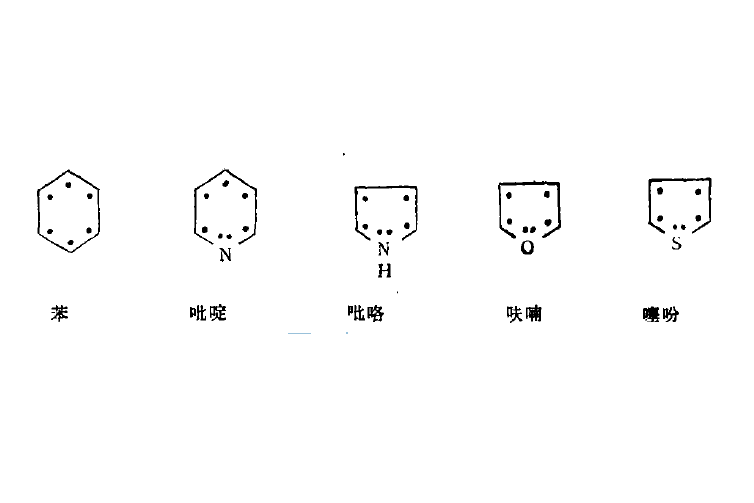
如吡啶、吡咯、呋喃、噻吩等具有與苯相似的芳香性, 它們的六隅體電子體系分別表示如下:
六隅體學說對於預言芳香性曾經有過重大的指導意義。
規則
休克爾規則定義
Hückel規則(
休克爾規則)是有機化學的經驗規則,它指當閉合環狀平面型的共軛多烯(
輪烯)
π電子數為(4n+2)時,具有
芳香性。從凱庫勒(kkul)提出苯的環狀結構,並發現苯和類苯化合物有特殊性質(芳性)以來,人們對芳性及其和結構之間的關係的研究也逐步深入,到1931年休克爾用其簡單的
分子軌道法計算了單環多烯的π
電子能級,提出了
4n+2規則;稱為休克爾規則。隨著微擾
分子軌道理論的建立和發展,使得休克爾規則的理論根據更加充分。
休克爾規則表明,對完全共軛的、單環的、平面多烯來說,具有(4n+2)個
π電子(這裡n是大於或等於零的整數)的分子,可能具有特殊芳香穩定性。隨著磁共振實驗方法的出現,對決定一化合物是否具有
芳香性起了重要的作用,並對芳香性的本質有了進一步的了解。因此芳香性更廣泛的含義為:分子必須是共平面的封閉
共軛體系;鍵發生了平均化;體系較穩定(有較大的
共振能);從實驗看,易發生環上的
親電取代反應,不易發生
加成反應;在
磁場中,能產生感磁環流;從
微觀上看,
π電子數符合
4n+2規則。
具有芳香性原因
為什麼4n+2個
π電子平面單環共軛體系才具有芳香性呢?從分子軌道
能級計算發現,當平面單環體系中的
成鍵軌道數目為2 n+1時,如果有4n+2個π電子剛好能給滿成鍵軌道,從而具有類似
惰性氣體的
電子排布,而將具有最大的成
鍵能而變得穩定,平面或接近平面, 電子的離域才有效;當環上的原子存在空間的排斥作用而破壞環的平面時,4n+2規則不適用。
在單環共軛多烯分子中,π電子數目符合4n+2規則具有
芳香性的原因 ,可以這種體系的分子軌道能級圖得到答案。在單環共軛多烯體系的分子軌道能級圖中,都有能量最低的成鍵軌道和能量最高的
反鍵軌道。對於能量最高的反鍵軌道,在
p軌道是單數時有兩個(
簡併軌道);在p軌道是
雙數時,只有一個。其它那些能量較高的
成鍵軌道和反鍵軌道或/和
非鍵軌道都是兩個(
簡併的)。根據休克爾理論,當成鍵軌道充滿電子時,它們具有與惰性氣體相似的結構,因此體系趨向穩定,除能量最低的成鍵軌道需要2個電子充滿外,其它能量較高的兩個成鍵軌道或/和非鍵軌道需要4個電子才能充滿,即只有(4n+2)個π電子才能充滿這些軌道,使體系處於穩定,而具有芳香性。
證明方法
休克爾4n+2規則可用微擾
分子軌道理論即PMO法從理論上加以證明。
在休克爾規則的啟示下,近二十年合成了芳香體系的化合物,於是出現了一系列非苯芳烴,及一些不含苯環結構,但具有一定程度的芳香性的烴,稱為非苯芳烴。
1. 環丁烯基二價正離子 它環上的四個碳都是sp
雜化的,
π電子數等於2,符合休克爾4n+2(n=0)規則,有
芳香性。
2. 環丁烯基雙負離子 它的π電子數等於6,環上的四個碳位於一個平面內,符合休克爾4n+2(n=1)規則,有芳香性。
3. 環辛三烯雙正離子 它的π電子數等於6,分子形狀是平面八邊行,符合休克爾4n+2(n=1)規則,有芳香性。
4. 環壬四烯負離子 它的π電子數等於10,環上碳原子近似於一個平面,符合休克爾4n+2(n=2規則,有芳香性。
5. 十二碳環六烯雙負離子 它是通過原來的六烯
環狀物的
還原性電解或與
鉀金屬作用以獲得,π電子數等於14,符合休克爾4n+2(n=3)規則,有芳香性。
6. 十六碳環八烯雙負離子也已製得,
π電子數等於18,符合理論判斷,它有
芳香性。
7. 蘭烴(又名阿族啉)是少數
共軛駢聯非苯烴,有芳香結構。此芳烴經X射線和電子衍射法測量它的鏈長大致相近而不相等,有較大的偶極距(1.08D),指出兩個環的電荷不等
環庚三烯帶正電荷,環戊二烯帶負電荷,彼此由電荷的“去”和“得”,而得到穩定。
8.
環戊二烯負離子當
環戊二烯懸浮於苯中的金屬鈉或鎂作用時形成環戊二烯
金屬化合物,它在
液態氨中有明顯的
導電性,證明了環戊二烯負離子的存在。環戊二烯負離子的π電子數目為兩個雙鍵上的四個和
亞甲基上的兩個,形成環狀六個π電子體系,符合休克爾4n+2規則,現已證明它是一個平面的對稱體系。從分子軌道理論計算結果,環戊二烯負離子是一個滿
電子構型體系,所以具有芳香性。
9.
環辛四烯負離子 在環辛四烯的四氫呋喃溶液中加入金屬鉀,.環辛四烯變成二價負離子,分子形狀由環辛四烯的澡盆型結構轉變為平面八邊形,共有10個π電子,符合休克爾4n+2規則,因此它具有
芳香性。
10.
環丙烯基正離子它的環是由三個sp
雜化的碳和2個
π電子組成的共軛體系,π電子數為2,符合爾4n+2規則,它有芳香性。
11.薁(yu,音“欲”)它是一個五元環的
環戊二烯和七元環的
環庚三烯稠合而成的。π電子數為10,符合休克爾4n+2規則,因此它具有芳香性。
12. 環十八碳九烯—[18]
輪烯它有十八個π電子,符合爾4n+2規則。。此芳烴經X射線證明,環中碳碳鍵長几乎相等,整個分子幾乎處於一個平面上,扭轉不大於0.1nm。說明輪內氫原子的排斥力很弱,它也具有一定的芳香性。
13. 1,3,5—環庚三烯正離子 它的環中亞甲基的碳是sp
雜化的,有空的p軌道,使平面的七個
碳原子變成環狀共軛體系,
π電子數為6,符合爾4n+2規則,它有芳香性。
同芳香性
此外,還有同芳香性,它是指某些
共軛雙鍵的環被一個或兩個
亞甲基所隔開,這個亞甲基在環平面之外,是環上的π電子構成芳香體系。如環壬三烯
正離子有兩個亞甲基在環平面之外環平面的碳行成共軛體系,π電子數為6,符合爾4n+2規則,它有芳香性。
兩個理論意義
休格爾規則不僅對六隅體學說提供了理論說明, 而且使得有機化學既不用實驗, 也不用計算就有對一個化合物的芳香性進行估計的可能性。在考慮(4n+2) 二電子數目必要條件以後,單環共平面是它的充分條件。