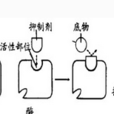
競爭性抑制劑是產生競爭性抑制作用的抑制劑。它與被抑制的酶的底物通常有結構上的相似性,能與底物競相爭奪酶分子上的結合位點,從而產生酶活性的可逆的抑制作用。而另一類競爭性抑制劑在化學結構和分子形狀上與底物無相似之處,因此並不在活性中心與酶結合,而是在活性中心以外的地方結合。然而一旦結合,酶的構象就發生變化,從而導致活性中心不能再結合底物。同樣,若底物先與活性中心結合,就會導致抑制劑結合部位的構象改變,致使抑制劑無法再與酶結合。因此,這一類競爭性抑制劑與底物在和酶結合這一點上也是相互排斥的。
第二種競爭性抑制劑與非競爭性抑制劑的差別在於,非競爭性抑制劑和底物可同時與酶結合形成三元複合物EIS,而前者不能。
基本介紹
概念解析
結構特徵
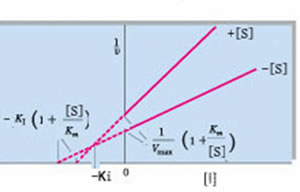
雙倒數方程
 競爭性抑制劑
競爭性抑制劑 競爭性抑制劑
競爭性抑制劑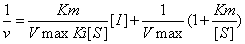 競爭性抑制劑
競爭性抑制劑計算公式
 競爭性抑制劑
競爭性抑制劑