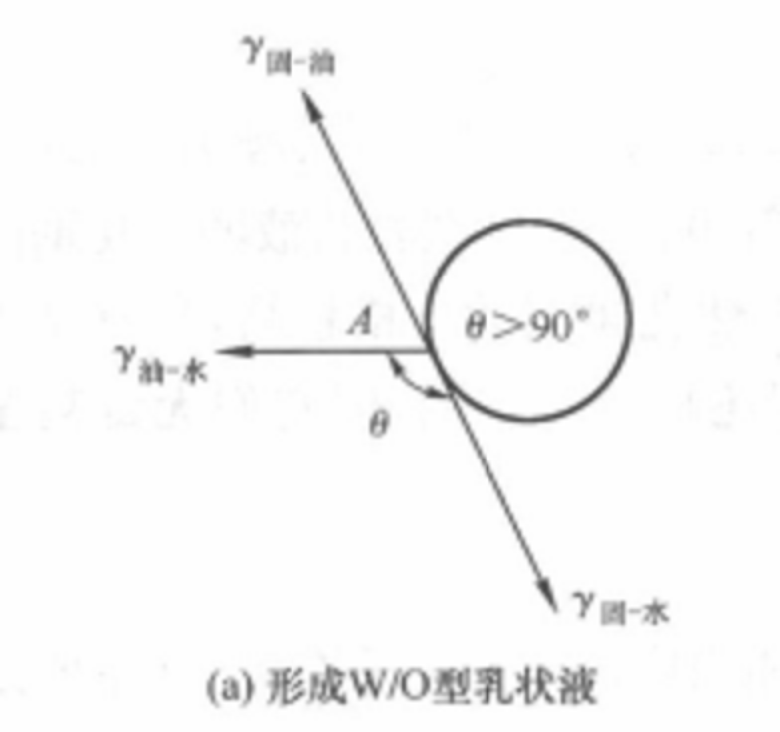
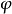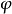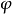穩定作用的規律
關於高分子化合物對溶膠的穩定性作用,大致有以下規律:
1、具有最少量的能蓋住溶膠粒子固體表面的高分子化合物才有穩定作用。顯然溶膠粒子的固體含量越多,比表面越高,所需要的高分子化合物的量也相應增加。但是,一旦在膠粒表面上形成了一個高分子薄層以後,過多的高分子化合物也不能增加它的穩定性,如下圖所示。
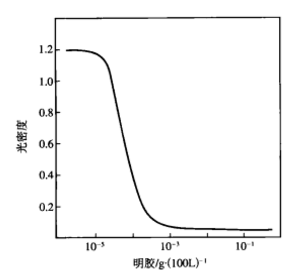 反應曲線
反應曲線若用0.0008mol/L KNO3來聚沉溶膠,用光密度來代表溶膠穩定性,可見明膠濃度為10-3g(100mL)時能使溶膠穩定,再多加明膠也並不能增加溶膠的穩定性。
2、溶膠被保護以後,它的一些物理化學性質,如電泳對電解質的敏感性等,會產生顯著的變化。這時體系的物理化學性質與所加入的高分子物質性質相近。例如,未經保護的溴化銀溶膠,它的電泳速率是溶液中Ag+濃度的函式,加入0.1%明膠以後,電泳速率與Ag+濃度無關,而是與pH有關,這顯然是明膠的性質。
3、因為高分子在溶膠表面上的吸附要有一定時間,所以加的方法和混合次序對溶膠穩定性都有影響。例如,先把明膠加到Fe(OH)3溶膠內再加NH4OH,不會有聚沉現象。如果將NH4OH先加到明膠溶液內,再將明膠加到Fe(OH)3溶膠內,則立即發生聚沉,這說明明膠在Fe(OH)3溶膠粒子上的吸附需要一定時間。
穩定作用的HVO理論
20世紀70年代以來,Hesselink等人用熱力學和統計力學方法研究了高分子溶液的分子形態,用於闡明高分子溶液對溶膠的穩定作用,取得較好的結果,這就是HVO理論。
該理論認為,吸附在固體表面上的高分子形態有三種:臥式(train)、環式(loop)和尾式(tail)。臥式是全部分子的鏈節都躺在固體的表面上,
環式是分子兩端都吸附於固體表面,尾式則僅有一端吸附於固體表面。所以在固體表面上的高分子並不是呈簡單的緊密整齊排列的單分子吸附層,而是具有一定的分布形式,粒子吸附高分子以後,相互接近時的粒子間相互排斥的位能大小,首先考慮兩個限制條件:①在固體表面上,已吸附的分子與溶液中的分子呈平衡狀態;②溶膠粒子相互碰撞時,固體表面的
吸附量不變,就是吸附在界面上的高分子的臥式部分鏈節數不變,伸向溶液內的鏈節將作重新排列。
當粒子相互碰撞時,吸附層會發生兩種變化:①表示吸附層被壓縮,沒有相互滲透,變形部分是相互作用區;②表示粒子表面上吸附層互相穿插,不壓縮被吸附的分子,構成了相互滲透區。其實這兩種都是理想情況,在實際體系中這兩種作用兼有。只是以哪種作用為主而已。下圖中a的相斥位能來自被吸附的高分子的壓縮變形,是構型熵的損失,稱為體積限制效應。下圖中b的相斥位能來自局部濃度的增高,產生局部滲透壓,稱為滲誘壓的限制效應。
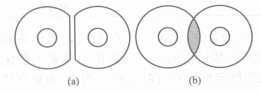 穩定作用的兩種情況
穩定作用的兩種情況穩定作用影響因素
高分子在固體表面上有
吸附與不吸附兩種情況。對溶膠粒子而言,前者可以產生空間穩定作用,後者可產生空位穩定作用。當高分子不吸附於固體表面,甚至是負吸附,在固體表面上的高分子濃度低於體相濃度,在表面上形成有空缺的吸附層,這樣的體系高分子濃度達到適宜程度後,會起到穩定溶膠的作用。若濃度不適宜,也可起到絮凝作用,稱為空位絮凝作用。
空位穩定作用的主要影響因素如下。
1、高分子的摩爾質量及其濃度描述不同摩爾質量的高分子絮凝溶膠時,需用到臨界絮凝濃度(CFC)和臨界穩定濃度(CSC)兩個概念。CFC是指開始絮凝時的高分子濃度,用體積分數
2*表示。CSC是指溶膠的位能為峰值時,足以使溶膠穩定的相應濃度,此濃度也用體積分數
2**表示,它在高濃度時總是大於硝值,故可用
2*和
2**討論影響溶膠的穩定因素。高分子的摩爾質量越大,它的
2*和
2**值越小,這說明好的絮凝劑也是好的穩定劑。
2、溶膠粒子大小粒子半徑r若大,
2*和
2**就小,這說明高分子對分散體系有較好絮凝作用和穩定作用。
3、溶劑性質溶劑直接影響高分子的溶解度及其分子在溶液中的形狀,良溶劑可使高分子充分伸展,因而
2*和
2**值都較小。對不良溶劑,高分子在溶液中呈捲曲狀,它與溶劑分子的相互作用小。可見良溶劑時低濃度下有更強的絮凝能力,高濃度下有更強的穩定能力。當高分子溶液中有兩種不同摩爾質量的溶質時,會對溶膠同時產生空間穩定作用和空位穩定作用。若高摩爾質量的被吸附,而低摩爾質量的為自由分子,則吸附層厚度大於空位層厚度,主效應為吸附層的作用,即空間穩定作用。若低摩爾質量的被吸附,而高
摩爾質量的是自由分子,則吸附層厚度小於空位層厚度,空位穩定性起主導作用。
 反應曲線
反應曲線 穩定作用的兩種情況
穩定作用的兩種情況