研究歷程
1682年,已實現了將動物器官移植給人類這種技術。當時,荷蘭外科醫生米克倫(Job Janszoon van Meekeren)報告稱,他在修補一名俄羅斯士兵的頭骨時,使用了一片狗骨頭碎片。
 豬和狒狒的"換心"試驗成功
豬和狒狒的"換心"試驗成功1902年,阿里克西斯·卡雷爾(Alexis Carrel)開創的血管縫合術在為首批異種器官移植開闢了道路,但直到20世紀60年代才取得了實質性進展。那時,外科醫生將靈長類動物的器官移植給人類,然而多數手術都在幾個月內失敗,病人也因此死亡。
1905年,法國的Princeteau進行了世界第一例異種器官移植手術。將兔腎植入腎功能衰竭兒童體內,手術很成功,但16天后由於
排異反應,兒童死於肺部感染。之後,世界各地的研究者逐步加入到異種移植器官研究之中。在人體的某些臟器功能失去作用時,移植動物器官能在人體記憶體活一段時間並能發揮作用,待找到合適的
人體器官後再進行移植。用實驗動物的組織和器官代替人類的器官有以下優點:動物器官取之不盡;動物器官比
人造器官更具自然和生物性;動物器官隨用隨取,可克服使用
人體器官存在的各種倫理及法律問題。
1920年,俄國醫生甫洛諾夫(Serge Voronoff)為了給病人注入青春的活力,將黑
猩猩的睪丸切片植入老年男子的陰囊內,10年後,已有數
百人接受了這樣的手術,女性也接受猩猩
卵巢組織移植以治療
更年期症狀
1967年12月3日,人類首次心臟移植手術成功。51年後,科學家成功將豬的心臟移植到狒狒體內,並存活195天。
2008年,患者克勞迪婭-卡斯蒂諾(Claudia Castillo)接受了一個來自死亡捐獻者的氣管移植器官,研究人員從捐獻者體內提取氣管,進行大小剪裁,然後放入從克勞迪婭體內提取的
幹細胞培養環境腳手架中,最終發育形成相應的氣管組織。
2009年,美國明尼蘇達州立大學
幹細胞科學家桃瑞絲-泰勒(Doris Taylor),在實驗室中實現了為新培育的微型心臟連線
人造血液供給,人造心臟能夠像正常老鼠體內的心臟一樣跳動,這種心臟覆蓋著一層老鼠心臟去細胞組織的“腳手架”,而且新培育的老鼠心臟組織是基於另一隻老鼠的幹細胞培育而成。
2015年11月,器官移植已成為許多終末期疾病首選的治療方法,全世界至今接受心、肝、腎等移植者已達60餘萬例,隨著外科手術的成功,
免疫抑制劑的不斷發展,移植成功率的提高,出現了供體嚴重短缺現象,異種移植已成為研究的方向。只有1/2的患者有機會接受移植,大約有1/5的患者在等待中死亡。
2018年12月5日,世界權威科學期刊《自然》發布經過基因編輯的豬心臟移植進狒狒體內後正常存活超過半年。
試驗過程
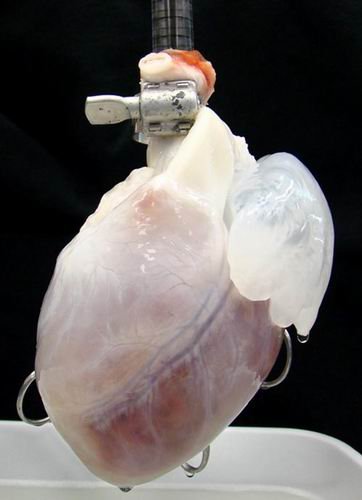 異種器官移植
異種器官移植2008年,患者克勞迪婭-卡斯蒂諾重複性地試著培育豬的心臟和肝臟,對於豬器官的培育將更簡單一些,因為豬的體型更大,要比處理培育體型較小的老鼠器官更容易。預計去細胞化的移植肝臟器官將比心臟更早地培育出來。
科學家史蒂文-巴迪拉克(Steven Badylak)稱,現已研究出如何在老鼠體內培育肝臟去細胞培育法,只是該技術尚未發布。此外,美國麻薩諸塞州總醫院的研究小組負責人馬丁-亞穆什(Martin Yarmush)培育了人造可移植老鼠肝臟器官,從而證明在實驗室內可以培育出具備肝功能的移植器官。據該研究小組成員科庫特-尤岡(Korkut Uygun)稱,研究小組的最終目標是培育出人體去細胞移植器官,並不僅是簡單的動物器官。
2009年美國明尼蘇達州立大學
幹細胞科學家桃瑞絲-泰勒(Doris Taylor)的方法非常簡單:從人體捐獻者或其他動物身體上提取器官,然後用溫性洗滌劑去除器官上的肌肉、細胞和
DNA,只保留一種叫做“免疫惰性”
蛋白質的內部“腳手架”蛋白質,從相關患者體內提取
幹細胞附加在這個“裸體腳手架”上,來自患者體內的幹細胞在培育過程中,會對移植器官起到主體免疫功能,並避免主體遭受由於移植器官導致的新感染。
2018年12月5日,據《自然》最新發布的論文,這個豬心臟移植試驗始於2015年,歷時3年時間。德國科學家選取了14隻幼年豬,將它們的心臟取出進行人源化的基因修飾。14隻狒狒被分成3組,科學家用三種不同的方式將豬的心臟移植到狒狒身上。
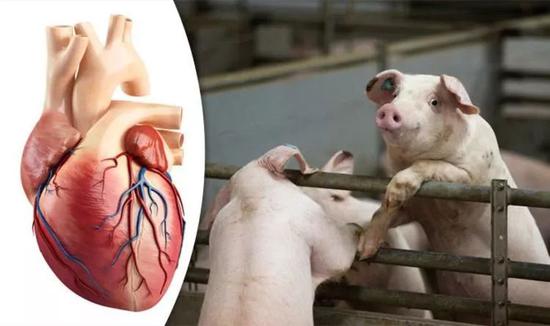 豬心臟移植試驗
豬心臟移植試驗前兩組試驗中,狒狒接受移植後都沒能活過40天。最後一組試驗,5隻狒狒在接受移植前接受了降血壓治療,因為豬的血壓低於狒狒。結果移植心臟生長速度比原有心臟還快,手術後2隻狒狒存活3個多月,還有兩隻分別存活182天和195天。
技術難點
桃瑞絲這種培育的複雜器官面臨的較大挑戰是如何確保所有的器官內細胞與患者的
血液相溶合,如果沒有血液進入,移植器官中心的細胞則會嚴重缺氧,導致移植後細胞死亡。桃瑞絲稱,她有辦法能夠克服這種困難。2008年1月,她帶領的一支研究小組實現了較大的技術突破,他們基於新生老鼠心臟細胞培育出一個跳動中的心臟,這個心臟保持著3D外形,其內部充滿著所有血管。當他們植入一些新的細胞,會生長出
血管組織。此外,桃瑞絲表示他們幾乎能夠重新培育出帶有細胞的完整血管系統,其中包括動脈、靜脈和毛細血管。她說:“由於我們培育出了血管,新的移植器官能夠與患者身體的
血液供給系統自然地連線在一起。”在移植心臟器官的培育過程中,
幹細胞轉換成為心室和心房的內皮細胞,還可形成血管和心臟
平滑肌細胞。
匹茲堡大學醫學院的大衛-庫珀(David Cooper)是異種
器官移植技術的主要研發人員,他指出,“裸體”豬心臟仍攜帶著alpha-Gal抗原體,人體免疫系統能夠識別,並遭受其攻擊。但是
倫敦大學學院再生醫學教授克莉絲-梅森(Chris Mason)指出,許多培育的去細胞豬器官都沒有施用輔助免疫藥物,必須對豬器官內對
人體免疫系統構成攻擊的物質徹底消除,否則未來數百萬名患者一旦接受豬心臟移植後將出現
心臟瓣膜和相關組織的副作用。
排異反應
成為培育人類移植心臟“腳手架”
動物器官異種移植排異過程在某些方面與同種排斥相似,可以借鑑。但異種移植又有其特性:細胞表面存在更多的“異物”,會與
宿主產生強烈的反應,這種跨物種間的移植存在較大的分子差異,包括天然抗體、
補體、NK細胞和巨噬細胞等。常出現的超急性排異反應(HAR),排異反應在
血液循環後幾分鐘或數小時發生,也可在24-48小時內發生不可逆轉
體液排斥反應,較常見的發生在手術台上;
急性血管性排斥反應(AVR),血管化臟器移植後數天到數周間發生,也是不可逆轉性體液排斥反應,常發生在手術後早期,病情進展迅速;加速性細胞排斥反應(TMR),受者循環血液中存在抗供者
抗體並不一定引起HAR和AVR的情況下,可能出現加速性細胞排斥反應。該反應對
免疫抑制劑抑制效果不良。受者抗供者抗體的存在可促進抗體依賴性細胞介導的細胞毒作用,促使發生細胞性
排斥反應,病理表現以間質水腫和局限性炎性細胞浸潤為特徵,細胞浸潤的局部毛細血管內皮細胞變性和壞死。異種移植的免疫障礙也遠遠大於同種移植(Allografts)。
 異種器官移植
異種器官移植異種器官移植排斥反應類型
依據供、受者種族遺傳背景差異程度分為協調性(Concordant)和非協調性(Discordant)。協調性異種移植髮生在種屬較近的動物之間,如大鼠與小鼠之間;非協調性異種移植則在種系發生較遠的種屬間進行,排斥以分鐘或小時計,常導致HAR發生,如豬器官移植到人、
豚鼠與大鼠之間的移植。有學者將協調性異種移植分為困難型和容易型;依據
排斥反應發生
機理將非協調性異種移植分為抗體型和非抗體型兩類。所不同的是在協調性異種移植中是誘生抗體,而在非協調性移植中則是預存天然抗體。
存在問題
雖然異種器官移植給人類移植器官的短缺帶來希望,但有些科學實驗表明還有令人擔心的問題存在。美國加州斯克里普斯研究所丹尼爾·沙羅門等人在實驗中發現,豬體內普遍存在的“豬內生逆轉錄酶
病毒”能感染人體細胞。沙羅門等還發現,將豬胰腺細胞移植給免疫功能受到抑制的實驗鼠後,該病毒會被激活,使鼠機體多種組織受到感染。
 異種器官移植
異種器官移植科學家尚未發現該
病毒對豬有害,受感染的實驗鼠也未患上疾病。但是,人體被該
病毒感染後會產生什麼後果,目前還不得而知。不同動物體內有不同的微生物群,對一種動物無害的
病毒,在另一種動物身上可能造成嚴重危害,這並非沒有先例。1997年,英國
倫敦大學學院的羅賓·韋斯等就曾報告說,他們在豬體內發現了兩種新型
病毒。這兩種
病毒不僅不損害豬的健康,而且一定程度上還能增強豬的機體功能。然而它們卻能使猴子、貓和某些鳥類患上
白血病。從其結構推斷,科學家認為它們也可能會讓人類患上
白血病。
科學家擔心,人類對豬體內的各種
病毒還了解得太少,將豬器官移植給人存在風險,甚至有可能引發新型大規模傳染病,產生不堪構想的後果。
儘管
病毒問題給異種器官移植的前景投下重重陰影,許多科學家仍贊成繼續這類研究。他們指出,異種器官移植具有極大醫療潛力,不應半途而廢。科學家們呼籲深入研究豬體內的
病毒並尋求相應的對付方法,同時對移植試驗進行嚴格的審查與控制。
 豬和狒狒的"換心"試驗成功
豬和狒狒的"換心"試驗成功 異種器官移植
異種器官移植 豬心臟移植試驗
豬心臟移植試驗 異種器官移植
異種器官移植 異種器官移植
異種器官移植
 豬和狒狒的"換心"試驗成功
豬和狒狒的"換心"試驗成功 異種器官移植
異種器官移植 豬心臟移植試驗
豬心臟移植試驗 異種器官移植
異種器官移植 異種器官移植
異種器官移植