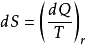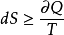熵的定義
熱力學定義
在
熱力學中,
熵是系統的熱力學參量,它代表了系統中不可用的能量,衡量系統產生自發過程的能力。熵增加,系統的總能量不變,但其中可用部分減少。孤立系統的熵不會減少,這也是
熱力學第二定律的表現之一。
統計學定義
在統計學中,熵衡量系統的無序性,代表了系統在給定的巨觀狀態(如溫度、壓強、體積等等)下,處於不同微觀狀態的可能性,或者說構成該巨觀系統的微觀方式的數量。舉例,已知在3個盒子裡有3個球,這個是系統的巨觀狀態,微觀狀態則是球在不同盒子間的分布(如3個球全部在第一個盒子,或者一個盒子裡有一個球等等)。熵越高的系統就越難精確描述其微觀狀態。
熵介紹
熵的定義
熵,熱力學中表征物質狀態的參量之一,用符號S表示,其物理意義是體系混亂程度的度量。
(1)經典熱力學
1865年,克勞休斯將發現的新的狀態函式命名為熵,用增量定義為
,式中T為物質的熱力學溫度;dQ為熵增過程中加入物質的熱量。
若過程是不可逆的,則
,下標“ir”是英文單詞“irreversible‘’的縮寫,表示加熱過程所引起的變化過程是不可逆的。
合併以上兩式可得
,此式叫做克勞休斯不等式,是熱力學中第二定律最普遍的表達式。
(2)統計熱力學
熵的大小與體系的微觀狀態Ω有關,即S=klnΩ,其中k為玻爾茲曼常量,k=1.3807x10-23J·K-1。體系微觀狀態Ω是大量質點的體系經統計規律而得到的熱力學機率,因此熵有統計意義,對只有幾個、幾十或幾百分子的體系就無所謂熵。
熵的性質
(1)狀態函式
熵S是狀態函式,具有加和(容量)性質(即對於系統M可分為M1與M2,則有SM=SM1+SM2),是廣度量非守恆量,因為其定義式中的熱量與物質的量成正比,但確定的狀態有確定量。其變化量ΔS只決定於體系的始終態而與過程可逆與否無關。由於體系熵的變化值等於可逆過程熱溫商δQ/T之和,所以只能通過可逆過程求的體系的熵變。孤立體系的可逆變化或絕熱可逆變化過程ΔS=0。
(2)巨觀量
熵是巨觀量,是構成體系的大量微觀離子集體表現出來的性質。它包括分子的平動、振動、轉動、電子運動及核自旋運動所貢獻的熵,談論個別微觀粒子的熵無意義。
(3)絕對值
熵的絕對值不能由熱力學第二定律確定。可根據量熱數據由第三定律確定熵的絕對值,叫規定熵或量熱法。還可由分子的微觀結構數據用統計熱力學的方法計算出熵的絕對值,叫統計熵或光譜熵。
熵增原理
熵增原理就是孤立熱力學系統的熵不減少,總是增大或者不變。用來給出一個孤立系統的演化方向。說明一個孤立系統不可能朝低熵的狀態發展即不會變得有序。
系統經絕熱過程由一狀態達到另一狀態熵值不減少——熵增原理(the principle of the increase of entropy)
對
絕熱過程,Q = 0 ,有ΔS(絕熱)≥ 0(大於時候不可逆,等於時候可逆) 或 dS(絕熱)≥0 (>0不可逆;=0可逆)
熵增原理表明,在絕熱條件下,只可能發生dS≥0 的過程,其中dS = 0 表示可逆過程;dS>0表示不可逆過程,dS<0 過程是不可能發生的。但
可逆過程畢竟是一個理想過程。因此,在絕熱條件下,一切可能發生的實際過程都使系統的熵增大,直到達到
平衡態。
玻爾茲曼曾經通過仔細研究兩個球形分子碰撞前與碰撞後的景象,宣稱能證明碰撞前的熵小於撞後的熵,因此熵在增加。但是他的證明是錯的,原因是如果是這樣,同樣的論證過程可以運用在時間的反方向上,那么也應該是熵增,時間反方向上熵增,也就說明正方向上是熵減。
化學熱力學
在化學中,一般認為大部分化學反應都是一定條件下可逆的,換言之“可以從前向後也可以從後向前”。事實上,一定條件下
化學反應的方向判定並非易事。在已知
焓變不足以確定化學反應方向時,為了確定一定條件下化學反應的方向,熱力學定義“熵”被引入了化學中。由
熵增原理可以推導出,化學反應向著“混亂度增大”,熵增大的方向進行,即趨向於ΔrS>0。(r為英語單詞reacting的詞頭,意思是化學反應中)
但是實際計算中,由於狀態數Ω不可直接求得,僅僅依靠熵的定義式S=klnΩ是無法確定
熵變的。此時需要另外一個公式:ΔS=Qr/T。此處ΔS為
熵變,Qr為熱量,T為熱力學溫度,單位為K。依靠這個公式可以計算出反應的熵變,從而判斷化學反應的方向,但是計算較為困難,在不恆溫時利用此式運算需要用到積分的數學手法。
我們知道給定環境中體系的熵是固定的,因此人們把在298K時1mol某種物質的熵稱為“
標準摩爾熵”,即“
標準熵”。符號為SmΘ(Θ讀作“西塔”,意思是標準狀況)。比如,SmΘH2(g)=130.57J/(mol·K)。由標準熵我們可以求得化學反應的標準摩爾熵變ΔrSmΘ:
ΔrSmΘ=∑viSmΘ(生成物)-∑viSmΘ(反應物)
此外,由ΔS=Qr/T可看出ΔS受T變化影響較小,因此在情況需要時可以直接將標準熵套入計算。
利用求得的摩爾熵變與焓變,可以通過ΔG=ΔH-TΔS計算出反應的吉布斯自由能降低量,設反應所做的非體積功為W,則
1.若W+ΔG<0,反應不可逆自發進行;
2.若W+ΔG=0,反應可逆進行;
3.若W+ΔG>0,反應無法進行。
由此可以準確無誤判斷一定條件下化學反應是否進行,這就是熵與熵增在化學熱力學中的套用。