基本介紹
- 中文名:氫氧化鈣
- 英文名:calcium hydroxide
- 別稱:熟石灰、消石灰
- 化學式:Ca(OH)2
- 分子量:74.096
- CAS登錄號:1305-62-0
- EINECS登錄號:215-137-3
- 熔點: 580℃
- 沸點:2850 ℃
- 水溶性:1.65 g/L (20℃)(微溶)
- 密度:2.24 g/mL(25 ℃)
- 外觀:白色粉末狀固體
- 套用:水溶液可驗證二氧化碳,建材
- 安全性描述:石灰水可以用於殺菌劑和化工原料
- 危險性符號:C/Xi
- 危險性描述:腐蝕性物品/刺激性物品
- 危險品運輸編號:UN 3262 8/PG 3
- 摩爾質量:74.093g/mol (g·mol-1)
- 酸鹼性:鹼性
研究簡史,計算化學數據,編號系統,理化性質,物理性質,化學性質,毒理學數據,製備方法,工業製備,實驗室製備,套用領域,安全措施,健康危害,急救措施,危害防治,安全術語,風險術語,儲存運輸,運輸方法,儲存方法,
研究簡史
中國是生產和利用石灰最早的國家之一。據考古資料考證,在中國黃河流域多處龍山期文化遺址中,已見到了用石灰抹面的光潔堅實的牆壁和地面(約公元前2800-2300年)。據用C-14測定,龍山期遺址中所用的石灰已是人工煅燒製成的。
近代工業的發展,石灰作為土木建築工程的主要材料之外,在許多新興的工業部門又開闢了多種用途。如冶金、玻璃、制鹼製糖、造紙、製革、電石及有機化工、碳化磚、碳化板以及土壤改良、水處理、氣體淨化等方面都使用了大量石灰。
計算化學數據
1、疏水參數計算參考值(XlogP):無
2、氫鍵供體數量:2
3、氫鍵受體數量:2
4、可旋轉化學鍵數量:0
5、互變異構體數量:無
6、拓撲分子極性表面積:2
7、重原子數量:3
8、表面電荷:0
9、複雜度:0
10、共價鍵單元數量:3
編號系統
CAS號:1305-62-0
MDL號:MFCD00010901
EINECS號:215-137-3
RTECS號:EW2800000
理化性質
物理性質
密度(g/mL,25/4℃):2.24
熔點(ºC):580
沸點(ºC,常壓):2850
溶解性
氫氧化鈣在水(100g)中的溶解度隨溫度(單位為℃)的變化為:
0度 | 0.185g |
10度 | 0.176g |
20度 | 0.165g |
30度 | 0.153g |
40度 | 0.141g |
50度 | 0.138g |
60度 | 0.116g |
70度 | 0.106g |
80度 | 0.094g |
90度 | 0.085g |
對於氫氧化鈣的溶解度隨著溫度升高而降低的問題,主流的解釋是,因為氫氧化鈣有兩種水合物〔Ca(OH)2·2H2O和Ca(OH)2·12H2O〕。這兩種水合物的溶解度較大,無水氫氧化鈣的溶解度很小。隨著溫度的升高,這些結晶水合物逐漸變為無水氫氧化鈣,所以,氫氧化鈣的溶解度就隨著溫度的升高而減小。
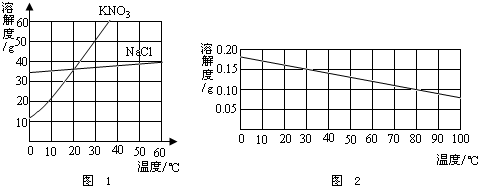 氫氧化鈣溶解度曲線
氫氧化鈣溶解度曲線化學性質
鹼性
化學方程式
1、氫氧化鈣與二氧化碳反應:
CO2+Ca(OH)2=CaCO3↓+H2O
2、氫氧化鈣與酸反應,生成鹽和水。
2、氫氧化鈣與酸反應,生成鹽和水。
稀鹽酸與氫氧化鈣反應:
2HCl+Ca(OH)2=CaCl2+2H2O
 氫氧化鈣與二氧化碳反應
氫氧化鈣與二氧化碳反應3、氫氧化鈣與某些鹽反應,生成另一種鹼和另一種鹽。
碳酸鈉溶液與氫氧化鈣反應:
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
硝酸銨與氫氧化鈣反應:
2NH4NO3+Ca(OH)2=2NH3↑+2H2O+Ca(NO3)2
2NH4NO3+Ca(OH)2=2NH3↑+2H2O+Ca(NO3)2
氯化鎂與氫氧化鈣反應:
MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓
毒理學數據
急性毒性:大鼠口經LD50:7340mg/kg;小鼠口經LD50:7300mg/kg。
屬強鹼性物質,有刺激和腐蝕作用。吸入粉塵,對呼吸道有強烈刺激性,還有可能引起肺炎。眼接觸亦有強烈刺激性,可致灼傷。
製備方法
工業製備
1、石灰消化法
將石灰石在煅燒成氧化鈣後,經精選與水按1:(3~3.5)的比例消化,生成氫氧化鈣料液經淨化分離除渣,再經離心脫水,於150~300℃下乾燥,再篩選(120目以上)即為氫氧化鈣成品。
CaCO3→CaO+CO2↑
CaO+H2O→Ca(OH)2。
將石灰石在煅燒成氧化鈣後,經精選與水按1:(3~3.5)的比例消化,生成氫氧化鈣料液經淨化分離除渣,再經離心脫水,於150~300℃下乾燥,再篩選(120目以上)即為氫氧化鈣成品。
CaCO3→CaO+CO2↑
CaO+H2O→Ca(OH)2。
2、將試劑氯化鈣溶於水中,製得25%的水溶液,加熱至80℃,然後分次加入濾過的30%的氫氧化鈉溶液 ( 可超過理論量30%) ,反應得到氫氧化鈣,所得漿狀混合物經抽濾後洗滌,先用0.1%的氫氧化鈉水溶液洗去大量氯離子,然後用蒸餾水洗至氯離子合格。
3、擴散法
首先配製兩種溶液:一為30g重結晶的CaCl2·6H2O溶於50mL水中;一為12gNaOH溶於50mL水並滴加少量Ba(OH)2的沉澱碳酸鹽。將兩種溶液分別裝滿兩個50mL的燒杯中。將兩個燒杯小心地放在同一個容器中,燒杯距離容器的上緣2cm,蓋好容器蓋,靜置4周后有1cm左右的針狀結晶生長出來,收集過濾,快速水洗,再依次用稀鹽酸、水、乙醇、乙醚洗滌,最後在短時間內於110℃進行乾燥。
3、擴散法
首先配製兩種溶液:一為30g重結晶的CaCl2·6H2O溶於50mL水中;一為12gNaOH溶於50mL水並滴加少量Ba(OH)2的沉澱碳酸鹽。將兩種溶液分別裝滿兩個50mL的燒杯中。將兩個燒杯小心地放在同一個容器中,燒杯距離容器的上緣2cm,蓋好容器蓋,靜置4周后有1cm左右的針狀結晶生長出來,收集過濾,快速水洗,再依次用稀鹽酸、水、乙醇、乙醚洗滌,最後在短時間內於110℃進行乾燥。
4、將鹼金屬的氫氧化物溶液與鈣鹽的水溶液作用可得氫氧化鈣。將46g四水硝酸鈣溶於經過煮沸排除氣體的500mL的蒸餾水中,冷卻至0℃,邊振盪邊分多次加入1mol/L的氫氧化鉀溶液(不含CO2),滴加過程中保持溶液為0℃,過濾分離析出的Ca(OH)2沉澱,用12L水分若干次傾析洗滌,吸濾沉澱在硫酸(相對密度1.355)乾燥器中真空乾燥20h可得Ca(OH)2。
實驗室製備
將生石灰(CaO)放入燒杯加入水。氧化鈣和水反應,放出熱量,生成物是氫氧化鈣。反應式:CaO+H2O→Ca(OH)2。
套用領域
1、可作生產碳酸鈣的原料。
2、氫氧化鈣屬鹼性,因而可以用於降低土壤的酸性,從而起到改良土壤結構的作用。農藥中的波爾多液正是利用石灰乳(溶於水的氫氧化鈣)和硫酸銅水溶液按照一定的比例配製而出的。冬天,樹木過冬防蟲,樹木根部以上塗80公分的石灰漿。 氫氧化鈣套用領域
氫氧化鈣套用領域
 氫氧化鈣套用領域
氫氧化鈣套用領域3、優質品主要用於生產環氧氯丙烷、環氧丙烷。
4、可用在橡膠、石油化工添加劑中,如石油工業加在潤滑油中,可防止結焦、油泥沉積、中和防腐。
5、用於製取漂白粉、漂粉精、消毒劑、制酸劑、收斂劑、硬水軟化劑、土壤酸性防止劑、脫毛劑、緩衝劑、中和劑、固化劑等。
6、氫氧化鈣和空氣中二氧化碳還會發生反應從而形成難溶於水的碳酸鈣。製糖工業生產中,先利用氫氧化鈣中和糖漿中的酸,然後通入二氧化碳和剩餘氫氧化鈣反應生成沉澱物被過濾出去,以此減少糖的酸味。
安全措施
健康危害
氫氧化鈣粉塵或懸浮液滴對黏膜有刺激作用,能引起噴嚏和咳嗽,和鹼一樣能使脂肪皂化,從皮膚吸收水分、溶解蛋白質、刺激及腐蝕組織。吸入石灰粉塵可能引起肺炎。
急救措施
皮膚接觸:應立即用大量水沖洗,再塗上3%-5%的硼酸溶液。
眼睛接觸:立即提起眼瞼,用流動清水或生理鹽水沖洗至少15分鐘。或用3%硼酸溶液沖洗。就醫。
吸入:迅速脫離現場至空氣新鮮處。必要時進行人工呼吸,就醫。
食入:應儘快用蛋白質之類的東西清洗乾淨口中毒物,如牛奶、優酪乳等奶質物品。患者清醒時立即漱口,口服稀釋的醋或檸檬汁,就醫。
危害防治
呼吸系統防護:必要時佩帶防毒口罩。
眼睛防護:戴化學安全防護眼鏡。
防護服:穿工作服(防腐材料製作)。
手防護:戴橡皮手套。
其它:工作後,淋浴更衣。注意個人清潔衛生。
安全術語
S26:不慎與眼睛接觸後,請立即用大量清水沖洗並徵求醫生意見。 危險品
危險品
 危險品
危險品S37:戴適當手套。
S39:戴護目鏡或面具。
風險術語
R41:對眼睛有嚴重傷害。
儲存運輸
運輸方法
起運時候包裝要完好,裝載應穩妥。運送過程之中要保證容器不走漏、不坍毀、不掉落、不損壞。嚴禁和易燃物或可燃物、酸類、食用化學品等混裝混運。雨天不宜運送。
儲存方法
貯存於陰涼、通風的倉庫。庫內濕度最佳不大於85%。包裝有必要完好密封,避免吸潮。應與易(可)燃物、酸類等分隔暫存,切忌混儲。儲區應該備有適宜的資料收留泄漏物。

