溶劑效應(solvent effect)亦稱“溶劑化作用”。指液相反應中,溶劑的物理和化學性質影響反應平衡和反應速度的效應。溶劑化本質主要是靜電作用。對中性溶質分子而言,共價鍵的異裂將引起電荷的分離,故增加溶劑的極性,對溶質影響較大,能降低過渡態的能量,結果使反應的活化能減低,反應速度大幅度加快。了解溶劑效應,有助於研究有機物的溶解狀況和反應歷程。
基本介紹
- 中文名:溶劑效應
- 外文名:solvent effect
- 別稱:溶劑化作用
- 作用:影響溶液內的反應平衡及速率
- 本質:靜電作用
- 學科:有機化學
基本簡介,溶劑效應的模擬,溶劑效應對發光的影響,溶劑效應相關,溶劑的分類,溶劑極性對反應速率的影響,
基本簡介
對於等極性過濾態和自由基過濾態反應,溶劑效應較小;對於偶極過渡態反應,溶劑效應較大,例如非質子偶極溶劑的特點是正端藏於分子內部,負端露於分子外部,負端可以與正離子起作用,而正端卻不能與負離子起作用,因此,在非質子溶劑中,用負離子作為試劑時,由於它不被溶劑分子包圍,可以很容易地進行反應,成為加快反應速度的重要手段。 溶劑效應
溶劑效應
 溶劑效應
溶劑效應溶劑效應對反應的影響的關注歷史悠久。不同的溶劑可以影響反應速率,甚至改變反應進程和機理,得到不同的產物。溶劑對反應速率的影響十分複雜,包括反應介質中的離解作用、傳能和傳質、介電效應等物理作用和化學作用,溶劑參與催化、或者直接參與反應(有人不贊成將溶劑參與反應稱作溶劑效應)。
溶劑效應的模擬
通常我們對溶劑效應的靜態模擬,關心的是溶劑效應的兩個方面:一是溶劑分子反應中心有鍵的作用,包括配位鍵和氫鍵等,這種作用屬於短程作用,另一個是極性溶劑的偶極距和溶質分子偶極距之間的靜電相互作用,這個屬於遠程作用,當然溶劑和溶質之間的色散力作用也是重要的遠程作用,特別是對於非極性溶劑而言,但是色散力的描述是量子化學模擬的一個難題。
高斯計算時,考慮溶劑效應,可以採用三種策略:
對於短程作用十分重要的體系,我們採用microsolvation model,或者稱為 explicit Solvation model。直接考慮溶劑分子和反應中心的作用。
對於沒有短程作用的體系,我們直接用虛擬溶劑模型(Implicit Solvation Model)來模擬遠程作用。這種虛擬溶劑模型通常是把溶劑效應看成是溶質分子分布在具有均一性質的連續介質(Continuum)當中,也稱為反應場(Reaction Field)。
短程作用的microsolvation model和遠程作用的連續介質(Continuum)模型結合起來的方法漸漸為人們所青睞。這種方法得到的結果更為可靠,因為它綜合考慮的溶劑的短程作用和遠程作用。
短程作用的模擬,很直觀的直接採用QM的方法研究溶劑分子作用了的活性中心,考慮這種成鍵對反應區域和反應過渡態結構和能量的影響。遠程作用需要做一些物理上的近似處理(也就是一定的物理模型)。連續介質(Continuum)模型有很多,作為常用的是PCM (極化連續介質模型,Polarized Continuum Model)。其他一些常用的連續介質模型還包括Onsager,COSMO,SMx等等。PCM最早於1981年由Tomasi教授(義大利比薩大學)提出。
涉及到三個概念cavity formation, dispersion-repulsion 和electrostatic interaction。在連續的介質中騰出空穴(cavity)以容納溶質,會導致體系能量升高,這部分的能量稱為cavity formation energy。空穴中的溶質和溶劑的作用,主要是范德華力的作用 (不包括靜電作用)。這部分能量稱為分散-排斥能(dispersion-repulsion energy),一般為負值(能量降低)。溶質分子的電荷分布會通過靜電作用使連續介質(溶劑)產生極化,而溶劑的極化作用反過來又會影響到溶質分子的電荷分布。這就是靜電的相互作用(electrostatic energy),使體系能量降低。三項能量的加和得到了溶劑化自由能(free energy of solvation),前兩項的能量與空穴表面積接近成正比關係,在PCM模型中,這兩項能量由表面積結合一些與原子特性相關的半經驗參數計算而得。
溶劑效應對發光的影響
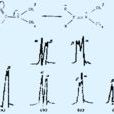
一般化合物的單重態激發壽命τ約10-9s,而許多有機溶劑分子在室溫下的介電取向弛豫時間τ在10-12~10-10s內,即在室溫下,溶劑分子的取向弛豫時問小於單重態激發態分子的平均壽命。在這種情況下,溶質分子和溶劑介質分子間新的平衡將在溶質分子被激發後,且先於螢光發射而重新建立起來。由於新的平衡的建立,會有部分激發態的能量被傳遞給溶劑,這樣螢光發射的峰值波長就會紅移,這就是溶致變色現象。此外不同極性的有機溶劑,其分子和溶質分子之間的作用也不同,導致螢光發射的峰值波長紅移的程度也不同。下圖為發光化合物分子在溶劑中電子能級構型與激發態壽命和溶劑分子取向弛豫時間τR的關係。從圖中可以看出,溶劑分子與發光分子之間的相互作用,導致基態與激發態的能級下降。由於激發態壽命τ與溶劑分子的取向弛豫時間τR存在差異,這樣導致分子激發態的壽命τ和取向弛豫時間τR存在3種關係。當τ《τR即發光分子的壽命很短時,溶劑分子對發光分子的影響不存在,就不會發生溶致變色現象。當體系τ》τR即發光分子的壽命很長時,溶劑分子的取向弛豫起主要作用,導致能級的變化,出現溶致變色效應。如基態溶質分子在溶液中與溶劑分子相互作用後的能級位置較激發態與溶劑分子作用的能級降得更低時,則可以觀察到光譜的藍移現象。反之,則可使光譜發生紅移。Lippert指出當溶質分子位置處的偶極矩變大,即溶劑和溶質之問的相互作用很強時,能級就降得更低。如果用μg和μe分別表示溶質分子的基態偶極矩和激發態偶極矩,當μe>μg為紅移時,μe<μg則為藍移。當分子激發態的壽命τ和取向弛豫時間τR處於同一數量級時,此時螢光峰的位置應處於τ《τR和τ》τR兩種極限狀況之間。
 發光化合物分子在溶劑中的關係圖
發光化合物分子在溶劑中的關係圖溶劑效應相關
溶劑的分類
溶劑的分類方法很多。有機溶劑一般是根據溶劑能否提供質子而形成氫鍵的性質把溶劑分為質子傳遞溶劑和非質子傳遞溶劑兩大類,另外,還根據介電常數或偶極矩的不同將介電常數大於15~20或偶極矩大於2.5D的溶劑列為極性溶劑,其他為非極性溶劑。
極性溶劑又可分為電子對受體溶劑和電子對給體溶劑兩大類。
電子對受體具有一個缺電子部位或酸性部位。最重要的電子對受體基團是羥基、氨基、羧基或未取代的醯氨基,它們都是氫鍵給體。此類質子傳遞溶劑可以通過氫鍵使電子對給體性的溶質分子或負離子溶劑化。例如,水、醇、酚和羧酸等。
電子對給體具有一個富電子部位或鹼性部位。最重要的電子對給體是水、醇、酚、醚、羧酸和二取代醯胺等化合物中的氧原子以及胺類和雜環化合物中的氮原子。上述氧原子和氮原子都具有未共用電子對,又是氫鍵受體。
原則上,大多數溶劑都是兩性的。例如,水既具有電子對受體性質(形成氫鍵),又具有電子對給體性質(利用氧原子)。但是,許多溶劑只突出一種性質,亦稱專一性溶劑化。例如,N,N一二甲基甲醯胺、二甲基亞碸、環丁碸、N-甲基吡咯烷酮以及乙腈和吡啶等溶劑對無機鹽有一定的溶解度,並能使無機鹽中的正離子M+溶劑化;然而,負離子則不易溶劑化而成為活潑的“裸”負離子。
因此,許多負離子的親核置換反應都是在上述電子對給體溶劑中進行的。
溶劑極性對反應速率的影響
溶劑極性對反應速率的影響常用Houghes—Ingold規則解釋。
Houghes—Ingold用過渡態理論來處理溶劑對反應速率的影響。經常遇到的反應,由起始反應物之間相互作用所生成的過渡態大都是偶極性活化配合物,它們在電荷分布上比相應的起始反應物常常有明顯的差別,並由此總結出以下兩條條規則:
①對於從起始反應物變為活化配合物時電荷密度增加的反應,溶劑極性增加,不利於配合物的形成,使反應速率減慢。
②對於從起始反應物變為活化配合物時電荷密度變化不大的反應,溶劑極性的改變對反應速率影響不大。
上述規則雖然有一定的局限性,但對於許多偶極型過渡態反應,例如親電取代、親核取代、p消除、不飽和體系的親電加成等,還是可以用上述規則預測其溶劑效應,並得到了許多實驗數據的支持。