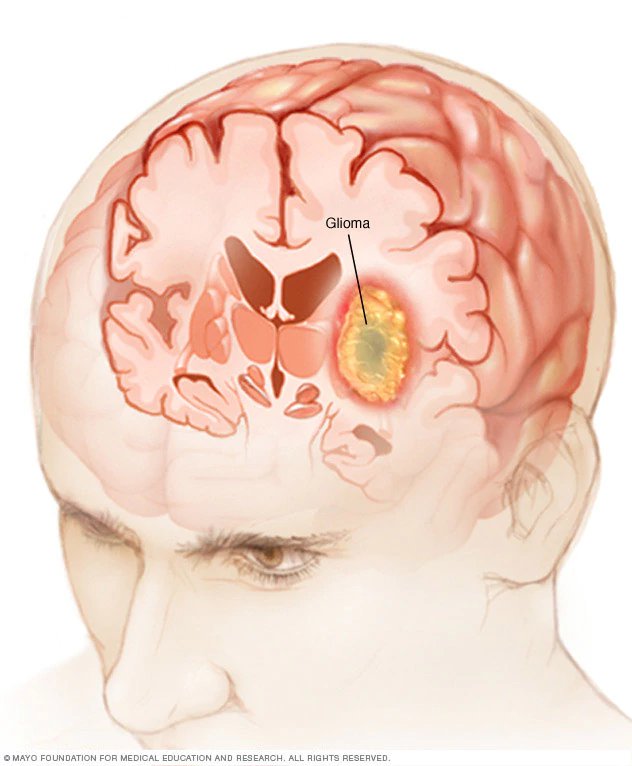
腦膠質瘤系發生於腦最常見的一類腫瘤。依其細胞構成不同又可分為星形母細胞瘤、星形細胞瘤、多形性膠質母細胞瘤、少突膠質細胞瘤、神經母細胞瘤、室管膜母細胞瘤、室管膜細胞瘤等。此類腫瘤生長部位、惡性程度不同。惡性腦膠質瘤是臨床上常見的一類顱腦腫瘤,其發病率在顱腦腫瘤中高達60%。
基本介紹
- 中文名:惡性腦膠質瘤
- 外文名: malignant glioma
- 科室:神經外科
定義,病因及常見疾病,鑑別診斷,檢查,治療原則,分級,WHO一級膠質瘤,WHO二級膠質瘤,WHO三級膠質瘤,WHO四級膠質瘤,分類,星形細胞瘤,髓母細胞瘤,少枝膠質瘤,室管膜瘤,流行病學,症狀,中腦腫瘤,橋腦腫瘤,延髓腫瘤,診斷,腦膠質瘤的特點及治療現狀,膠質瘤手術,膠質瘤放療,膠質瘤化療,化療方案,據MGMT表達不同指導的惡性膠質瘤個體化化療,雜合性缺失與少突膠質瘤治療方案選擇,分子靶向藥物治療,早期惡性膠質瘤能治好嗎,
定義
顱內良性膠質瘤是指生長在顱內某一部位(多在腦神經組織外),細胞分化良好,生長緩慢,多能根治的腫瘤。而顱內惡性膠質瘤則相反(大都生長在腦神經組織內),細胞分化不良,生長迅速,難以根治。有些顱內良性腫瘤,由於位置深在,其周圍有許多重要結構,發現時體積已很大,手術不能全部切除,預後不良。而有些部分的所謂顱內惡性腫瘤,由於生長在不很重要的腦組織中,幾乎能全部切除,手術後也能生存較長時間,甚至能治癒。有極個別的腦瘤,開始為良性,以後轉變成惡性。顱內膠質細胞瘤、轉移瘤及侵入瘤多為惡性。惡性膠質瘤亦稱腦癌,是生長於顱內的惡性腫瘤。
病因及常見疾病
鑑別診斷
臨床表現:主要為顱內壓增高症狀及相應部位的壓迫症狀,如頭痛、嘔吐、視力障礙、感覺障礙、偏癱、語言障礙、共濟失調等。診斷:CT、磁共振攝像有重要診斷意義,病理診斷方可確定其類型與性質。
檢查
根據現如今的WHO分型標準,膠質瘤被分為四種組織學等級。
膠質瘤Ⅰ級,例如毛細胞型星形細胞瘤是生長非常緩慢的腫瘤,若此型腫瘤得到完全切除,患者則有治癒的可能。
膠質瘤Ⅱ級(常見的有少突星形細胞瘤、星形細胞瘤等)。
侵襲性的Ⅲ級膠質瘤(間變性星形細胞瘤、間變性少突膠質細胞瘤等)處於中間臨床病變過程。
Ⅳ級膠質瘤(惡性膠質瘤)則具有高度的侵襲性(中位生存期為14.5~16.6個月)。
治療原則
手術切除為本,有些易復發。腦膠質瘤主要以浸潤性方式生長,擴散速度快,因此加重臨床治療困難,手術治療的關鍵是切除腫瘤的同時延長患者生存期,但手術難以將其全部切除,復發性極高,因此,惡性腦質瘤術後聯合化療是極為重要的。
分級
世界衛生組織將膠質瘤分為4級,惡性度從低度到高度。
1級為良性,2級為低度惡性,3級4級為高度惡性。
WHO一級膠質瘤
(毛細胞性星形細胞瘤):手術是可以治癒性的。如果在術後影像上有殘餘腫瘤,則可行第二次手術切除整個腫瘤。放療和化療對此類腫瘤極其有限。
WHO二級膠質瘤
(低度惡性膠質瘤):手術是非功能區腫瘤的最主要的治療手段。對於40歲以下的肉眼全切的病人,無需額外的其他治療。對於40以下的不全切除的腫瘤病人以及病人年齡大約40歲不管是否全切都應該進行放療。
WHO三級膠質瘤
WHO四級膠質瘤
(多形性膠質母細胞瘤):同樣需要手術來達到組織病理診斷和減小腫瘤體積。術後放療(劑量在60Gy左右)。化療手段包括卡莫司汀,聯合方案PCV(甲基苄肼,環己亞硝脲和長春新鹼),或者替莫唑胺用來對腫瘤生長進行控制。
分類
星形細胞瘤
為膠質瘤中最常見的一種,約占40%左右。病理分型為Ⅰ級(星形細胞瘤),Ⅱ級 (星形母細胞瘤),Ⅲ~Ⅳ級(多形膠母細胞瘤)。Ⅰ~Ⅱ級星形細胞瘤為低度惡性,起病緩慢,腫瘤在CT及MR的表現多為實性或囊性,邊界不清,腫瘤實性部分或囊性結節均可強化。臨床表現與病灶部位不同進行性地出現相應的症狀,並最後出現顱高壓的症狀。Ⅲ~Ⅳ級的多形膠母細胞瘤起病快速,為惡性度最高的腫瘤,多生長於大腦半球,因腫瘤生長迅速,腫瘤中心可有多處壞死及出血,CT及MR均明顯強化。周圍可伴大片腦組織的水腫。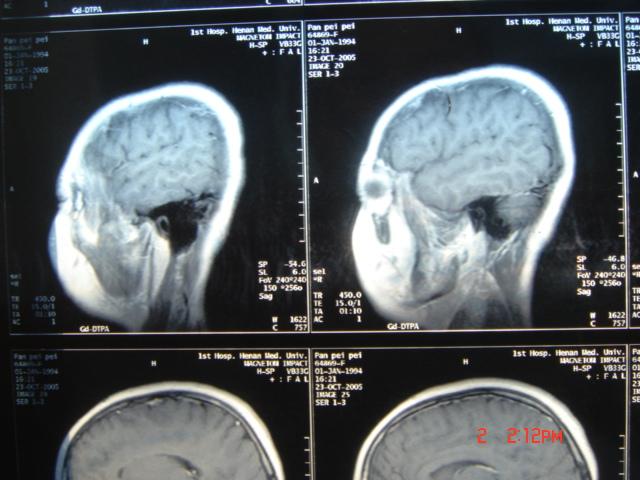 惡性腦膠質瘤CT影像表現
惡性腦膠質瘤CT影像表現
 惡性腦膠質瘤CT影像表現
惡性腦膠質瘤CT影像表現髓母細胞瘤
為高度惡性腫瘤,好發於2-10歲的兒童,最少者可見於幾月余小兒,大多數來源於小腦蚓部向四腦室及延髓小腦半球生長,以額、頂、顳葉區為多見。病人主要表現為神經功能障礙。常無法徹底手術切除,且復發迅速。因阻塞腦脊液循環通道,發現時多已伴有腦積水,CT及MR可發現後顱窩占位,因CT對此部位顯示 不清,故推薦MR檢查。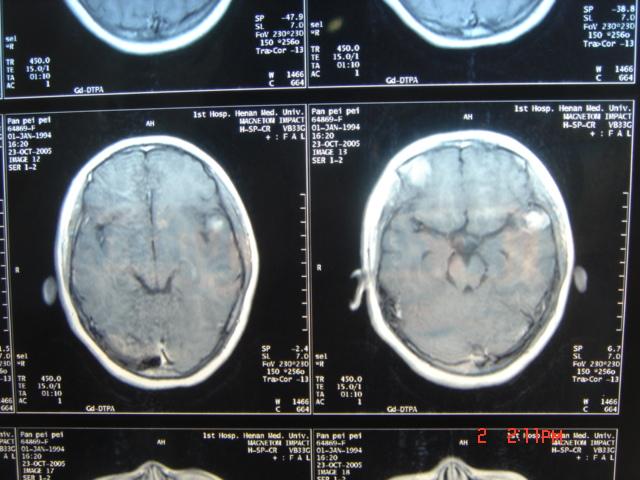 惡性腦膠質瘤CT影像表現
惡性腦膠質瘤CT影像表現
 惡性腦膠質瘤CT影像表現
惡性腦膠質瘤CT影像表現少枝膠質瘤
為低度惡性腫瘤,偏良性,不少人亦稱其為良性腫瘤。生長慢,瘤內常可見鈣化斑塊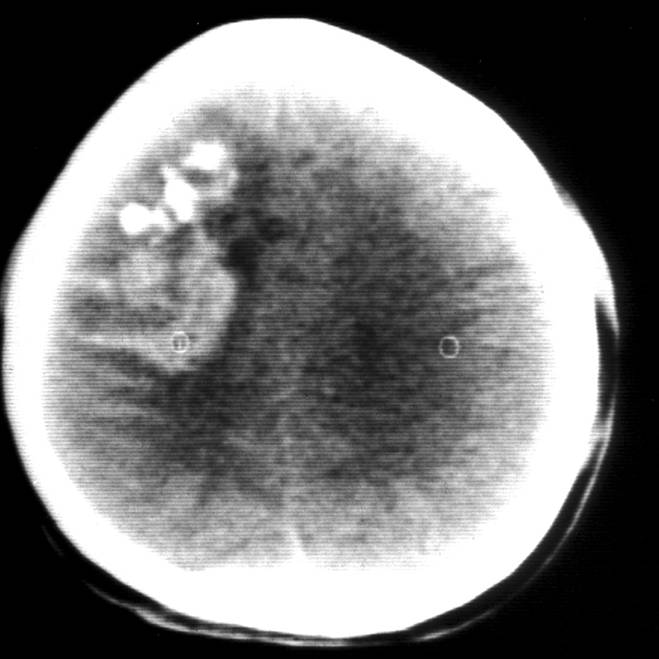 少枝膠質瘤
少枝膠質瘤
 少枝膠質瘤
少枝膠質瘤室管膜瘤
腦膠質瘤大多緩慢發病,自出現症狀至就診時間一般為數周至數月,少數可達數年。惡性程度高的和後顱窩腫瘤病史較短,較良性的或位於靜區的腫瘤病史較長。腫瘤若有出血或囊變,症狀會突然加重,甚至有類似腦血管病的發病過程。膠質瘤的臨床症狀可分兩方面,一是顱內壓增高症狀,如頭痛、嘔吐、視力減退、復視、精神症狀等;另一是腫瘤壓迫、浸潤、破壞腦組織所產生的局灶症狀,早期可表現為刺激症狀如局限性癲癇,後期表現為神經功能缺失症狀如癱瘓。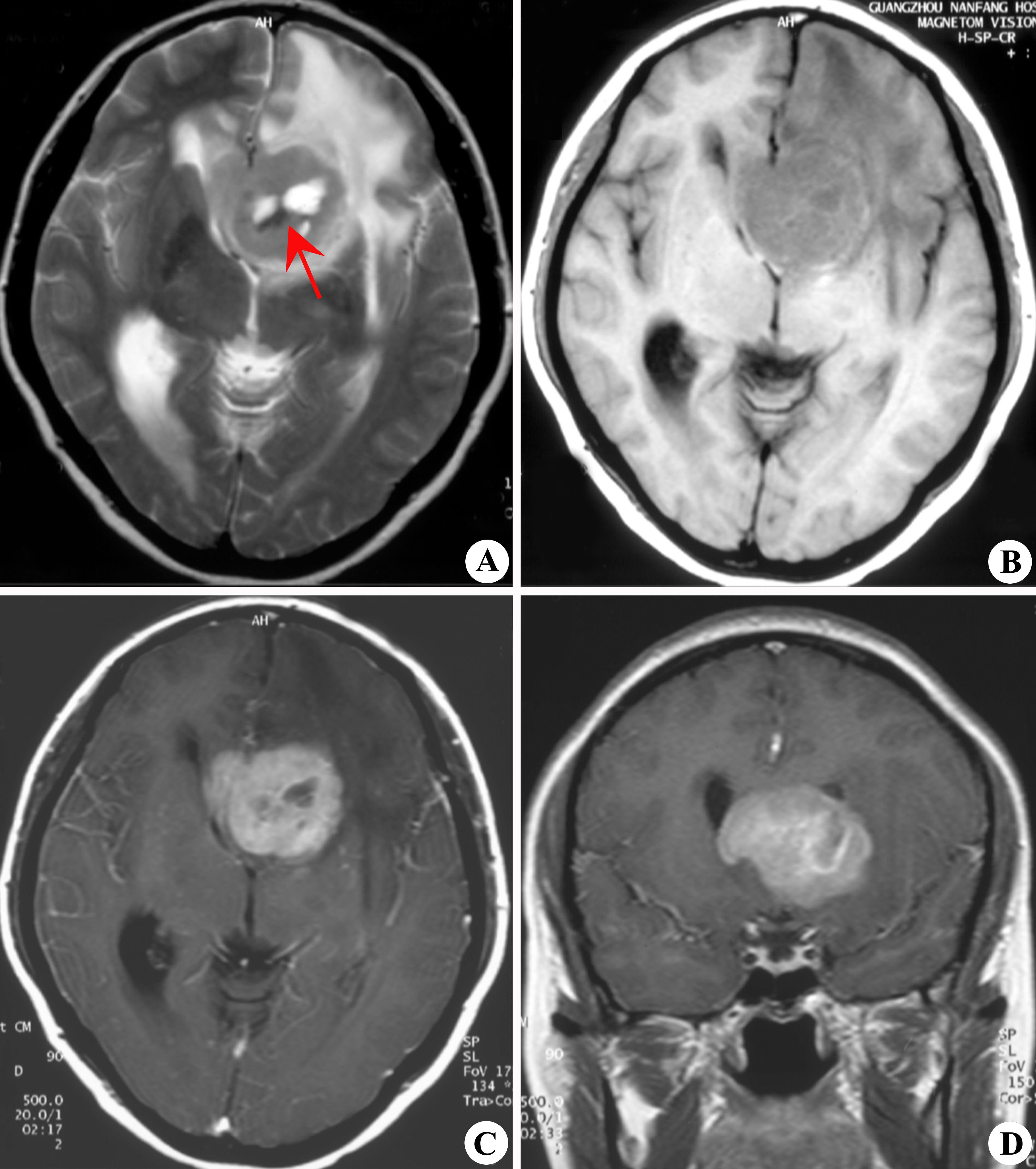 左額葉深部室管膜瘤
左額葉深部室管膜瘤
 左額葉深部室管膜瘤
左額葉深部室管膜瘤胚胎性腫瘤中樞神經系統 (CNS)包括惡性生殖細胞瘤、成神經管細胞瘤、原始神經外胚層腫瘤 (PNET)等 ,好發於兒童青少年
流行病學
腦幹腫瘤(腦幹膠質瘤)占顱內腫瘤的1.4%。主要為神經膠質瘤,其中以星形細胞瘤和極性成膠質細胞瘤較為多見,其次是少枝膠質細胞瘤、室管膜膠質瘤、髓母細胞瘤,此外還可見到血管瘤(包括血管網織細胞瘤)、囊腫、畸胎瘤、結核瘤、轉移性腫瘤等。兒童及青少年好發,特別是5~9歲兒童發病率最高。兒童病人常以分化較差的極性成膠質細胞瘤、髓母細胞瘤和室管膜瘤為多,成年病人則以星形細胞瘤為多。兒童患者病程短、進展快;常在較短時間(數周至數月)內即引起嚴重的腦幹症狀;成年患者病程長、進展慢,可數月甚至1年以上始出現嚴重的腦幹症狀。各種腫瘤在腦幹中分布的部位略有不同,星形細胞瘤可分布於腦幹的各部位,髓母細胞瘤和室管膜瘤則分布於導水管的被蓋部位和第四腦室底。
症狀
腦幹腫瘤(腦幹膠質瘤)症狀:
中腦腫瘤
由於腫瘤極易阻塞導水管,故早期可出現顱內壓增高症狀。也有首發症狀為精神和智力改變,這可能與網狀結構受累有關。根據腫瘤侵襲部位不同,常表現有:①動眼神經交叉性偏癱綜合症——Weber綜合症,病變位於大腦腳底部,出現病側動眼神經麻痹,對側上、下肢體和面、舌肌中樞性癱瘓。②四疊體綜合症——Parrnaud綜合症,表現眼瞼下垂、上視麻痹、瞳孔固定、對光反應消失、會聚不能等。③Benedikt綜合症,表現為耳聾等、病側動眼神經麻痹、對側肢體肌張力增強、震顫等。
橋腦腫瘤
占全部腦幹腫瘤半數以上,多見於兒童。早期兒童常以復視、易跌跤為首發症狀;成年人則常以眩暈、共濟失調為首發症狀。90%以上病人有顱神經麻痹症狀,約40%病人以外展神經麻痹為首發症狀,隨著腫瘤發展出現面神經、三叉神經等顱神經損害和肢體的運動感覺障礙。常表現有Millard-Gubler綜合症——橋腦半側損害,包括面神經交叉癱,若病變位於橋腦下半部偏一側時致病側周圍性面癱伴對側肢體偏癱。
延髓腫瘤
首發症狀常為嘔吐,易被誤診為神經性嘔吐或神經官能症,特別是成年患者。病人可有不同程度頭昏、頭痛,然後較早出現後組顱神經麻痹的症狀,如吞咽困難、進食嗆咳、講話鼻音、伸舌不能等。腫瘤累及雙側時則出於真性延髓麻痹症群,同時伴有雙側肢體運動、感覺障礙及程度不等的痙攣性截癱,病程早期可有呼吸不規則,晚期可出現呼吸困難或衰竭。
臨床上常表現的延髓半側損害有:①舌下神經交叉癱(Jackson綜合症);②吞咽、迷走交叉癱(Avellis綜合症);③Schmidt綜合症——病側Ⅸ~Ⅶ顱神經麻痹及對側半身偏癱;④延髓背外側綜合症(Wallenberg綜合症)等。
診斷
膠質瘤的診斷,根據其生物學特徵、年齡、性別、好發部位及臨床過程進行分析,在病史及體徵基礎上,採用電生理、超音波、放射性核素、放射學及核磁共振等輔助檢查,定位正確率幾乎是100%,定性診斷正確率可在90%以上。
腦膠質瘤由於腫瘤呈浸潤性生長,與腦組織無明確分界,難以徹底切除,手術治療的原則是在保存神經功能的前提下儘可能切除腫瘤。早期腫瘤較小又位於適當部位者可爭取全部切除。位於額葉的腫瘤,可作腦葉切除。當額葉或顳葉腫瘤範圍較廣不能全部切除時,可同時切除額極或顳極作內減壓術。腫瘤位於運動、言語區而無明顯偏癱、失語者,宜注意保存神經功能,適當切除腫瘤,避免發生嚴重後遺症。腦室腫瘤宜從非功能區切開腦組織進入腦室,儘可能切除腫瘤,解除腦梗阻。位於丘腦、腦幹的膠質瘤,除小的結節性或囊性者可作切除外,一般作分流術,緩解增高的顱內壓後,進行中醫藥綜合治療。
腦膠質瘤的特點及治療現狀
國內外對於膠質瘤的治療普遍為手術、中醫藥、放療、化療、X刀、和γ刀。
膠質瘤手術
1、2級一般的復發1-2年。
膠質瘤放療
放射治療幾乎是各型膠質瘤的常規治療,但療效評價不一,除髓母細胞瘤對放療高度敏感,室管膜瘤中度敏感外,其他類型對放療均不敏感,有觀察認為放療與非放療者預後相同。此外射線引起的放射性壞死對於腦功能的影響亦不可低估。X-刀、γ-刀—均屬放射治療範疇,因腫瘤的部位、瘤體大小(一般限於3厘米以下)及瘤體對射線的敏感程度,治療範疇局限,認為膠質瘤,特別是性質惡性的星形Ⅲ-Ⅳ級或膠質母細胞瘤均不適合採用R-刀治療。
膠質瘤化療
化療方案
惡性膠質瘤並不是一個均一的群體,同種病理類型不同病人對同一化療方案的療效不一樣,膠質瘤中某些遺傳特徵的改變與其對化療的敏感性密切相關。如何識別出化療有效人群,對提高化療療效,避免盲目/無效化療具有重要意義。比較肯定與臨床療效相關的分子有:O6-甲基鳥嘌呤-DNA甲基轉移酶(O6-methylguanine-DNA methyltransferase , MGMT)和染色體1p/19q雜合性缺失(loss of heterozygosity, LOH)。在化療前先檢測腫瘤組織中MGMT和染色體1p/19q的表達,據檢測結果選擇化療方案有望提高化療的有效性。
據MGMT表達不同指導的惡性膠質瘤個體化化療
(1) MGMT強陽性(++)和陽性(+)表達患者化療方案
這類患者由於存在由MGMT介導的耐藥因素,不宜用亞硝脲類藥物單藥或TMZ五天方案化療。可選用不含亞硝脲和TMZ的化療方案,如VM26+DDP;亞硝脲類藥物或TMZ聯合其他藥物化療,DDP在亞硝脲類藥物或TMZ給藥前24小時給予可降低MGMT轉錄;由於TMZ有自身耗竭MGMT的作用,可選用TMZ較長時間持續用藥方案。
(2) MGMT可疑陽性(±)和陰性(-)表達患者化療方案:
這類患者選擇化療藥物的範圍相對比較廣,可結合年齡、卡氏評分、病理級別、腫瘤組織中其他分子指標如PCNA、PTEN、TOPOII、GST等的表達,選用亞硝脲類或替莫唑胺單藥或與其他藥物聯合用藥方案,也可選用不含亞硝脲類或替莫唑胺方案。
雜合性缺失與少突膠質瘤治療方案選擇
染色體1p/19q雜合性缺失的少突膠質瘤患者對化療敏感,預後好,生存期長,手術後先行PCV方案或TMZ組成的方案化療,放療可推遲,作為復發時的挽救治療。單1p LOH的少突膠質瘤患者也對化療敏感,但化療療效持續時間及生存期相對短,需放化療結合治療,手術後可先行化療,化療結束後儘快行放療。1p/19q均無LOH,尤其伴有PTEN突變、10q LOH、EGFR擴增、CDKN2A 缺失和環狀強化的患者預後非常差,建議6周同期放化療,然後序貫周期化療。
分子靶向藥物治療
由於信號傳導通路的複雜性以及不同通路之間的互動作用,單一靶向藥物治療惡性膠質瘤作用有限。針對多個靶點的藥物,或有互補作用的不同靶向藥物的聯合,靶向藥物和細胞毒類藥物如替莫唑胺,以及放療的聯合治療將是提高療效的關鍵。
早期惡性膠質瘤能治好嗎
就治療現狀而言,惡性腦瘤仍是醫學上未被攻克的一大難題,但是這也並不等於得了惡性膠質瘤就被宣判了死刑,臨床上亦有不少治療後長期生存的病例。 早期惡性膠質瘤能治好嗎?主要取決於是否及時採取了恰當的治療手段。早期惡性腦瘤癌腫較小,若部位合適,應行手術切除。若癌腫部位切除難度大,可先行放療,待癌腫變小後,再行手術切除。另外,西醫各治療手段均會對人體正常細胞造成不同程度的損傷,臨床上多主張聯合中醫藥治療,以起到增效減毒的作用。