簡介
tubulin組成
微管的蛋白質稱為微管蛋白。微管蛋白是球形分子,有兩種類型:α微管蛋白(α-tubulin)和β微管蛋白(β-tubulin)。這兩種亞基有35~40%的胺基酸序列同源,表明編碼它們的
基因可能是由同一原始祖先演變而來。另外,這兩種微管蛋白與細菌中一種叫作FtsZ的GTPase(分子量為40kDa)同源,這種酶具有和微管蛋白相似的功能,能夠
聚合並且參與
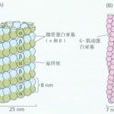
細胞分裂。α和β微管蛋白的亞基都是直徑為4nm的球形分子,它們組成的
異源二聚體的長度為8nm。α和β
微管蛋白各有一個GTP結合位點, 位於α
亞基上的GTP結合位點,是不可逆的結合位點,結合上去的GTP不能被
水解,也不能被GDP替換。位於β亞基上的GTP結合位點結合GTP後能夠被水解成GDP,所以這個位點又稱為可交換的位點(exchangeable site,
E位點)。還有一種微管蛋白,即
γ微管蛋白,不是微管的組成成分,但是參與微管的組裝。長期以來,Tubulin一直被認為是
真核生物特異性的。然而,最近,已顯示幾種
原核蛋白與微管蛋白有關。
結構
系一種
球蛋白,是細胞內
微管的基本結構單位。它是由兩個蛋白質分子,即α-、β-微管蛋白分子
聚合而成的異二聚體;每個這樣的二聚體又與兩個
核苷酸分子相結合,一個屬緊密結合,另一個為疏鬆結合,而且可以快速交換。分子量12萬,
沉降係數6s。微管蛋白有兩個尺寸相等而結構不同的
亞基(α和β)。其亞基分子量為5.5萬。微管蛋白具有專一性地與某些抗有絲分裂藥劑,如
秋水仙鹼(colchicine)、
長春花鹼和
鬼臼素等相結合。一旦與秋水仙鹼相結合後就阻止了α-、β-微管蛋白(
亞單位)聚合成微管蛋白質,從而完全失去形成微管的功能。微管蛋白對於保持細胞形狀、運動、胞內物質運輸起到了不可或缺的作用。
功能
α-和β-微管蛋白聚合成動態
微管,這些亞基是微酸性的,
等電點在5.2和5.8之間。在真核生物中,微管是
細胞骨架的主要成分之一,並且在許多過程中起作用,包括結構支持,細胞內轉運和DNA分離。
為了形成微管,α-和β-微管蛋白的二聚體與
GTP結合併在GTP結合狀態下組裝到微管的(+)末端。β-微管蛋白亞基暴露在微管的正端,而α-微管蛋白亞基暴露在負端。在將二聚體摻入微管後,與β-微管蛋白亞基結合的GTP分子最終通過沿著微管原絲的二聚體間接觸
水解成GDP。微管蛋白二聚體的β-微管蛋白成員是否與GTP或GDP結合會影響微管中二聚體的穩定性。與GTP結合的二聚體傾向於組裝成微管,而與GDP結合的二聚體傾向於分裂;因此,這種GTP循環對於微管的
動態不穩定性是必不可少的。
當結合到微管中時,微管蛋白積累了許多
翻譯後修飾,其中許多是這些蛋白質所特有的。這些修改包括detyrosination,
乙醯化,polyglutamylation,polyglycylation,
磷酸化,
泛素化,SUMO化,和棕櫚醯化。對一些微管中的乙醯化進行了許多科學研究,特別是α-微管蛋白N-乙醯轉移酶(ATAT1),它被證明在許多生物和分子功能中發揮重要作用,它與許多人類疾病相關,特別是神經系統疾病。
細菌微管
在
Prosthecobacter屬細菌中鑑定了α-和β-微管蛋白的同系物。它們被命名為BtubA和BtubB,以將它們鑑定為細菌微管蛋白。兩者都表現出與α-和β-微管蛋白的
同源性。雖然結構上與真核生物微管蛋白高度相似,但它們具有幾個獨特的特徵,包括
伴侶免疫摺疊和弱二聚化。電子低溫顯微鏡表明BtubA / B形式的微管
體內,並表明這些微管包括只有五個原絲,而相比之下,真核微管,其通常含有13隨後體外研究表明,BtubA / B形成四鏈“微型微管”。
類型
真核生物
微管蛋白超家族含有六個微管蛋白(α-,β-,γ-,δ-,ε-和ζ-微管蛋白)。
α-微管蛋白
人α-微管蛋白亞型包括:
· TUBA1A
· TUBA1B
· TUBA1C
· TUBA3C
· TUBA3D
· TUBA3E
· TUBA4A
· TUBA8
β-微管蛋白
已知與人微管蛋白結合的所有藥物都與β-微管蛋白結合。這些包括
紫杉醇,
秋水仙鹼和
長春花生物鹼,它們各自在β-微管蛋白上具有不同的結合位點。
III類β微管蛋白是微管元件中只表示
神經元,並且是特定於神經組織神經元流行標識符。它比其他
同種型的β-微管蛋白更慢地結合秋水仙鹼。
β1-微管蛋白,有時稱為VI類β-微管蛋白,在胺基酸序列水平上最不同。它僅在人類的巨核細胞和血小板中表達,並且似乎在血小板的形成中起重要作用。當VI類β-微管蛋白在哺乳動物細胞中表達時,它們會導致微管網路的破壞,微管碎片的形成,並最終導致巨核細胞和血小板中存在邊緣帶狀結構。
Katanin是一種蛋白質複合物,可在β-微管蛋白亞基上切斷微管,是神經元和高等植物中快速微管運輸所必需的。
人β-微管蛋白亞型包括:
· TUBB
· TUBB1
· TUBB2A
· TUBB2B
· TUBB2C
· TUBB3
· TUBB4
· TUBB4Q
· TUBB6
γ-微管蛋白
γ-微管蛋白,微管蛋白家族的另一成員,在微管的
成核和極性取向中是重要的。它主要存在於
中心體和紡錘極體中,因為它們是最豐富的微管成核區域。在這些細胞器中,在稱為γ-微管蛋白環複合物(γ-TuRCs)的複合物中發現了幾種γ-微管蛋白和其他蛋白質分子,其在化學上模擬微管的(+)末端,從而允許微管結合。γ-微管蛋白也被分離為
二聚體並且作為γ-微管蛋白小複合物(γTuSC)的一部分,在二聚體和γTuRC之間的中間尺寸。γ-微管蛋白是微管成核的最佳理解機制,但某些研究表明,某些細胞可能能夠適應其缺失,正如已經抑制其正確表達的
突變和
RNAi研究所表明的那樣。
人γ-微管蛋白亞型包括:
· TUBG1
· TUBG2
γ-微管蛋白環複合物的成員:
· TUBGCP2
· TUBGCP3
· TUBGCP4
· TUBGCP5
· TUBGCP6
δ和ε-微管蛋白
已經發現Delta(δ)和epsilon(ε)微管蛋白定位於
中心粒並且可能在
中心粒結構和功能中起作用,儘管它們都沒有像α-和β-形式那樣被充分研究。
人δ-和ε-微管蛋白基因包括:
· δ微管蛋白
· TUBD1
· ε微管蛋白
· TUBE1
ζ-微管蛋白
Zeta-微管蛋白存在於許多真核生物中,但是其他人缺失,包括胎盤哺乳動物。已經顯示它與多中心上皮細胞中的中心粒的基底足結構相關。
原核生物
BtubA / B
BtubA / B存在於Verrucomicrobial屬Prosthecobacter的一些細菌物種中。它們與真核微管蛋白的進化關係尚不清楚,儘管它們可能是通過側向基因轉移從真核細胞譜系中產生的。
FtsZ
幾乎所有細菌和古細菌都使用FtsZ進行分裂。這是第一個鑑定出的原核
細胞骨架蛋白。
TubZ
CetZ
經開區在發現euryarchaeal的進化枝
Methanomicrobia和
嗜鹽菌,在那裡它有細胞形狀分化功能。