2022年9月30日,抗腫瘤藥物睿妥®(塞普替尼,Selpercatinib)獲國家藥監局批准上市。是全球首個獲批的高選擇性RET抑制劑,可抑制多種RET變異。用於治療RET融合陽性的轉移性非小細胞肺癌的成年患者、需要系統性治療的攜帶RET突變的晚期或轉移性甲狀腺髓樣癌成人和12歲及以上的兒童患者以及需要系統性治療和放射性碘治療(如適用)難治的RET融合陽性的晚期或轉移性甲狀腺癌成人和12歲及以上的兒童患者。它由禮來製藥研發,信達生物負責中國商業化。
基本介紹
- 藥品名稱:睿妥
- 外文名:Retsevmo
- 別名:塞普替尼膠囊
- 劑型:膠囊劑
- 是否納入醫保:否
- 藥品類型:化學藥品
- 規格:80mg
- 生產商:Lilly del Caribe, Inc.
發展歷程,成份,化學名稱,化學結構式,性狀,適應症,規格,用法用量,推薦劑量,兒童用藥,老年用藥,禁忌,
發展歷程
睿妥®(塞普替尼)於2020年5月獲得美國FDA批准,成為全球首個獲批的高選擇性RET抑制劑。
2021年11月,國家藥監局受理塞普替尼在國內的上市申請,並納入優先審評審批程式。
2022年10月10日,信達生物發布公告,抗腫瘤藥物塞普替尼獲國家藥監局批准上市。
成份
本品主要成份為塞普替尼。
化學名稱
6-(2-羥基-2-甲基丙氧基)-4-(6-(6-((6-甲氧基吡啶-3-基)甲基)-3,6-二氮雜雙環[3.1.1]庚基-3-基)吡啶-3-基)吡唑[1,5-a]吡啶-3-腈
化學結構式
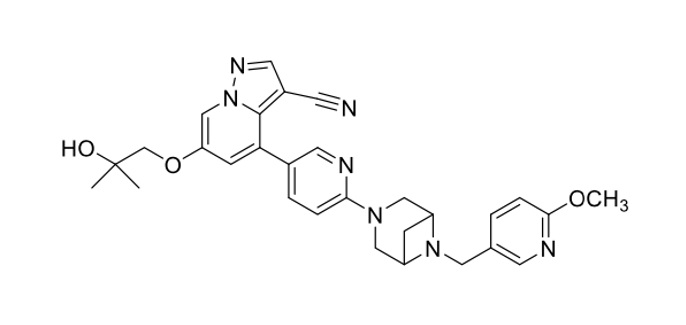
分子式:C29H31N7O3
分子量:525.61
性狀
本品為藍色不透明膠囊,表面有“Lilly”、“2980”和“80 mg”的黑色油墨印字,內容物為白色或類白色至淡黃色粉末(80mg規格)。
適應症
1.本品用於轉染重排(RET)基因融合陽性的局部晚期或轉移性非小細胞肺癌(NSCLC)成人患者的治療。
2.本品適用於需要系統性治療的晚期或轉移性RET突變型甲狀腺髓樣癌(MTC)成人和12歲及以上兒童患者的治療,以及需要系統性治療且放射性碘難治(如果放射性碘適用)的晚期或轉移性RET融合陽性甲狀腺癌成人和12歲及以上兒童患者的治療。
規格
(1)80 mg
用法用量
本品應由在抗腫瘤治療方面富有經驗的醫生處方使用。
推薦劑量
基於體重,本品的推薦劑量為:
· 低於50 kg:120 mg
· 50 kg或以上:160 mg
本品口服給藥,每日2次(大約間隔12小時),直至發生疾病進展或不可耐受的毒性。
整顆吞服膠囊。請勿壓碎或咀嚼膠囊。
如有漏服本品,且距下一次計畫服藥時間大於6小時,應補服錯過的劑量。
如果在服用本品後出現嘔吐,請勿補服額外的劑量,請按計畫繼續服用下個劑量。
特殊人群用藥
肝功能不全
重度肝功能不全時的劑量調整
對於重度肝功能不全患者,根據表4的建議降低推薦劑量
表4:重度肝功能不全患者的推薦劑量
當前劑量 | 推薦劑量 |
120 mg,每日2次 | 80 mg,每日2次 |
160 mg,每日2次 | 80 mg,每日2次 |
輕度和中度肝功能不全
輕度(總膽紅素≤ULN,且AST大於ULN,或總膽紅素大於1至1.5倍ULN且伴任何AST)或中度(總膽紅素大於1.5至3倍ULN伴任何AST)肝功能不全患者使用本品不建議調整劑量。應監測肝功能不全的患者服用本品時相關的不良反應。
腎功能不全
輕度至重度腎功能不全(根據腎臟病飲食改良 [MDRD] 公式估計的腎小球濾過率 [eGFR] ≥ 15至89 mL/min)患者使用本品不建議調整劑量。尚未確定終末期腎病(ESRD)患者中的推薦劑量。
兒童用藥
已在患有需要系統性治療的甲狀腺髓樣癌(MTC)以及需要系統性治療和放射性碘治療(如適用)難治的晚期RET融合陽性甲狀腺癌的12歲及以上的兒童患者中確定了本品的安全性和有效性。在成人中進行的充分且良好的對照研究以及在12歲及以上的兒童患者中獲得的其他藥代動力學和安全性數據支持將本品用於這些適應症。尚未確定在12歲以下的兒童中本品用於這些適應症的安全性和有效性。
尚未確定本品在兒童患者其他適應症的安全性和有效性。
應對生長板開放的青少年患者的生長板進行監測。根據生長板異常的嚴重程度和個體風險獲益評估,考慮暫停或終止治療。
老年用藥
在702名接受本品治療的患者中,34%(239名患者)≥ 65歲,10%(67名患者)≥ 75歲。在≥ 65歲的患者中,未觀察到本品在安全性或有效性上存在總體差異。
禁忌
禁用於對活性成分或任何輔料過敏者。