專利背景
戊二胺是一種可用於生產多種化學品的平台化合物。自20世紀80年代以來,用生物法生產戊二胺的研究領域獲得了廣泛關注。在生物法中,戊二胺可以通過賴氨酸脫羧生成。截至2012年5月,用生物法生產戊二胺主要採用以下兩種方法:微生物發酵生產或生物體外酶催化生產。
在發酵生產賴氨酸的方法中,將賴氨酸脫羧酶基因加到賴氨酸生產菌株(如谷氨酸棒桿菌和大腸桿菌)中,將生物合成賴氨酸的途徑進一步延伸為合成戊二胺的途徑。然而,已報告的戊二胺產率低於使用相同的不含賴氨酸脫羧酶基因的菌種生產賴氨酸的產率。產率低可能是由於戊二胺對生產菌株的毒性抑制作用。
此外,可以對細菌進行改造或利用誘導來表達賴氨酸脫羧酶,用於催化生物體外的賴氨酸脫羧反應。一種方法是在未經改造的蜂房哈夫尼菌(Hafniaalvei,H.alvei)菌株中對染色體編碼的賴氨酸脫羧酶基因進行誘導表達。然而,此種方法所報導的酶產量低。另一種方法涉及重組細菌的構建。例如,日本一些公司(JP2009028045,US7189543,CN102056889)相繼報導能夠過量表達賴氨酸脫羧酶的大腸桿菌重組菌的構建,並利用全細胞或者細胞裂解液催化賴氨酸脫羧得到戊二胺。然而,大量表達對宿主細胞有毒的蛋白質使得表達質粒在幾次傳代後不穩定。必須在發酵液中使用抗生素以確保在培養過程中重組質粒的穩定。
抗生素的使用可能導致對抗生素有抗藥性的細菌的發展,也會在環境中保持高水平的抗藥性微生物。由於對抗生素有抗藥性的細菌對健康和生態環境的危害,抗生素的使用是不環保的。因此,我們需要一個更有效的重組質粒載體,能夠在沒有抗生素篩選的條件下,多次連續傳代仍然保持穩定。
發明內容
詳細說明
下面描述中的具體細節僅僅是為了能夠充分理解《在蜂房哈夫尼菌中穩定的重組表達質粒載體及其套用》的實施例。但是作為該領域的技術人員應該知道《在蜂房哈夫尼菌中穩定的重組表達質粒載體及其套用》的實施並不限於這些細節。另外,公知的結構和功能沒有被詳細的描述或者展示,以避免模糊了《在蜂房哈夫尼菌中穩定的重組表達質粒載體及其套用》實施例的要點。
在《在蜂房哈夫尼菌中穩定的重組表達質粒載體及其套用》中所使用的胺基酸,多肽,鹼基序列,核酸的縮寫,是基於國際理論和套用化學聯合會及國際生物聯合會對生物化學命名的規定,發表在Europea nJournal of Biochemistry1984年第138卷第9期的“準備含鹼基序列和胺基酸序列的說明書的指導”(美國專利和商標局)一文中的縮寫,以及在生物技術領域中通用的縮寫。
在《在蜂房哈夫尼菌中穩定的重組表達質粒載體及其套用》中所討論的“核苷酸序列”,“聚核苷酸”或“DNA分子”,可能包括雙鏈DNA(即,由正義鏈和反義鏈組成的雙鏈DNA)或單鏈DNA,及其片段。在此“其片段”是指該核苷酸序列的一部分,其編碼的多肽與該核苷酸序列的完整序列所編碼的多肽的功能基本相同。例如,一種編碼抗毒素基因的核苷酸表達可以中和毒素多肽的多肽。編碼抗毒素基因的核苷酸的一個片段所表達的多肽也能中和該毒素多肽,因此與編碼抗毒素基因的核苷酸的全序列所表達的多肽相比提供了大致相同的功能。同樣,編碼毒素基因的核苷酸的一個片段所表達的多肽與編碼毒素基因的核苷酸的全序列所表達的多肽對與細胞有基本相同的毒性。
這裡提到的核苷酸序列,聚核苷酸或DNA分子不僅限於功能區,可能包括至少一個表達調控區,編碼區,前導序列,外顯子,內含子和表達盒。此外,核苷酸序列或聚核苷酸的例子可能指RNA或DNA。具有特定的胺基酸序列的多肽和具有特定的DNA序列的聚核苷酸可能包括該序列的片段、同源序列、衍生序列和突變序列。核苷酸序列或聚核苷酸的突變體(如突變DNA)的例子,包括自然發生的突變、人工突變,和/或刪除,替換,添加和/或插入等突變。這種突變體所編碼的多肽應該理解為與未突變的原核苷酸序列編碼的多肽實質上具有相同的功能。
《在蜂房哈夫尼菌中穩定的重組表達質粒載體及其套用》所公開的內容包括一個穩定的重組表達質粒載體,包括以下部分:
一段編碼抗毒素基因的聚核苷酸,其表達一種多肽,來中和一種對宿主細胞有毒的多肽,與之對應的有毒的多肽由一段編碼毒素基因的聚核苷酸在宿主細胞中表達,
一段編碼多肽表達產物的聚核苷酸,其中,
該穩定的重組表達質粒載體由在宿主細胞中可複製骨架質粒衍生而成。
在一些實施例中,該毒素基因在宿主細胞的染色體基因組中編碼。
在一些實施例中,該穩定的重組表達質粒載體進一步包括編碼毒素基因的聚核苷酸。
在一些實施例中,該編碼毒素基因的聚核苷酸和/或編碼抗毒素基因的聚核苷酸是重組的。
在一些實施例中,毒素基因,抗毒素基因和編碼多肽表達產物的聚核苷酸中的一個或多個基因被進一步用密碼子最佳化技術進行最佳化,以在宿主細胞中對相應多肽提供更好的表達。例如,最佳化毒素基因可以包括DNA序列的最佳化,以與序列SEQIDNO:1或SEQID:3相比更好地表達多肽毒素。在某些實施例中,抗毒素基因包括進一步最佳化的DNA序列,以與序列SEQIDNO:2或SEQID:4相比更好地表達抗毒素多肽。在某些實施例中,多肽表達產物的基因包括進一步最佳化的DNA序列,以與序列SEQIDNO:5或SEQID:6相比更好地表達多肽表達產物。
密碼子最佳化是一種技術,其通過增加感興趣的基因在宿主細胞內的翻譯效率來得到最大限度的蛋白表達。一個物種的DNA核苷酸序列被最佳化成為另一個物種的DNA核苷酸序列。DNA序列被分成三個一組(密碼子)。一種胺基酸的低頻率密碼子被宿主細胞中相同胺基酸的高頻率密碼子所取代。由此,最佳化的DNA序列在宿主細胞中的表達得到改善。
這裡使用的毒素/抗毒素基因對有兩個基因,其中一個是毒素基因,表達對宿主細胞有毒性的多肽,另一個是抗毒素基因,表達的多肽能夠中和該毒素多肽對宿主細胞的毒性。
某些原核生物含有一個或多個染色體編碼的毒素基因。某些原核生物含有編碼特定毒素/抗毒素基因對的內源性質粒。毒素/抗毒素基因對通常在維持遺傳信息的穩定和應激反應中發揮作用。當細胞中有染色體或質粒編碼的抗毒素基因時,抗毒素蛋白能夠持續表達,中和毒素蛋白,維持細胞的存活。在某些原核生物中,抗毒素蛋白的降解速度比毒素蛋白快。如果帶有抗毒素基因的質粒從細胞內丟失,已合成的毒素蛋白遺留的時間會比抗毒素蛋白長,能夠殺死細胞或抑制細胞生長。因此,在保持細胞存活的前提下,帶有抗毒素基因或毒素/抗毒素基因對的質粒不易丟失。
毒素/抗毒素基因對包括但不限於,abt/abi基因對,aat/aai基因對,及其片段。在某些實施例中,毒素基因包括DNA序列SEQIDNO:1,或SEQIDNO:3。在某些實施例中,抗毒素基因包括DNA序列SEQIDNO:2,或SEQIDNO:4。
這裡使用的宿主菌是指可以被穩定的重組質粒載體轉化的微生物。宿主菌包括,但不限於,蜂房哈夫尼菌(H.alvei)。
在某些實施例中,宿主菌天然不含有內源性質粒或消除了原有的內源性質粒。術語“消除”(cured)在此指將內源性質粒從宿主菌中消除。所得到的不含內源性質粒的宿主菌被稱為“已消除的”宿主菌。
在一些實施例中,作為宿主的H.alvei菌株可以從任何已知的H.alvei株中選擇。例如,無內源性質粒的H.alvei株,有pAlvA內源性質粒的H.alvei株和其質粒消除株(pAlvA-株),有pAlvB內源性質粒的H.alvei株和其質粒消除株(pAlvB-株)。
在某些實施例中,宿主菌是適合套用於工業規模或大規模生產的工業菌株。例如,工業菌株可以在發酵器中培養。培養的規模可以從幾百升至幾百萬升。相反實驗室菌株通常在幾升或更小的規模中培養。在一些實施例中,工業菌株可以在相對實驗室菌株更簡單和更經濟的培養液中生長。
多肽表達產物是由宿主菌產生的一種多肽。多肽表達產物包括但不限於,任何大腸桿菌可以生產的多肽表達產物,例如,酶(如脫羧酶,水解酶,磷酸化酶)。例如,脫羧酶為胺基酸脫羧酶。例如,脫羧酶為賴氨酸脫羧酶,酪氨酸脫羧酶,精氨酸脫羧酶,鳥氨酸脫羧酶,或谷氨酸脫羧酶。在一個實施例中,脫羧酶是賴氨酸脫羧酶。在另一個實施例中,編碼賴氨酸脫羧酶的聚核苷酸包括cadA基因,haldc基因或其片段。在另一個實施例中,編碼賴氨酸脫羧酶的聚核苷酸包括DNA序列SEQIDNO:5或SEQIDNO:6。在另一個實施例中,水解酶為葡萄糖苷酶,α-葡萄糖苷酶,β-葡萄糖苷酶,甘露糖苷酶,α-甘露糖苷酶,β-甘露糖苷酶,果糖苷酶,β-果糖苷酶,木糖苷酶,α-木糖苷酶,β-木糖苷酶,半乳糖苷酶,α-半乳糖苷酶,β-半乳糖苷酶,乳糖酶,澱粉酶,α-澱粉酶,β-澱粉酶,芥子酶,幾丁質酶,蔗糖酶,麥芽糖酶,轉化酶,透明質酸酶,或神經氨酸酶。在一個優選的實施例中,編碼β-半乳糖苷酶的聚核苷酸包括lacZ基因或其片段。
可複製骨架質粒可以是能夠在宿主菌中複製的任何一種質粒。在一個實施例中,穩定的重組表達質粒是由一個可以在蜂房哈夫尼菌中複製的骨架質粒衍生而成的。骨架質粒包括但不限於,pUC(例如pUC18和pUC19質粒),pBR322,pACYC質粒,和它們的衍生質粒。
此處使用的,所謂重組質粒“由在宿主細胞中可複製骨架質粒衍生而成”,是指該重組質粒通過在骨架質粒中插入一個或多個編碼抗毒素基因的聚核苷酸,一個或多個編碼毒素基因的聚核苷酸,和/或一個或多個編碼多肽表達產物的聚核苷酸,和它們的任意組合來構建重組質粒。
《在蜂房哈夫尼菌中穩定的重組表達質粒載體及其套用》所公開的內容還包括將一個或多個在此公開的穩定的重組質粒載體轉化進宿主菌而得到的轉化子。
這裡提到的轉化子是指通過引入一個或多個穩定的重組質粒載體而改變的宿主菌。在某些實施例中,轉化子是通過轉化向具備感受態的宿主細胞引進重組質粒載體而獲得的。
所述轉化子中帶有抗毒素基因或毒素/抗毒素基因對的質粒的穩定性高於同樣宿主菌中不含有抗毒素基因或者毒素/抗毒素基因對的重組質粒的穩定性。
在一個實施例中,宿主菌是一株不含有內源性質粒的蜂房哈夫尼菌。不含有內源性質粒的H.alvei株可以是天然沒有內源性質粒的菌株,也可以如前文所述是一個質粒消除後的菌株。穩定的重組質粒載體帶有一個或多個抗毒素基因,選自abi基因,aai基因,及其片段,和/或帶有一個或多個毒素/抗毒素基因對,選自abt/abi基因對,aat/aai基因對及其片段。
戊二胺生產方法
《在蜂房哈夫尼菌中穩定的重組表達質粒載體及其套用》所公開的內容還包括一個生產戊二胺的方法:
1a)培養一個具有在此公開的穩定的重組表達質粒的轉化子;
1b)用步驟1a中得到的菌液催化賴氨酸脫羧生成戊二胺;
1c)從步驟1b的反應液中回收戊二胺。
在此處提到的“使用步驟1a獲得的菌液”可能包括對步驟1a獲得的菌液的進一步處理。例如用緩衝溶液稀釋菌液,或離心獲得菌體、再將菌體重懸於緩衝溶液中,或將菌體裂解製得裂解液,或/和從菌體裂解液中提純賴氨酸脫羧酶。
轉化子可以在含有碳源和非碳營養源的培養基中培養。碳源包含但不限於糖(碳水化合物,如葡萄糖和果糖),油和/或脂肪,
脂肪酸,和/或其衍生物。油和脂肪包括十碳以上的飽和和/或不飽和脂肪酸,如椰油,棕櫚油,棕櫚仁油等。脂肪酸可以是飽和和/或不飽和脂肪酸,如己酸,辛酸,癸酸,月桂酸,油酸,棕櫚酸,亞油酸,亞麻酸,肉豆蔻酸等。脂肪酸衍生物包括但不限於脂肪酸酯和脂肪酸鹽。非碳營養源包括但不限於氮源,無機鹽和其他有機營養源。
例如,培養基包含轉化子可吸收的碳源,還可以包含一種或一種以上的其他營養源,如氮源、無機鹽和其他有機營養源。在某些實施例中,培養基中氮源的重量百分比占0.01至0.1%。氮源包括氨,銨鹽(如氯化銨,硫酸銨和磷酸銨),蛋白腖,肉類提取物,酵母提取物等。無機鹽包括但不限於,磷酸二氫鉀,磷酸氫二鉀,磷酸鎂,硫酸鎂,氯化鈉等。其他有機營養源包括,但不限於,胺基酸(如甘氨酸,丙氨酸,絲氨酸,蘇氨酸和脯氨酸),維生素(如維生素B1,維生素B12和維生素C),等等。
菌液培養可以在任何能夠讓菌細胞生長的溫度下進行。較適宜的溫度在約20至40℃,或約35℃。培養時間可以是約1天、約2天、約3天、約4天、約5天、約6天、約7天、約8天、約9天或約10天左右。
在一個實施例中,轉化子的培養基含有肽,蛋白腖,維生素(如B族維生素),微量元素(如氮,硫,鎂),和礦物質。這樣的培養基包括,但不限於眾所周知的LB培養基(由胰蛋白腖、酵母提取物和NaCl溶解於水(如蒸餾水或去離子水)製成)。
在一個實施例中,步驟1c還包括以下步驟:
1d)分離由步驟1b所得到的反應液的固體和液體部分;
1e)將步驟1d中得到的液體部分的pH調節到約14或更高;
1f)除去步驟1e中得到的液體中的水分;
1g)回收戊二胺。
在步驟1d中,分離步驟1b反應液的固液部分,可以通過傳統的離心和/或過濾來實現。
在步驟1e中,步驟1d中所得的液體成分的pH值可以通過添加鹼,如氫氧化鈉來調節。氫氧化鈉可以以固體或溶液(如水溶液)的形式來添加。
在步驟1f中,水份可以通過常壓或者真空蒸餾除去。
在步驟1g中,戊二胺可以通過常壓或者真空蒸餾回收。
《在蜂房哈夫尼菌中穩定的重組表達質粒載體及其套用》所公開的內容,還包括用在此公開的方法所製得的生物基戊二胺。
這裡提到的“生物基”的化合物是指根據ASTMD6866標準被認為是生物基的化合物。所述ASTMD6866標準指美國材料試驗標準協會ASTMD6866測試標準,其名稱為“用放射性碳分析法測定固體、液體和氣體試樣生物含量的試驗方法”,ASTMD6866是工業利用碳14測定生物質含量的標準方法。
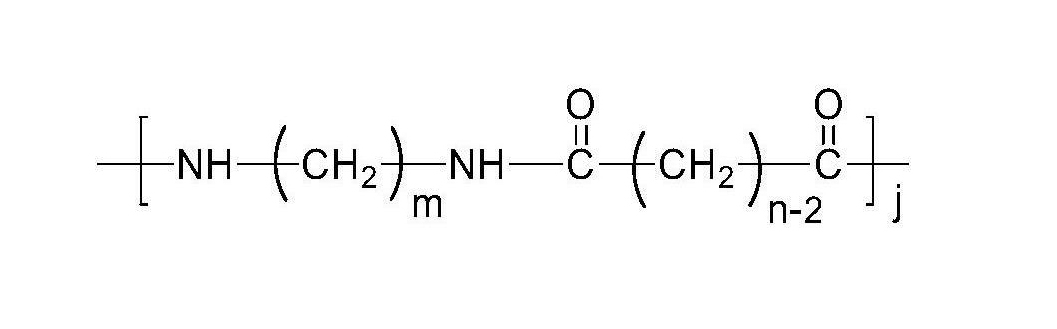
《在蜂房哈夫尼菌中穩定的重組表達質粒載體及其套用》所公開的內容還包括一種聚醯胺,其包括結構式1的結構:
結構式1
及其立體異構體,其中:m=4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,或22;n=4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,或22;j=約100~約1,000,000;
所述的聚醯胺由碳原子數為m的一種或多種二元胺和碳原子數為n的一種或多種二元酸聚合製得,二元胺、二元酸中的至少一種包含符合ASTMD6866標準的可再生來源的生物基碳,且該二元胺或二元酸的m或n可以相同或不同。
在一個實施例中,二元胺為生物基戊二胺,優選用《在蜂房哈夫尼菌中穩定的重組表達質粒載體及其套用》中所公開的方法製備的生物基戊二胺。二元酸的例子包括,但不限於:十碳二元酸、十一碳二元酸、十二碳二元酸、十三碳二元酸、十四碳二元酸、十六碳二元酸、十八碳二元酸,以及它們的任意組合。在某些實施例中,全部或部分的二元酸是生物基的。
在另一個實施例中,聚醯胺所含結構同上文所述,是由生物基戊二胺與一種或多種二元酸聚合製得,且優選按照《在蜂房哈夫尼菌中穩定的重組表達質粒載體及其套用》所提供的方法製備的生物基戊二胺;n=4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,或22;j=約100~約100萬或者j=約1000~約10萬或者j=約1000~約1萬;且二元酸包含符合ASTMD6866標準的生物基碳。
聚醯胺製備方法
《在蜂房哈夫尼菌中穩定的重組表達質粒載體及其套用》亦公開了在此公開的聚醯胺的製備方法,包括:
按照《在蜂房哈夫尼菌中穩定的重組表達質粒載體及其套用》所提供的方法製備生物基戊二胺,用作二元胺。
在一個實施例中,該方法進一步包括製備一種或多種生物基二元酸。
在另一個實施例中,該方法進一步包括反應生物基戊二胺和一種或多種生物基二元酸來製備聚醯胺。
《在蜂房哈夫尼菌中穩定的重組表達質粒載體及其套用》中所公開的內容還包括含有在此公開的一種或多種聚醯胺的組合物。
在一個實施例中,二元胺為生物基戊二胺,優選用《在蜂房哈夫尼菌中穩定的重組表達質粒載體及其套用》中所公開的方法製備的生物基戊二胺。二元酸的例子包括,但不限於:十碳二元酸、十一碳二元酸、十二碳二元酸、十三碳二元酸、十四碳二元酸、十六碳二元酸、十八碳二元酸,以及它們的任意組合。在某些實施例中,全部或部分的二元酸是生物基的。
在另一個實施例中,聚醯胺所含結構同上文所述,是由生物基戊二胺與一種或多種二元酸聚合製得,且優選按照《在蜂房哈夫尼菌中穩定的重組表達質粒載體及其套用》所提供的方法製備的生物基戊二胺;
n=4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,或22;
j=約100~約100萬或者j=約1000~約10萬或者j=約1000~約1萬;且
二元酸包含符合ASTMD6866標準的生物基碳。
《在蜂房哈夫尼菌中穩定的重組表達質粒載體及其套用》亦公開了一種製備五亞甲基-1,5-異氰酸酯(1,5-diisocyanatopentane)的方法,包括:
2a)按照《在蜂房哈夫尼菌中穩定的重組表達質粒載體及其套用》所公開的方法製備生物基戊二胺;
2b)將步驟2a中所得到的生物基戊二胺轉化為五亞甲基-1,5-異氰酸酯。
步驟2b的方法可以採用公知的二元胺轉化為異氰酸酯的方法。例如傳統的光氣法,包括一步高溫光氣法,即在高溫下將光氣與二元胺混合製得異氰酸酯,以及由此改進的兩步光氣法,和用三光氣代替光氣的三光氣法。此外還有不採用光氣作為原料的方法,例如用CO2代替光氣的己二胺羰基化法:在伯胺和有機鹼溶液中通入CO2,向反應混合物中再加入適量的含磷親電試劑,發生脫水放熱反應,製得異氰酸酯。又例如,氨基甲酸酯熱分解法,先用伯胺製備氨基甲酸酯,再加熱分解氨基甲酸酯製得異氰酸酯。
附圖說明
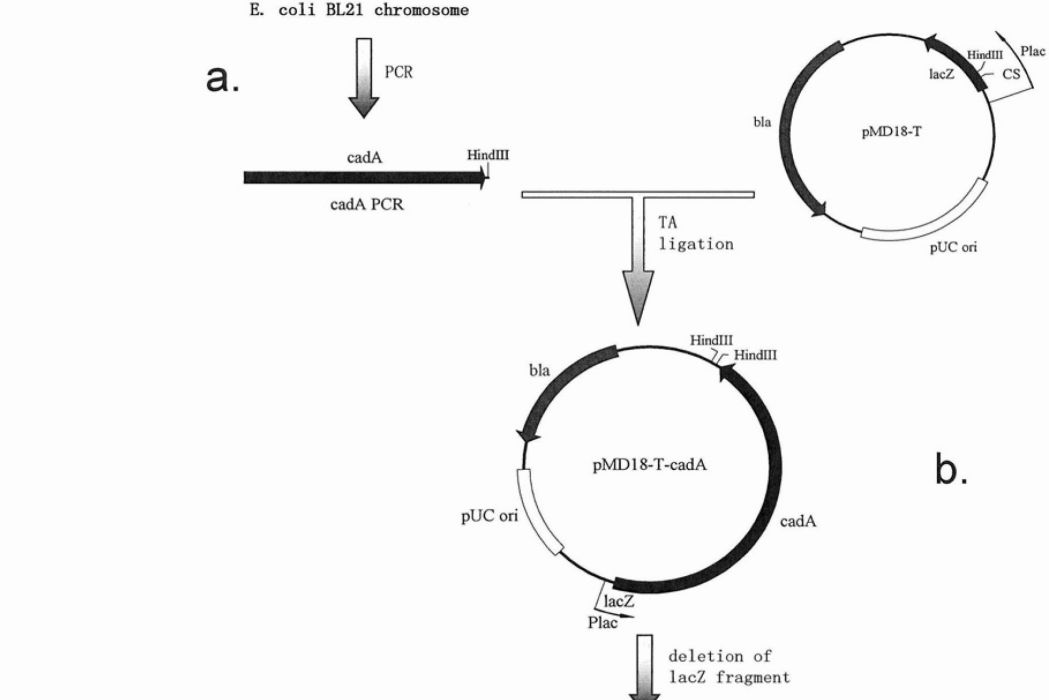
圖1為例1中所述的pPlac-cadA-abtabi重組表達質粒的構建。
a)使用大腸桿菌BL21染色體為模板得到的cadA的PCR產物;
b)將cadAPCR產物連線到pMD18-T載體上得到的pMD18-T-cadA質粒,其中,cadA基因的5'位置有一段lacZ基因片段;
c)用PCR定點誘變刪除lacZ基因片段後,形成的pPlac-cadA質粒;
d)用H.alvei質粒pAlvB為模板,得到的具有HindIII位點及abt/abi的PCR產物,該PCR產物隨後被連線到pMD18-T載體;
e)用HindIII酶切pPlac-cadA和含abt/abi片段的pMD18-T質粒,將pPlac-cadA質粒的主體和abt/abi片段連線,得到pPlac-cadA-abtabi重組表達質粒。
圖2為實施例3中所述的重組菌JM109/pPlac-cadA,連續傳代培養所得的菌液,梯度稀釋以後在LB和LB/AMP平板上的菌落生長狀況。
圖3為實施例3中所述的重組菌Ha/pPlac-cadA,連續傳代培養所得的菌液,梯度稀釋以後在LB和LB/AMP平板上的菌落生長狀況。
圖4為實施例3中所述的重組菌Hac/pPlac-cadA-abtabi,連續傳代培養所得的菌液,梯度稀釋以後在LB和LB/AMP平板上的菌落生長狀況。
技術領域
《在蜂房哈夫尼菌中穩定的重組表達質粒載體及其套用》屬於分子生物學領域,具體涉及一種穩定的重組表達質粒載體及其用途。
權利要求
1.一種包含穩定的重組表達質粒載體的轉化子,包含:一段編碼重組型抗毒素基因的聚核苷酸,其表達一種多肽,和一段編碼毒素基因的聚核苷酸,其在宿主細胞中表達對宿主細胞有毒的多肽,所述毒素基因-抗毒素基因為abt-abi或aat-aai;一段編碼多肽表達產物的聚核苷酸,其中,所述該穩定的重組表達質粒載體由在蜂房哈夫尼菌中可複製骨架質粒衍生而成,所述轉化子以蜂房哈夫尼菌為宿主菌;當所述宿主菌含有pAlvB或pAlvA內源性質粒時清除所述內源性質粒。
2.根據權利要求1所述的轉化子,其特徵在於所述的毒素基因aat為SEQIDNO:1所示的DNA序列、毒素基因abt為SEQIDNO:3所示的DNA序列。
3.根據權利要求1所述的轉化子,其特徵在於所述的抗毒素基因aai為SEQIDNO:2所示的DNA序列、抗毒素基因abi為SEQIDNO:4所示的DNA序列。
4.根據權利要求1所述的轉化子,其特徵在於所述的骨架質粒為pUC18、pUC19、pBR322、pACYC中的任一質粒或其衍生質粒。
5.根據權利要求1所述的轉化子,其特徵在於所述的多肽表達產物包含脫羧酶、水解酶和磷酸化酶中至少一種。
6.根據權利要求5所述的轉化子,其特徵在於脫羧酶為賴氨酸脫羧酶,酪氨酸脫羧酶,精氨酸脫羧酶,鳥氨酸脫羧酶,或谷氨酸脫羧酶。
7.根據權利要求6所述的轉化子,其特徵在於編碼賴氨酸脫羧酶的聚核苷酸包括haldc基因,cadA基因。
8.根據權利要求7所述的轉化子,其特徵在於所述的haldc基因序列如SEQIDNO:6所示,cadA基因序列如SEQIDNO:5所示。
9.根據權利要求5所述的轉化子,其特徵在於所述的水解酶為β-半乳糖苷酶。
10.根據權利要求9所述的轉化子,其特徵在於編碼所述β-半乳糖苷酶基因的聚核苷酸包含lacZ基因。
11.根據權利要求1所述的轉化子,其特徵在於所述的蜂房哈夫尼菌為蜂房哈夫尼菌的工業菌株。12.一種生產1,5-戊二胺的方法,包括:1a)培養權利要求1-11所述的轉化子;1b)用步驟1a中得到的菌液催化賴氨酸脫羧生成1,5-戊二胺;和1c)從步驟1b中得到的反應液中提取純化得到1,5-戊二胺。
實施方式
以大腸桿菌BL21(Biomed公司)染色體DNA為模板,用引物1和2(引物1,SEQID:NO7:ATGAACGTTATTGCAATATT,引物2,SEQID:NO8:ACTGAAAGCTTCCACTTCCCTTGTACGAGCT)複製cadA基因(圖1a)。將該PCR產物與pUC18-衍生的T載體,pMD18-T(TaKaRa公司)連線。選擇cadA基因和lac啟動子(Plac)同向的連線產物。產生的質粒命名為pMD18-T-cadA(圖1b)。
pMD18-T-cadA所載cadA基因與其5’端的一小段lacZ基因處於同一閱讀框。因此,通過定點誘變PCR刪除該多餘的lacZ片段。PCR反應包括:50ng質粒DNA,10pmole引物3(SEQID:NO9:ATTCAATATTGCAATAACGTTCATAGCTGTTTCCTGTGTG),dNTPs(每種0.25mM),1微升PfuDNA聚合酶(Biomed公司),1微升TaqDNA連線酶(NEB),4微升PfuDNA聚合酶10×緩衝液,5微升TaqDNA連線酶10×緩衝液,加去離子水至總體積為50微升。熱循環條件與常規PCR相同。在PCR反應結束後,加入1微升DpnI(NEB)內切酶,在37℃反應1hr。用10微升該PCR反應液轉化100微升大腸桿菌BL21感受態細胞。從轉化子菌落中提取質粒,用引物4(SEQID:NO10:AGGAAACAGCTATGAACGTT)測序。預期質粒上cadA基因5’端的lacZ片段應被刪除。經過測序驗證得到的預期質粒,命名為pPlac-cadA(圖1c)。
該實施例中使用的H.alvei菌株含有pAlvB內源性質粒。pAlvB質粒上的毒素/抗毒素基因對為abt/abi基因對。根據公布的pAlvB序列(GenBank:AY271829)設計引物5和6(引物5,SEQID:NO11:ACTGAAAGCTTTACTTTCATCACAAGCCTCT,引物6,SEQID:NO12:ACTGAAAGCTTAGATTCAGCGCGAGAGTGAT),這兩個引物在片段的兩端引入了一對HindIII酶切位點(圖1d)。以pAlvB為模板,複製一段含有abt/abi基因的片段。將PCR產物連線到pMD18-T載體。然後將該連線產物用HindIII酶切,得到一段含有abt/abi基因的約1.8kb的片段。再將pPlac-cadA質粒也用HindIII酶切,得到一段約4.8kb的片段。最後,將pPlac-cadA片段和abt/abi片段連線在一起,形成重組表達質粒,pPlac-cadA-abtabi(圖1e)。
由於該實施例中使用的H.alvei菌株含有內源性質粒,首先對該H.alvei菌株進行質粒消除,得到無內源性質粒的H.alvei株(H.alveic)。再將重組表達質粒pPlac-cadA-abtabi轉化進H.alveic。這種重組表達質粒在無抗生素篩選的條件下經過5次或更多次連續傳代培養仍能保持穩定。
對一株帶有pAlvB內源性質粒的H.alvei(Ha)做質粒消除。先用一個重組表達抗毒素的pUC衍生質粒解除宿主對pAlvB的生存依賴。使用pUC衍生的質粒作為骨架質粒,是因為它能夠在H.alvei內複製,並且其拷貝數可以隨培養溫度升高而提高。因此,在有抗生素篩選和較高培養溫度的條件下,pUC質粒在與pAlvB的競爭中處於優勢,使後者易於丟失。pUC質粒上重組表達的Abi抗毒素蛋白可以中和pAlvB遺留的Abt毒素蛋白,使宿主細胞不會死亡。
以pAlvB為模板,用引物6和7(引物7,SEQID:NO13:ACTGAAAGCTTTTTAATTGTGTGACCACTAT)複製abi基因。將PCR產物連線到pMD18-T載體(含有氨苄青黴素抗性基因),該連線產物被命名為pMD18-T-abi。用該質粒轉化以CaCl2法製備的H.alvei感受態細胞。H.alvei感受態細胞的製備方法與常用的E.coli感受態細胞的製備方法相同。
所得的轉化子中包含兩個質粒:pAlvB和pMD18-T-abi。將轉化子劃線於LB/AMP平板上,在40℃過夜培養。對於長出來的菌落,用引物5和6做菌落PCR。消除了pAlvB的菌落沒有PCR產物。
下一步是從消除了pAlvB的H.alvei菌株中去除pMD18-T-abi質粒。將該菌株劃線於不含氨苄青黴素的LB平板上,在40℃過夜培養。將長出來的菌落再次劃線於不含氨苄青黴素的LB平板上,在40℃過夜培養。對長出來的菌落用引物6和7做菌落PCR。消除了pMD18-T-abi的菌落沒有PCR產物。用質粒抽提試劑盒(Axygen公司)對質粒消除的菌株進行DNA提取,沒有得到質粒DNA。
該質粒消除的菌株被命名為H.alveic(Hac)。
重組質粒在宿主中的穩定性通過如下方法檢測:在非選擇性培養液中連續傳代重組菌株,將每次培養所得的菌液進行梯度稀釋,分別塗在非選擇性和選擇性平板上,估算和比較菌液中的總細胞數和含質粒的細胞數。
將3個重組菌株(JM109/pPlac-cadA,Ha/pPlac-cadA,Hac/pPlac-cadA-abtabi)的單菌落分別接種於含有氨苄青黴素的LB培養液中(JM109為E.coliJM109菌株(Biomed公司);Ha為含有內源性質粒pAlvB的H.alvei菌株;Hac為消除了內源性質粒的H.alvei菌株),於35℃搖床內生長1天(種子液)。然後以0.1%的接種率接種於新鮮的無氨苄青黴素的LB培養液內。於同樣溫度生長1天(第1次傳代)。接著用相同的接種率和相同的生長條件連續傳代和培養(第2至第5次傳代)。每次培養結束的菌液用無菌的0.85%氯化鈉溶液進行10×梯度稀釋。取5微升稀釋後的樣品分別點於LB平板和LB/AMP平板上。在35℃溫育1天。在無氨苄青黴素的平板上可以估計菌液的細胞總數,在有氨苄青黴素的平板上可以估算菌液中帶有質粒的細胞的數量(圖2(JM109/pPlac-cadA),圖3(Ha/pPlac-cadA),圖4(Hac/pPlac-cadA-abtabi))。
在非選擇性培養液中經過2到3次連續傳代,JM109/pPlac-cadA和Ha/pPlac-cadA菌液中含有質粒的菌的比例下降到1%左右(圖2和3)。與此相反,經過5次連續傳代,Hac/pPlac-cadA-abtabi菌液中含有質粒的菌的比例仍為100%(圖4)。因此,在H.alvei中,毒素/抗毒素基因使重組表達質粒在沒有抗生素篩選的情況下也能保持穩定。
榮譽表彰
2018年12月20日,《在蜂房哈夫尼菌中穩定的重組表達質粒載體及其套用》獲得第二十屆中國專利優秀獎。