基本介紹
- 中文名:四羥基合銅酸鈉
- 英文名:Sodium cuprate
- 別稱:銅酸鈉
- 化學式:Na2[Cu(OH)4]
- 分子量:177.55
- 熔點:未知
- 沸點:未知
- 水溶性:易溶
- 密度:未知
- 閃點:未知
- 套用:用於製備強氧化劑高銅酸鈉
基本信息,理化性質,製備,風險,用途,其它相關試驗現象,
基本信息
中文參考名稱:四羥基合銅酸鈉;銅酸鈉
英文參考名稱:Sodium cuprate(直譯為銅酸鈉)
參考化學式:Na2[Cu(OH)4](讀作四羥基合銅酸鈉)
化學式量:177.55
理化性質
外觀:藍色溶液,也有叫絳藍色(絳本是深紅色之意,這裡一般理解為藍色中略帶灰色 ),較高濃度的強鹼性溶液呈現出較重的深藍色
水溶液酸鹼性:由於此溶液只能於鹼性環境中存在,所以水溶液呈鹼性
穩定性:不夠穩定,久置易分解,生成黑色的氧化銅沉澱。隨著溶液鹼性的增強其穩定性會有所增強,但即使其處於高濃度的強鹼溶液中久置數周至數月仍能見到黑色沉澱物(氧化銅)。溶液中可能存在如下轉化:
Na2[Cu(OH)4]<====> Na2CuO2(讀作銅酸鈉)+2H2O
配離子空間構型:網路上較為公認的是平面正方形結構,以姜泰勒效應解釋
製備
氫氧化銅溶解於高濃度的氫氧化鈉溶液即可直接得到該溶液;另有的常用方法是硫酸銅溶液中加過量氫氧化鈉;此外還可以直接將氧化銅投入高濃度氫氧化鈉溶液,常溫下反應數小時後靜置即可得到透明的深藍色溶液,溶液呈強鹼性。此外建議製得該溶液後不要用濾紙過濾,濾紙可能導致藍色的氫氧化銅析出。靜置沉降後抽取上層透明溶液即可。為使溶液更穩定,可補加鹼增強溶液的鹼性。
相關反應式:Cu(OH)2 + 2NaOH ====>Na2[Cu(OH)4]; 氧化銅溶於高濃度氫氧化鈉溶液
氧化銅溶於高濃度氫氧化鈉溶液
 氧化銅溶於高濃度氫氧化鈉溶液
氧化銅溶於高濃度氫氧化鈉溶液2 NaOH + CuO + H2O ====>Na2[Cu(OH)4]
風險
主要為鹼性腐蝕性危害。
用途
相關反應式:2Na2[Cu(OH)4] + R-CHO====> R-COONa + Cu2O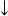 + 3H2O + 3NaOH;
+ 3H2O + 3NaOH;
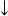
或簡寫為:2Cu(OH)2 + R-CHO====> R-COOH + Cu2O + 2H2O
+ 2H2O

其它相關試驗現象
將該溶液加入葡萄糖溶液中,加熱,出現磚紅色不溶物(氧化亞銅)。
將四羥基合銅酸鈉的高濃度鹼溶液加熱蒸乾得到橘黃色固態物質(可能是含有一價態銅的化合物的混合物)。
用鉑做陽極,石墨做陰極電解已經發生部分分解的四羥基合銅酸鈉溶液,兩個電極均產生大量氣泡,陰極有紅色固體析出
將四羥基合銅酸鈉溶液加入乙醇中,靜置,上層液體逐漸析出磚紅色沉澱
另外,四羥基合銅酸鈉還會與次溴酸反應,方程式如下:
2Na2[Cu(OH)4]+2HBrO=2NaCuO2+NaBr+NaBrO+5H2O
生成的高銅酸鈉只能在鹼性條件下存在,其中銅為+3價

 四羥基合銅酸鈉溶液和葡萄糖加熱反應
四羥基合銅酸鈉溶液和葡萄糖加熱反應