咪唑衍生物、製備方法及用途
《咪唑衍生物、製備方法及用途》是北京歐博方醫藥科技有限公司 於2011年6月15日申請的發明專利,該專利的申請號為2011101604965,公布號為CN102464652A,公布日為2012年5月23日,發明人是李靖,該專利屬於化學藥物領域。
如“發明內容”中式(I)所述的咪唑類化合物能夠抑制環氧化酶,干擾體內花生四烯酸向前列腺素的生物轉化,因此,《咪唑衍生物、製備方法及用途》所述化合物及其藥物組合物可以治療環氧化酶介導的相關疾病,如可以用於治療和緩解人和動物物的炎症及由炎症引發的各種疾病,如關節炎、神經退化性疾病、抑鬱症、神經分裂症、鎮痛疾病、腸癌和乳腺癌。
2018年12月20日,《咪唑衍生物、製備方法及用途》獲得第二十屆中國專利銀獎。
基本介紹
中文名 :咪唑衍生物、製備方法及用途公布號 :CN102464652A公布日 :2012年5月23日申請號 :2011101604965申請日 :2011年6月15日申請人 :北京歐博方醫藥科技有限公司地址 :北京市海淀區開拓路5號A318室發明人 :李靖分類號 :C07D401/04(2006.01)I、C07D401/14(2006.01)I、A61K31/4439(2006.01)I、A61P29/00(2006.01)I等代理機構 :北京兆君聯合智慧財產權代理事務所(普通合夥)類別 :發明專利代理人 :胡敬紅
專利背景,發明內容,技術領域,權利要求,實施方式,榮譽表彰,
專利背景 花生四烯酸 的代謝產物參與了許多急、慢性炎症發病過程。而這一大類脂肪性的花生四烯酸代謝產物是在一系列酶的作用下得到的。從治療的意義上考慮,其中最重要的一個酶就是前列腺素G/H合成酶,即
環氧化酶 (COX)。它催化產生許多血管緊張素和炎症物質,如前列腺素(PGE
2 、PGD
2 、PGF
2 ),環前列腺素(PGI
2 ),和血栓素(TXA
2 )等。
因在抗炎鎮痛方面的顯著活性,非甾體抗炎藥(NSAIDs)已被廣泛套用於治療疼痛及關節炎。NSAIDs主要是通過抑制環氧化酶(COX),也就是前列腺素G/H合成酶(PGHs),從而抑制花生四烯酸代謝形成前列腺素類物質而起作用。前列腺素,尤其是前列腺素PGE2 ,是在炎症發生時被檢測到的主要花生酸類物質,是導致疼痛、發熱和其他炎症相關症狀的主要介導物。抑制前列腺素的生物合成已經被證明是抗炎藥物作用的重要靶點。然而傳統非甾體抗炎藥因會導致危及生命的潰瘍和腎臟毒性等副作用,而使其在治療上的套用受到很大的限制。皮質類固醇類藥物雖可作為NSAIDs的替代,但長期使用也會產生嚴重的不良反應。
20世紀90年代初研究發現,環氧化酶存在兩種酶,即COX-1和COX-2。COX-1存在於胃、腎及血小板等許多正常的組織中。NSAIDs引起的胃腸及腎的毒副作用就是由COX-1的抑制所導致。而COX-2是可誘導的酶,在許多組織中,如巨噬細胞、骨細胞、成纖維細胞及內皮細胞中,經一系列炎症因子或細胞因子的誘導而大量表達。
COX-2的發現使得選擇性COX-2抑制劑的合成成為可能。高選擇性的COX-2抑制劑對COX-1的抑制作用降低,從而降低了潰瘍方面的毒性,提高了這類藥的胃腸耐受力。《咪唑衍生物、製備方法及用途》即闡述了一類新的選擇性COX-2抑制劑。
發明內容 《咪唑衍生物、製備方法及用途》是關於如式(I)所示的化合物:
式(I) 這裡:當X=N,Y=C,或者Y=N,X=C原子;取代基R代表氫原子、C1-5 烷基、鹵素、氰基;取代基R代表被一個或多個基團獨立地取代的芳基或雜芳基,其中取代基團可以是鹵素、C1-8 烷基、ROC0-8 烷基、RSC0-8 烷基、氰基、硝基、-NRR、-NRSO2 R、-SOR、-SO2 R、-SO2 NRR、或者-CONRR;取代基R代表-SOR、-SO2 R、-SR基;取代基R代表氫原子、C1-8 烷基、C1-8 鹵代烷基、芳基C0-8 烷基,其中芳基可以被1個或多個基團選擇性的取代,取代基團可以是C1-8 烷基、鹵素、C1-8 鹵代烷基、氰基、硝基;取代基R代表C1-8 烷基或者C1-8 鹵代烷基;取代基R代表氫原子、C1-8 烷基,芳基C0-8 烷基,其中芳基可以被1個或多個基團選擇性的取代,這些基團可以是C1-8 烷基、鹵素、C1-8 鹵代烷基、氰基、硝基;取代基R代表-NH2 、C1-8 烷基、C1-8 鹵代烷基。
這裡所說的碳氫部分中碳原子的數量是由一個含碳原子最小個數及最大個數的前綴來命名的,例如,前綴為Ca-b 的烷基表示含a到b個碳原子的烷基。因此,C1-8 烷基就是指含有1-8個碳原子的烷基。
“烷氧基”是指與一氧原子鍵合的直鏈或帶支鏈的、單價的、飽和的碳脂肪鏈,包括但不限於如甲氧基、乙氧基、丙氧基、丁氧基、異丁氧基、叔丁氧基以及其它類似基團。
“烷基”是指直鏈或帶支鏈的、單價的、飽和碳脂肪鏈,包括但不限於如甲基、乙基、丙基、異丙基、丁基、異丁基、叔丁基、戊基、異戊基、己基以及其它類似基團。
“芳基”是指一種環狀的芳香烴,包括但不限於如苯基、
萘基 、蒽基、菲基,以及其它類似基團。
“鹵素”是指氯、溴、氟和碘原子或基團。
“雜芳基”是指其中一個或多個碳原子被如氮、氧或硫等雜原子取代的單環或多環芳香烴。如果雜芳基含有不只一個雜原子,則這些取代的雜原子可以相同也可以不同。雜芳基包括但不限於如苯並呋喃基、苯並噻吩基、苯並咪唑基、苯並噁唑基、苯並噻唑基、苯並吡喃基、呋喃基、咪唑基、吲唑基、吲嗪基、吲哚基、異苯並呋喃基、異吲哚基、異喹啉基、異噻唑基、異噁唑基、萘啶基、噁二唑基、噁嗪基、噁唑基、酞嗪基、蝶啶基、嘌呤基、吡喃基、吡嗪基、吡唑基、噠嗪基、吡啶[3,4-b]吲哚基、吡啶基、嘧啶基、吡咯基、喹嗪基、喹啉基、喹喔啉基、噻二唑基、噻三唑基、噻唑基、噻吩基、三嗪基、三唑基、呫噸基以及其它類似基團;
“取代”是指分子中的氫原子被其它不同的原子或分子所替代。替換氫原子的原子或分子稱之為“取代基”。
該發明的一種實施方式包括一組具有式(I)結構的化合物,其所述化合物的結構特徵在於:當X=N,Y=C,或者Y=N,X=C原子;取代基R代表氫原子、C1-5 烷基、鹵素、氰基;取代基R代表被一個或多個基團獨立地取代的芳基或雜芳基,其中取代基團可以是鹵素、C1-8 烷基、ROC0-8 烷基、RSC0-8 烷基、氰基、硝基、-NRR、-NRSO2 R、-SOR、-SO2 R、-SO2 NRR、或者-CONRR;取代基R代表-SOR、-SO2 R、-SR基;取代基R代表氫原子、C1-8 烷基、C1-8 鹵代烷基、芳基C0-8 烷基,其中芳基可以被1個或多個基團選擇性的取代,取代基團可以是C1-8 烷基、鹵素、C1-8 鹵代烷基、氰基、硝基;取代基R代表C1-8 烷基或者C1-8 鹵代烷基;取代基R代表氫原子、C1-8 烷基,芳基C0-8 烷基,其中芳基可以被1個或多個基團選擇性的取代,這些基團可以是C1-8 烷基、鹵素、C1-8 鹵代烷基、氰基、硝基;所述芳基是指苯基或者萘基;所述雜芳基是指那些能與苯環駢合的雜芳基,如吡啶、吡嗪、嘧啶或者噠嗪;取代基R代表-NH2 、C1-8 烷基、C1-8 鹵代烷基。
該發明的另一種實施方式包括一組具有式(I)結構的化合物,其所述化合物的結構特徵在於:當X=N,Y=C,或者Y=N,X=C原子;取代基R代表氫原子、C1-5 烷基、鹵素;取代基R代表被一個或多個基團獨立地取代的芳基或雜芳基,其中取代基團可以是鹵素、C1-8 烷基、ROC0-8 烷基、RSC0-8 烷基、硝基、-NRR、-SOR;取代基R代表-SR、-SO2 R基;取代基R代表氫原子、C1-8 烷基、C1-8 鹵代烷基;取代基R代表C1-8 烷基或者C1-8 鹵代烷基;所述芳基是指苯基,所述雜芳基是指吡啶;取代基R代表-NH2 、C1-8 烷基。
該發明的另一種實施方式包括一組具有式(I)結構的化合物,其所述化合物的結構特徵在於:當X=N,Y=C,或者Y=N,X=C原子;取代基R代表氫原子、C1-3 烷基、鹵素;取代基R代表被一個或多個基團獨立地取代的芳基或雜芳基,其中取代基團可以是鹵素、C1-5 烷基、ROC0-5 烷基、RSC0-5 烷基、硝基、-NRR、-SOR;取代基R代表-SR、-SO2 R基;取代基R代表氫原子、C1-5 烷基、C1-5 鹵代烷基;取代基R代表C1-5 烷基或者C1-5 鹵代烷基;取代基R代表氫原子、C1-5 烷基,芳基C0-5 烷基,其中芳基可以被1個或多個基團選擇性的取代,這些基團可以是C1-5 烷基、鹵素、C1-5 鹵代烷基、氰基、硝基;取代基R代表C1-5 烷基。
該發明的另一種實施方式包括一組具有式(I)結構的化合物,其所述化合物的結構特徵在於:當X=N,Y=C,或者Y=N,X=C原子;取代基R代表氫原子、C1-3 烷基、鹵素;取代基R代表被一個或多個基團獨立地取代的芳基或雜芳基,其中取代基團可以是鹵素、C1-4 烷基、ROC0-4 烷基、RSC0-4 烷基、硝基、-NRR、-SOR;取代基R代表-SR、-SO2 R基;取代基R代表氫原子、C1-4 烷基、C1-4 鹵代烷基;取代基R代表C1-4 烷基或者C1-4 鹵代烷基;取代基R代表氫原子、C1-4 烷基,芳基C0-4 烷基,其中芳基可以被1個或多個基團選擇性的取代,這些基團可以是C1-4 烷基、鹵素、C1-4 鹵代烷基、氰基、硝基;取代基R代表C1-4 烷基。
該發明的另一種實施方式包括一組具有式(I)結構的化合物,其所述化合物的結構特徵在於:當X=N,Y=C,或者Y=N,X=C原子;取代基R代表氫原子、氯原子、溴原子、C1-3 烷基;取代基R代表被一個或多個基團獨立地取代的芳基或雜芳基,其中取代基團可以是鹵素、C1-3 烷基、ROC0-4 烷基、RSC0-4 烷基、硝基、氨基、-SOR;取代基R代表-SR、-SO2 R基;取代基R代表C1-4 烷基、C1-4 鹵代烷基;取代基R代表C1-3 烷基。
該發明的另一種實施方式包括一組具有式(I)結構的化合物,其所述化合物的結構特徵在於:當X=N,Y=C,或者Y=N,X=C原子;取代基R代表氫原子、氯原子、甲基;取代基R代表被一個或多個基團獨立地取代的芳基或雜芳基,其中取代基團可以是鹵素、C1-3 烷基、C1-3 烷氧基、ROC0-4 烷基、RSC0-4 烷基、硝基、氨基、-SOR;取代基R代表-SR、-SO2 R基;取代基R代表C1-3 烷基、C1-3 鹵代烷基;取代基R代表C1-3 烷基;取代基R代表甲基。
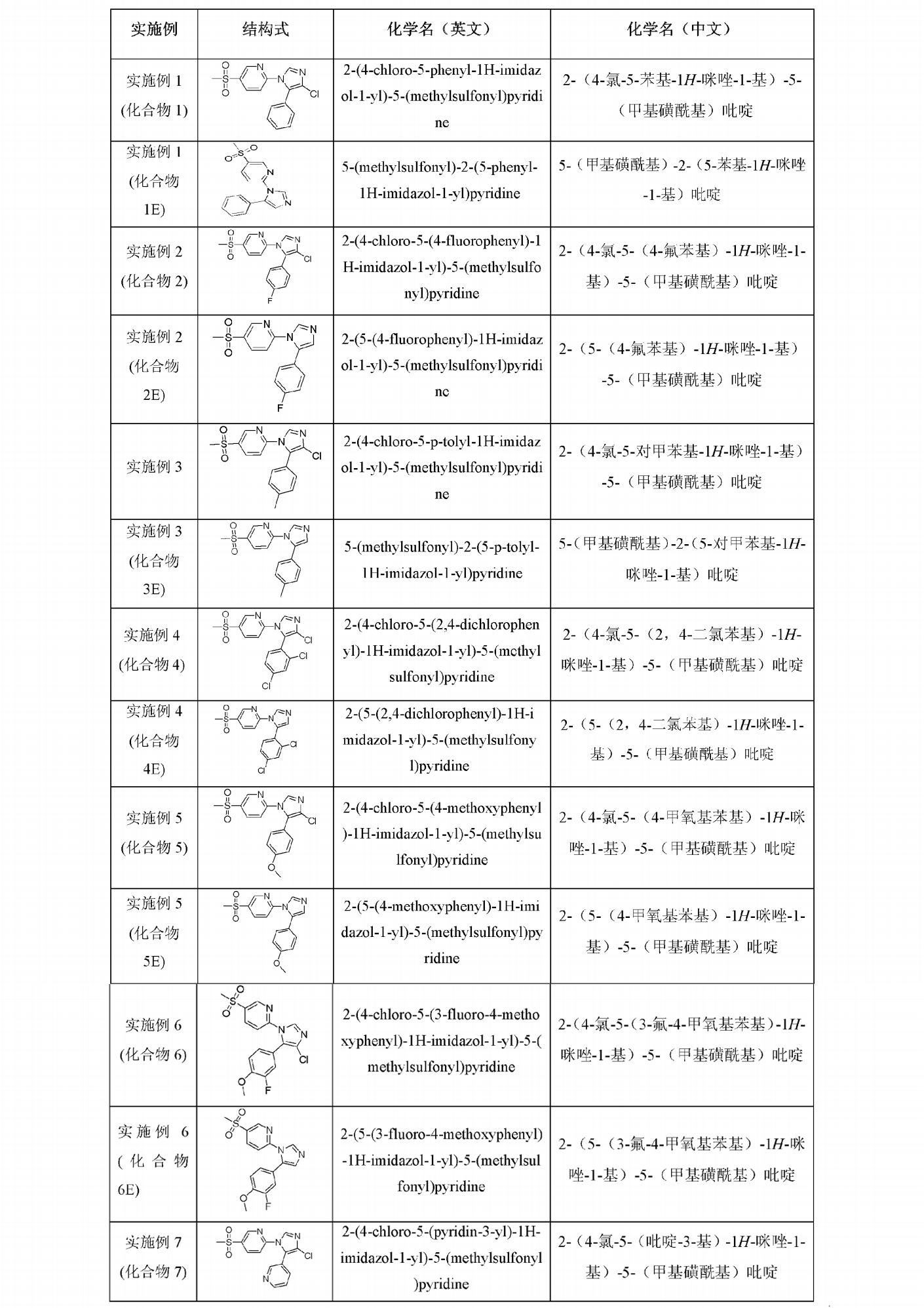
該發明的一個更優選實施方式中,式(I)的化合物選自:2-(4-氯-5-苯基-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,5-(甲基磺醯基)-2-(5-苯基-1H-咪唑-1-基)吡啶,2-(4-氯-5-(4-氟苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(4-氟苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-對甲苯基-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,5-(甲基磺醯基)-2-(5-對甲苯基-1H-咪唑-1-基)吡啶,2-(4-氯-5-(2,4-二氯苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(2,4-二氯苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(4-甲氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(4-甲氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(3-氟-4-甲氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(3-氟-4-甲氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(吡啶-3-基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,5-(4-氯-5-苯基-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,2-(甲基磺醯基)-5-(5-苯基-1H-咪唑-1-基)吡啶,5-(4-氯-5-(4-甲氧基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(3-氟-4-甲氧基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(吡啶-3-基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(4-氟苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,2-(4-氯-5-(3-氯-4-甲氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(3-氟苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(3-氟-4-甲基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(2-氟苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(2,4-二氟苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(2,4-二氯苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(3-氟苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(3-氟-4-甲基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(2-氟苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,5-(甲基磺醯基)-2-(5-(4-(三氟甲氧基)苯基)-1H-咪唑-1-基)吡啶,4-甲基-3-(1-(5-(甲基磺醯基)吡啶-2基)-1H-咪唑-5-基)吡啶,2-(5-(2-氟-4-甲氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(3-氯-4甲基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(3-甲氧基-4-甲基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(4-氯苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,4-氯-3-(1-(5-(甲基磺醯基)吡啶-2基)-1H-咪唑-5-基)吡啶,2,4-二氯-3-(1-(5-(甲基磺醯基)吡啶-2基)-1H-咪唑-5-基)吡啶,2-(5-(2-氯-4甲氧基吡啶-3-基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,3,4-二氯-5-(1-(5-(甲基磺醯基)吡啶-2基)-1H-咪唑-5-基)吡啶,5-(甲基磺醯基)-2-(5-(4-丙氧基苯基)-1H-咪唑-1-基)吡啶,2-(5-(3,5-二乙氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(4-乙氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,5-(甲基磺醯基)-2-(5-(4-硝基苯基)-1H-咪唑-1-基)吡啶,2-(5-(4-(亞甲基磺醯基)苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(4-(亞乙磺醯基)苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,N,N-二甲基-4-(1-(5-(甲基磺醯基)吡啶-2基)-1H-咪唑-5-基)苯胺,2-(5-(4-氟苯基)-4-甲基-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(2,4-二氟苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(2-氯-4甲氧基吡啶-3-基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,3,4-二氯-5-(4-氯-1-(5-(甲基磺醯基)吡啶-2基)-1H-咪唑-5-基)吡啶,2-(4-氯-5-(4-丙氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(3,5-二乙氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(4-乙氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(4-硝基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(4-(甲硫基)苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(4-(乙硫基)苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(4-乙氧基吡啶-3-基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-溴-5-(4-氟苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(4-氟苯基)-4-甲基-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(4-(三氟甲氧基)苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(3,4-二氯苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,5-(4-氯-5-(3-氟苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(3-氟-4-甲基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(2-氟苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(4-(三氟甲氧基)苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(5-(4-氟苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,2-(甲基磺醯基)-5-(5-對甲苯基-1H-咪唑-1-基)吡啶,5-(5-(2,4-二氟苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(5-(2,4-二氯苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(5-(4-甲氧基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(5-(3-氟-4-甲氧基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(5-(3-氟苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(5-(3-氟-4-甲基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(5-(2-氟苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,2-(甲基磺醯基)-5-(5-(4-(三氟甲氧基)苯基)-1H-咪唑-1-基)吡啶,4-甲基-3-(1-(6-(甲基磺醯基)吡啶-3-基)-1H-咪唑-5-基)吡啶,5-(5-(2-氟-4-甲氧基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(5-(3-氯-4甲基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(5-(3-甲氧基-4-甲基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(5-(4-氯苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(5-(4-氯吡啶-3-基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,2,4-二氯-3-(1-(6-(甲基磺醯基)吡啶-3-基)-1H-咪唑-5-基)吡啶,2-氯-4-甲氧基-3-(1-(6-(甲基磺醯基)吡啶-3-基)-1H-咪唑-5-基)吡啶,3,4-二氯-5-(1-(6-(甲基磺醯基)吡啶-3-基)-1H-咪唑-5-基)吡啶,2-(甲基磺醯基)-5-(5-(4-丙氧基苯基)-1H-咪唑-1-基)吡啶,5-(5-(3,5-二乙氧基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(5-(4-乙氧基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,2-(甲基磺醯基)-5-(5-(4-硝基苯基)-1H-咪唑-1-基)吡啶,5-(5-(4-(亞甲基磺醯基)苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(5-(4-(乙磺醯基)苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,N,N-二甲基-4-(1-(6-(甲基磺醯基)吡啶-3-基)-1H-咪唑-5-基)苯胺,5-(5-(4-氟苯基)-4-甲基-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-對甲苯基-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(2,4-二氟苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,2-氯-3-(4-氯-1-(6-(甲基磺醯基)吡啶-3-基)-1H-咪唑-5-基)-4-甲氧基吡啶,3,4-二氯-5-(4-氯-1-(6-(甲基磺醯基)吡啶-3-基)-1H-咪唑-5-基)吡啶,5-(4-氯-5-(4-丙氧基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(3,5-二乙氧基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(4-乙氧基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(4-硝基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(4-(甲硫基)苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(4-(乙硫基)苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,3-(4-氯-1-(6-(甲基磺醯基)吡啶-3-基)-1H-咪唑-5-基)-4-乙氧基吡啶,5-(4-溴-5-(4-氟苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(5-(4-氟苯基)-4-甲基-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(3,4-二氯苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(3-氯-4-甲氧基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶。該發明的一個更進一步的優選實施方式中,式(I)的化合物選自:2-(4-氯-5-苯基-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,5-(甲基磺醯基)-2-(5-苯基-1H-咪唑-1-基)吡啶,2-(4-氯-5-(4-氟苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(4-氟苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-對甲苯基-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,5-(甲基磺醯基)-2-(5-對甲苯基-1H-咪唑-1-基)吡啶,2-(4-氯-5-(2,4-二氯苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(2,4-二氯苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(4-甲氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(4-甲氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(3-氟-4-甲氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(3-氟-4-甲氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(吡啶-3-基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,5-(4-氯-5-苯基-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,2-(甲基磺醯基)-5-(5-苯基-1H-咪唑-1-基)吡啶,5-(4-氯-5-(4-甲氧基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(3-氟-4-甲氧基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(吡啶-3-基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(4-氟苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶。該發明的一個更進一步的優選實施方式中,式(I)的化合物選自:2-(4-氯-5-苯基-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,5-(甲基磺醯基)-2-(5-苯基-1H-咪唑-1-基)吡啶,2-(4-氯-5-(4-氟苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(4-氟苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-對甲苯基-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,5-(甲基磺醯基)-2-(5-對甲苯基-1H-咪唑-1-基)吡啶,2-(4-氯-5-(2,4-二氯苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(2,4-二氯苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(4-甲氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(4-甲氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(3-氟-4-甲氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(3-氟-4-甲氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(吡啶-3-基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,5-(4-氯-5-苯基-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(4-甲氧基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(3-氟-4-甲氧基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(4-氟苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶。
該發明還涉及上述發明化合物的鹽、溶劑合物、異構體和前體藥物。所謂前體藥物是指上述式(I)所代表化合物的任何前體,在體內能夠分解和釋放式(I)所代表的化合物。
式(I)所代表的一些化合物是可以存在手性中心的,因此會產生各種立體異構體。該發明也包括這其中的每個立體異構體及其混合物。而且,該發明中的一些化合物可能存在順反異構體。該發明包括其中的每個幾何異構體及其混合物。
該發明還包括藥用組合物,由有效劑量的式(I)化合物或其藥學上可接受的鹽、溶劑合物、異構體或前體藥物加上一個或多個藥用輔料所組成。
該發明還包括式(I)化合物或其藥學上可接受的鹽、溶劑合物、異構體或者前體藥物在製備用於預防或治療動物和人的由環氧化酶,特別是環氧化酶2(COX-2),介導的疾病的藥物中的套用。
該發明還包括式(I)化合物或其藥學上可接受的鹽、溶劑合物、異構體或者前體藥物在製備用於治療動物和人的炎症、疼痛、發燒的藥物中的套用,包括骨關節炎、類風濕關節炎、急性疼痛、圍手術期疼痛、手術後疼痛、腰痛、肩關節周圍炎、頸肩腕症候群、
腱鞘炎 、痛經、牙痛等。
該發明還包括式(I)化合物或其藥學上可接受的鹽、溶劑合物、異構體或者前體藥物在製備用於預防或治療癌症,包括結腸癌、乳腺癌的藥物中的套用。
該發明還包括式(I)化合物或其藥學上可接受的鹽、溶劑合物、異構體或者前體藥物在製備用於預防或治療動物和人的抑鬱症的藥物中的套用。
該發明還包括式(I)化合物或其藥學上可接受的鹽、溶劑合物、異構體或者前體藥物在製備用於預防或治療動物和人的精神分裂症的藥物中的套用。
該發明還包括式(I)化合物或其藥學上可接受的鹽、溶劑合物、異構體或者前體藥物在製備用於預防或治療動物和人的腦梗死、癲癇、神經退行性疾病(如阿爾茲海默氏病和老年痴呆症)、腺瘤息肉尤其是家族性腺瘤直腸息肉的藥物中的套用。
上面所述的動物包括犬科、馬科、貓科、鹿科等,如狗、狼、貓、熊貓、馬、鹿等。
“藥學上可接受的”是指某載體、運載物、稀釋劑、輔料,和/或所形成的鹽通常在化學上或物理上與構成某藥物劑型的其它成分相兼容,並在生理上相兼容。
“鹽”和“可藥用的鹽”是指式(I)所示的化合物或其立體異構體,或其前藥的有機鹽和無機鹽。這些鹽可以是在化合物的最後分離和純化中直接得到的,或者是通過使用合適的有機或無機酸或鹼分別與式(I)所示化合物,或其立體異構體,或其前藥反應,然後分離獲得鹽。常用的鹽包括如氫溴酸鹽、鹽酸鹽、硫酸鹽、硫酸氫鹽、硝酸鹽、醋酸鹽、草酸鹽、苯磺酸鹽、棕櫚酸鹽、硬脂酸鹽、月桂酸鹽、硼酸鹽、苯甲酸鹽、乳酸鹽、磷酸鹽、甲苯磺酸鹽、檸檬酸鹽、馬來酸鹽、延胡索酸鹽、琥珀酸鹽、酒石酸鹽、萘酸鹽、甲磺酸鹽、葡萄糖酸鹽、乳糖酸鹽、十二烷基磺酸鹽以及其它類似鹽。這些鹽可能也包括鹼或鹼土金屬中的陽離子,如鈉、鋰、鉀、鈣、鎂以及其它類似物,以及無毒的銨、季銨和銨陽離子,包括但不限於銨、四甲基銨、四乙銨、甲胺、二甲胺鹽、三甲基胺鹽、三乙胺鹽、乙胺以及其它類似物。其他例子詳見本專利的參考文獻Berge,etal.,J.Pharm.Sci.,66,1-19(1977)。
式(I)所示化合物的鹽可以通過將式(I)所示化合物的溶液與所需酸或鹼適當進行混合而得到。這些鹽可能在溶液中形成沉澱,可以通過過濾而收集,或在溶劑蒸發後回收而得到。
式(I)的化合物可以以非溶劑化形式或者諸如水,乙醇等的可藥用溶劑的溶劑化形式存在,且可預期的是該發明包括所有溶劑化和非溶劑化的形式。
“前藥”是指一種作為藥物前體的化合物,該化合物可在對主體給藥後在體內通過一個化學或生理過程(例如,通過置於生理pH值或通過酶作用)釋放活性藥物。關於前藥的合成與使用的討論,參見T.Higuchi和W.Stella的文章:″Prodrugs as Novel Delivery Systems,”vol.14 of the ACS Symposium Series,and in Bioreversible Carriersin Drug Design,ed.Edward B.Roche,American Pharmaceutical Association and Pergamon Press,1987。這兩篇文章的內容均被引用併入該文中。“前藥”也可包括該發明化合物的代謝前體,該類前藥在對主體給藥時可能不具有活性,但可在體內轉化為該發明的化合物。前藥也可以是天然存在或者化學合成的化合物。
式(I)所示的化合物可以包含不對稱或手性中心,從而以不同的立體異構體形式存在。可預期的是,所有式(I)所示的化合物的立體異構體及其混合物,包括外消旋混合物都是該發明的一部分。另外,也包括所有的幾何異構體和位置異構體。例如:如果式(I)所示的化合物含有雙鍵,則其順式與反式兩種形式及其混合物也都包括在該發明的範圍之內。
非對映異構體混合物可以通過本領域普通技術人員熟知的方法(如色譜法和/或分步結晶法)基於它們的物理化學差異來分離為它們的各個非對映異構體。對映異構體的分離可通過與具有光學活性的化合物反應,將對映異構體混合物轉化成非對映異構體混合物,然後分離非對映異構體,再將單獨的非對映異構體轉化(如水解)成相應的純對映異構體。另外,某些式(I)所示的化合物可以為阻轉異構體(如,取代的聯芳烴),也是該發明中的一部分。
式(I)的化合物還可以作為處於平衡中的互變異構體存在,且所有這些形式都包括在該發明的範圍內。
該發明的一種實施方式中,該發明包括了同位素標記的式(I)化合物,所述同位素標記化合物是指與該文中所列化合物相同,但是其中的一個或多個原子被另一個原子取代,該原子的原子質量或質量數不同於自然界中常見的的原子質量或質量數。可以引入式(I)化合物中的同位素包括包括氫、碳、氮、氧、磷、氟和氯,即H、H、C、C、N、O、O、P、P、S、F和Cl。含有上述同位素和/或其它原子同位素的式(I)的化合物及其立體異構體和前藥,以及該化合物、立體異構體或者前藥的可藥用的鹽均應包含在該發明範圍之內。
某些同位素標記的式(I)化合物,例如那些被如H和C等放射性同位素標記的化合物,可被用作化合物和或底物的組織分布分析中。氚(即H)和碳14(即C)同位素因其相對容易製備和易於檢測而特別優選。另外,一些同位素,如氘代(即H),由於有更好的代謝穩定性(如提高體內半衰期、或者降低給藥劑量)從而提供某些治療優勢,因此,可在某些情況下優選。所述同位素標記的式(I)化合物通常可用本領域普通技術人員已知的方法諸如用同位素標記的試劑替代非同位素標記的試劑來製備。
該發明包括所有上述提到的化合物,尤其是式(I)所示的化合物,其中包括那些獨立存在的或者是任何可兼容的組合。
如上所述,該發明中的化合物主要通過抑制環氧化酶2(COX-2酶)而發揮作用。因此,它們可被用作治療或預防各種疾病或病原體引起的炎症、疼痛和/或者發熱,這些疾病包括:風濕熱、流感或其他病毒感染症狀、感冒、腰頸疼痛、痛經、頭疼、牙疼、肌肉痛、神經痛、滑膜炎、滑液囊炎、關節炎包括類風濕性關節炎及幼年型關節炎、退行性關節疾病包括骨關節炎、強直性脊柱炎、紅斑狼瘡、肌腱炎、扭傷拉傷及其他的損傷(如那些在體育運動中發生的損傷)、外科或牙科手術後的疼痛、癌症疼痛。他們還可用於皮膚炎症的治療,如
牛皮癬 、
濕疹 、燒傷和皮炎。
該發明的化合物還可以用於治療由COX-2酶介導的其他病原體的感染疾病。例如,式(I)化合物能夠抑制細胞增殖,從而可用於癌症的治療或預防,尤其是產生前列腺素或者表達環氧化酶的癌症。該發明的化合物可用於治療,例如,肝癌、膀胱癌、胰腺癌、卵巢癌、前列腺癌、宮頸癌、肺癌、乳腺癌和皮膚癌,特別是消化系統癌症,如結腸癌。
該發明的化合物還能用於治療或預防腦梗死、癲癇、抑鬱、精神分裂症和神經退行性疾病,如阿爾茲海默氏疾病和痴呆。
根據這裡所敘述的產品活性,該發明還包括由該發明中的化合物與賦形劑或者其他必要的輔料組成的組合物。該發明中的化合物可以以任何藥用劑型服用,而正如大家所知道的,以何種劑型主要由給藥途徑和病理所決定。
根據該發明內容,口服固體組合物包括片劑、混懸液、顆粒劑和膠囊。在片劑中,活性成分至少與一種惰性稀釋劑(如乳糖、澱粉、甘露醇、微晶纖維素或磷酸鈣)、粘合劑(如澱粉、凝膠、微晶纖維素或者聚乙烯吡咯烷酮)及
潤滑劑 (如硬脂酸鎂、硬脂酸、滑石粉)混合。片劑可以通過已知技術包衣以延緩其在胃腸道中的崩解和吸收,進而達到緩釋控釋的目的。胃腸衣是用糖、
甘露醇 、
微晶纖維素 、丙烯酸樹脂等製備的。緩釋片劑可能是通過使用產生滲透壓的賦形劑實現的,如半乳糖醛酸聚合物。口服製劑還可能套用可吸收的硬膠囊,如凝膠,其中活性化合物與惰性固體稀釋劑和潤滑劑或者如乙氧基飽和甘油酯的糊狀材料,也能夠產生控釋的作用。也可能套用軟凝膠膠囊,其中活性化合物與水或者油性介質混合,如椰子油、棉花油、液體石蠟或者橄欖油。
通過加入水製備混懸液的粉末和顆粒可以通過將活性化合物與分散劑或濕潤劑、混懸劑及一種或多種防腐劑混合得到,其中混懸劑可能為羧甲基纖維素鈉、甲基纖維素、羥丙基甲基纖維素、藻酸鈉、聚乙烯吡咯烷、黃蓍膠、黃原膠、阿拉伯樹膠,防腐劑可能為對羥基苯甲酸甲酯或丙酯。還可能添加如甜味劑、調味劑和著色劑。
口服液體製劑包括乳劑、混懸液、糖漿和酏劑,通常其中會添加惰性稀釋劑,如蒸餾水、乙醇、山梨醇、甘油或丙二醇。所謂組合物還含有共佐劑,如潤濕劑、混懸劑、甜味劑、調味劑、防腐劑或緩衝液。
根據該發明,注射用注射製劑是由無菌水溶性或非水溶性溶液、混懸液或乳液溶於合適的無毒溶劑或稀釋液中組成的。水溶性溶劑或混懸介質可以是注射用蒸餾水、格林溶液和氯化鈉等滲溶液。而非水溶性溶劑或混懸介質可以是丙二醇、聚乙二醇、蔬菜油(如橄欖油)、或醇(如乙醇)。這些組分也可以與濕潤劑、防腐劑、乳化劑和分散劑聯合使用。它們可以通過任何已知的方法進行滅菌,或者製備成無菌固體組成,並可以在使用前在水中或任何其他無菌可注射的介質中溶解。它也可能直接用無菌的原材料製成,並在整個生產過程中保證無菌。
給藥劑量及給藥次數主要取決於動物和人的種類,以及所治療疾病的性質和嚴重性、患者的年齡和體重,以及給藥途徑。通常來說,成年動物或成人的每天用量在1毫克到1000毫克之間,可以是一次給藥或多次給藥。但是,對於特殊病例,也可能需要超出上述範圍。該專業的技術人員將會根據每個病例的具體情況而決定合適的劑量。
該發明的另一個目的是提供式(I)所代表化合物的製備工藝。式(I)所代表化合物可以根據下面反應方程式和討論來製備。除非特別說明,下面反應方程式及討論中,當R代表氫原子、鹵素或者C1-5 烷基時,包括以下步驟:R,R、R、R、R、R、X、Y即為上述定義的基團。
當R代表氫原子或者C1-5 烷基時,包括以下步驟:
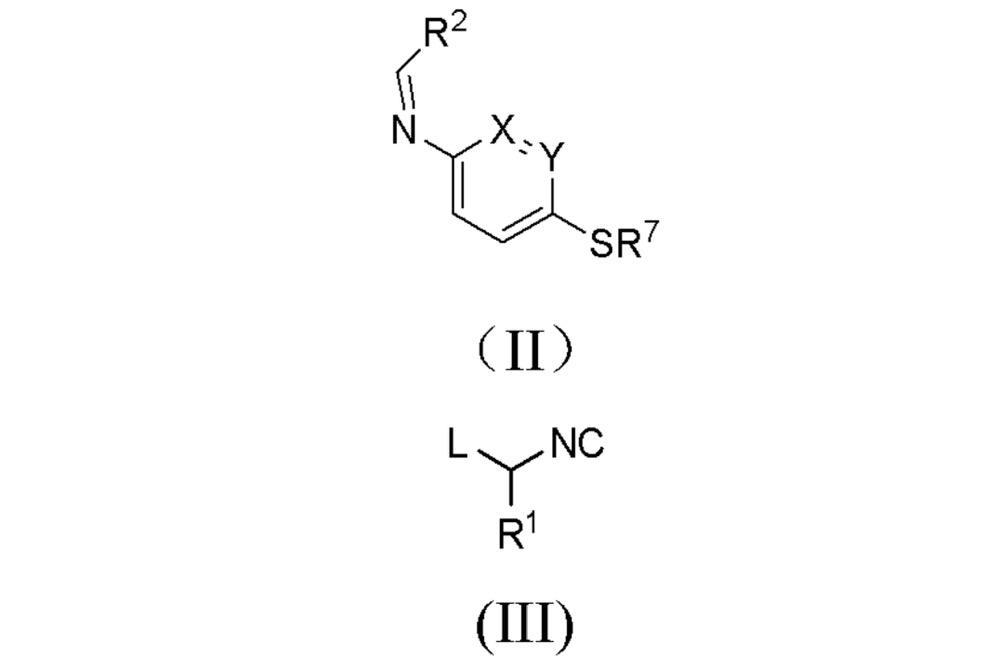
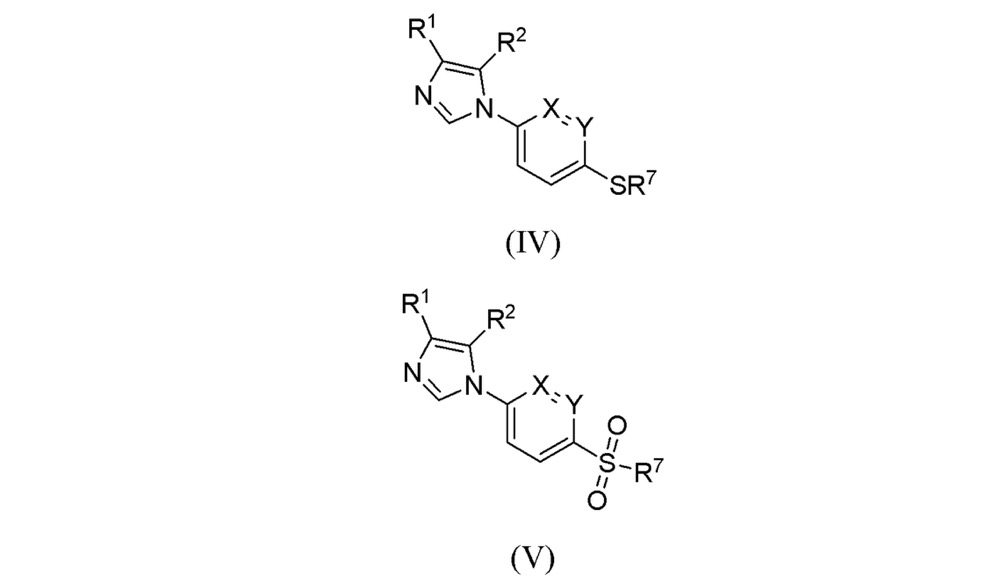
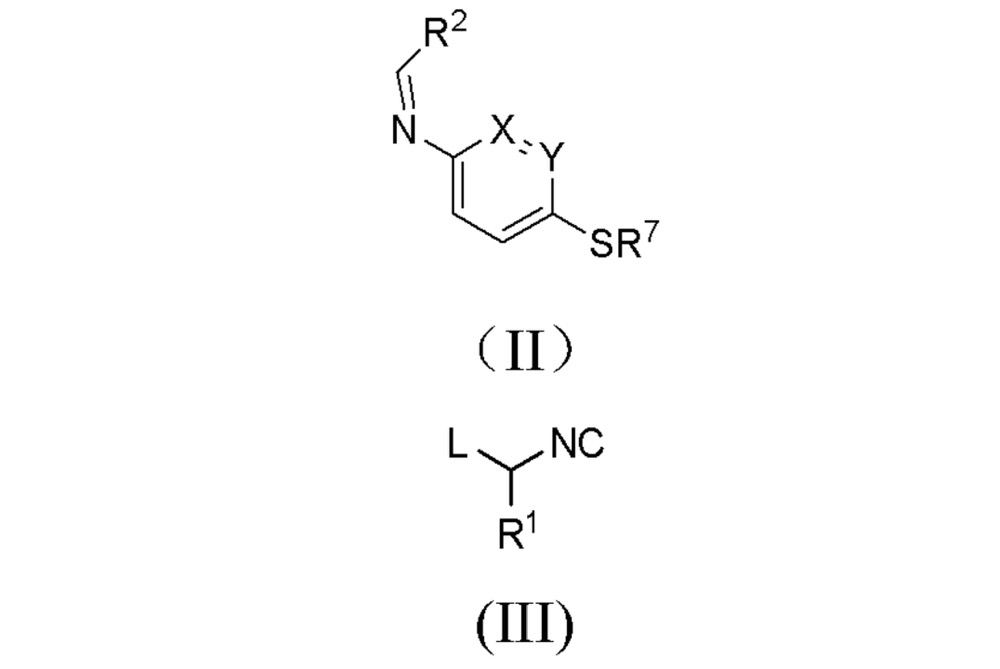
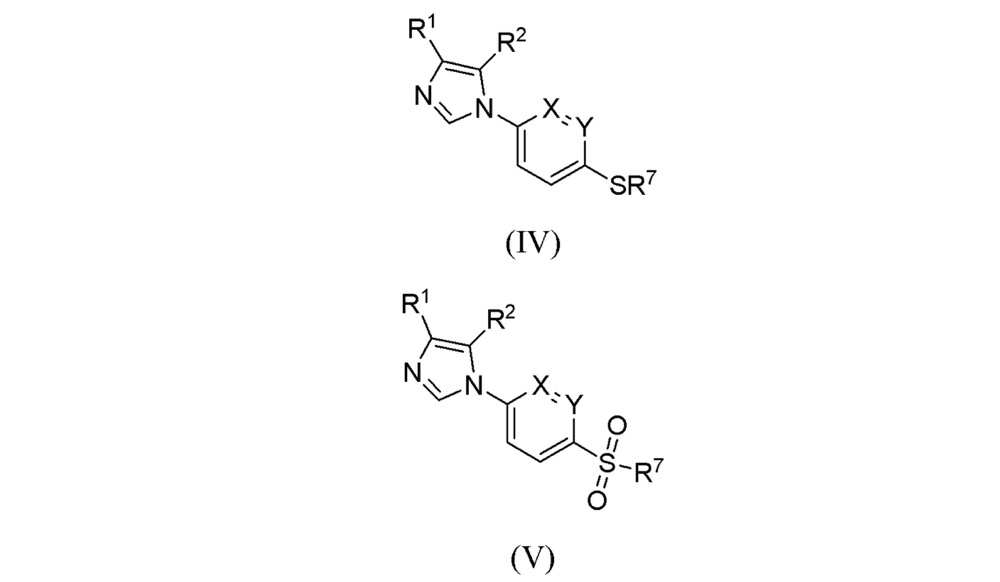
a)用通式II所代表的亞胺與通式III所代表的異腈反應,得到化合物式(IV),其中式(II)中的X、Y、R和R即為上述定義的基團,其中式(III)中的L代表一個離去基團;
化學結構式 b)氧化式(IV)所代表的硫醚轉化為化合物式(V),
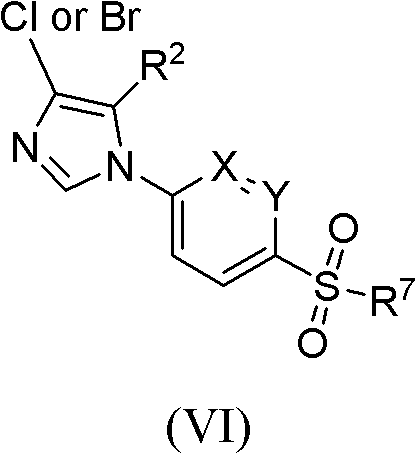
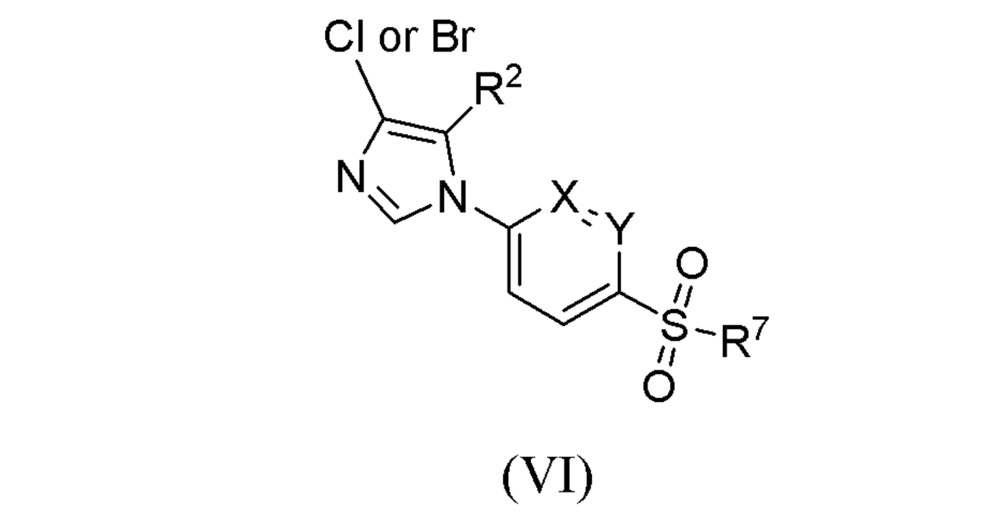
化學結構式 當R代表鹵素時,可先通過上述步驟中R代表氫原子時得到化合物式(V),然後再進一步通過與鹵代試劑反應而轉化成化合物式(VI)。
化學結構式 對於該專業技術人員顯而易見的是,化合物的確切製備方法是可根據化學結構而略有不同的。而且,在下面所闡述的多數製備過程中,利用常規的的保護基團來保護不穩定或活潑基團是必要的。上述保護基團的性質,以及它們引入或去除的製備方法都是公開的技術。(實例見GreeneT.W.“有機合成中的保護基團”,JohnWiley&Sons,紐約,1981)
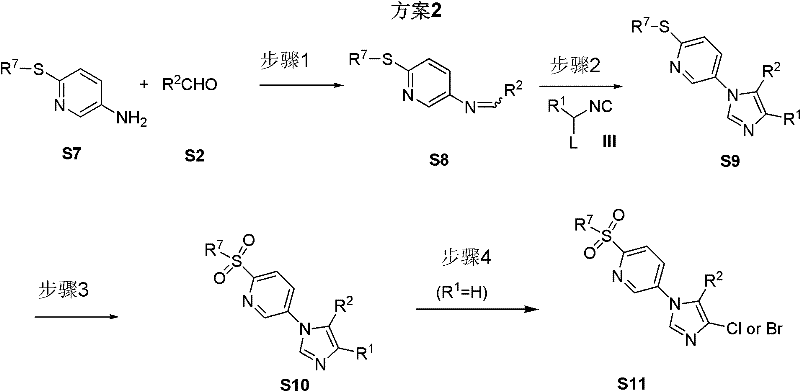
以下列舉了具體製備方法,包括方案1和方案2,如下:
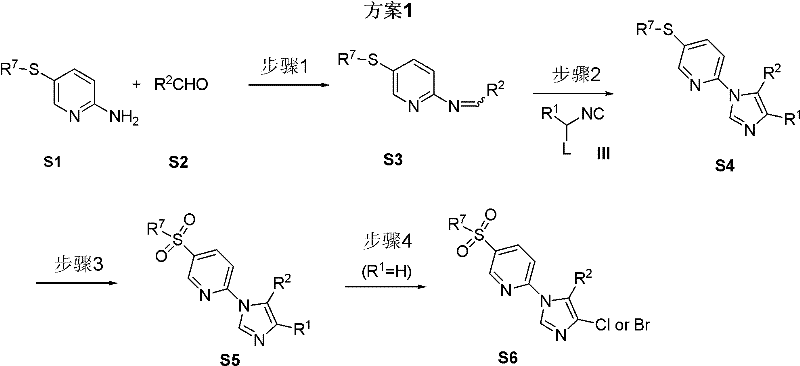
製備步驟 方案1闡明了一種合成式(I)所代表化合物的方法。根據上述方案1,化合物式(S3)是通過化合物式(S1)和化合物式(S2)在惰性溶劑中縮合反應而得到的。該反應中所適用的溶劑包括醇(如甲醇、乙醇、丙醇),醚(如1,2-二甲氧基乙烷、1,2-二乙氧基乙烷、THF、DMF),或者是上述醇及醚的混合物。該反應可以在化學當量或催化量的路易氏酸存在下進行。該反應通常在0℃到100℃下進行,優選條件為50-80℃下反應10-30個小時。
化合物式(S4)是通過化合物式(S3)和化合物式(III)在惰性溶劑中反應得到的,其中L代表離去基團,例如:對甲苯磺醯基等。適用於該反應的溶劑有醇(如甲醇、乙醇、丙醇),醚(如1,2-二甲氧基乙烷、1,2-二乙氧基乙烷、THF、DMF),或者是上述醇及醚的混合物。該反應可以在化學當量或催化量的K2 CO3 、Na2 CO3 的存在下進行。該反應通常在0℃到100℃下進行,回流反應時間優選10-30個小時。
化合物式(S5)可以通過化合物式(S4)與氧化試劑在惰性溶劑中反應得到。該反應中所用的最佳溶劑為二氯甲烷。該反應中所使用的最佳氧化劑為MCPBA(間氯過氧苯甲酸)。該反應通常在-20℃到40℃下進行,優選反應溫度為0℃。
當取代基R為氫原子時,化合物式(S5)可通過與鹵代試劑反應而轉化成化合物式(S6)。優選的鹵代試劑為NCS(N-氯代丁二醯亞胺)。該反應可以在化學當量或催化量的催化劑存在下進行,如AIBN(偶氮二異丁腈)。該反應通常在0℃到100℃下進行,優選為50-80℃,反應10-30個小時。
製備步驟 方案2闡明了另一種合成式(I)所代表化合物的方法。根據上述方案2,化合物式(S8)是通過化合物式(S7)和化合物式(S2)在惰性溶劑中縮合反應而得到的。該反應中所適用的溶劑包括醇(如甲醇、乙醇、丙醇),和醚(如1,2-二甲氧基乙烷、1,2-二乙氧基乙烷、THF、DMF),或者是上述醇及醚的混合物。該反應可以在化學當量或催化量的路易氏酸存在下進行。該反應通常在0℃到100℃下進行,優選條件為為50-80℃,反應10-30個小時。
化合物式(S9)是通過化合物式(S8)和化合物式(III)在惰性溶劑中反應得到的。其中L代表離去基團,例如:對甲苯磺醯基等。適用於該反應中的溶劑包括醇(如甲醇、乙醇、丙醇),醚(如1,2-二甲氧基乙烷、1,2-二乙氧基乙烷、THF、DMF),或者是上述醇及醚的混合物。該反應可以在化學當量或催化量的K2 CO3 、Na2 CO3 的存在下進行。該反應通常在0℃到100℃下進行,回流反應時間優選10-30個小時。
化合物式(S10)可以通過化合物式(S9)與氧化試劑在惰性溶劑中反應得到。該反應中所用的優選溶劑為二氯甲烷。該反應中所使用的最佳氧化劑為MCPBA(間氯過氧苯甲酸)。該反應通常在-20℃到40℃下進行,反應溫度優選為0℃。
當取代基R為氫原子時,化合物式(S10)可通過與鹵代試劑反應而轉化成化合物式(S11)。最佳的鹵代試劑為NCS(氯代丁二醯亞胺)。該反應可以在化學當量或催化量的催化劑存在下進行,如AIBN(偶氮二異丁腈)。該反應通常在該反應通常在0℃到100℃下進行,優選反應溫度為50-80℃,反應10-30個小時。
技術領域 《咪唑衍生物、製備方法及用途》涉及一類新的咪唑衍生物及其藥物組合物在環氧化酶相關疾病治療中的套用。該發明中的化合物能夠抑制環氧化酶,干擾體內花生四烯酸向前列腺素的生物轉化,因此,可以用於治療和緩解動物和人的炎症及由炎症引發的各種疾病,如關節炎、神經退化性疾病、抑鬱症、神經分裂症疾病和哺乳動物結腸癌,以及人結腸癌。
權利要求 1.式(I)所示的化合物或其藥學上可接受的鹽,溶劑合物、異構體或前藥,其中:
化學結構式 X=N,Y=C,或者Y=N,X=C原子;取代基R代表氫原子、C1-5 烷基、鹵素;取代基R代表被一個或多個基團獨立地取代的芳基或雜芳基,其中取代基團選自鹵素、C1-8 烷基、ROC0-8 烷基、RSC0-8 烷基、氰基、硝基、-NRR、-NRSO2 R、-SOR、-SO2 R;取代基R代表、-SO2 R、-SR基;取代基R代表氫原子、C1-8 烷基、C1-8 鹵代烷基;取代基R代表C1-8 烷基;取代基R代表C1-8 烷基;取代基R代表C1-8 烷基。
2.權利要求1所述的化合物或其藥學上可接受的鹽,其特徵在於:X=N,Y=C,或者Y=N,X=C原子;取代基R代表氫原子、C1-5 烷基、鹵素;取代基R代表被一個或多個基團獨立地取代的芳基或雜芳基,其中取代基團選自鹵素、C1-8 烷基、ROC0-8 烷基、RSC0-8 烷基硝基、-NRR-SOR、-SO2 R;取代基R代表-SR、-SO2 R基;取代基R代表氫原子、C1-8 烷基、C1-8 鹵代烷基;取代基R代表C1-8 烷基。
3.權利要求2所述的化合物或其藥學上可接受的鹽,溶劑合物、異構體或前藥,其特徵在於:X=N,Y=C,或者Y=N,X=C原子;取代基R代表氫原子、C1-3 烷基、鹵素;取代基R代表被一個或多個基團獨立地取代的苯基或吡啶基,其中取代基團選自鹵素、C1-5 烷基、ROC0-5 烷基、RSC0-5 烷基、硝基、-NRR、-SOR;取代基R代表氫原子、C1-5 烷基、C1-5 鹵代烷基;取代基R代表C1-5 烷基;取代基R代表C1-5 烷基;取代基R代表C1-5 烷基。
4.權利要求3所述的化合物或其藥學上可接受的鹽,其特徵在於:X=N,Y=C,或者Y=N,X=C原子;取代基R代表氫原子、C1-3 烷基、鹵素;取代基R代表被一個或多個基團獨立地取代的苯基或吡啶基,其中取代基團選自鹵素、C1-4 烷基、ROC0-4 烷基、RSC0-4 烷基、硝基、-NRR、-SOR;取代基R代表氫原子、C1-4 烷基、C1-4 鹵代烷基;取代基R代表C1-4 烷基;取代基R代表C1-4 烷基;取代基R代表C1-4 烷基。
5.權利要求4所述的化合物或其藥學上可接受的鹽,其特徵在於:X=N,Y=C,或者Y=N,X=C原子;取代基R代表氫原子、氯原子、溴原子、C1-3 烷基;取代基R代表被一個或多個基團獨立地取代的苯基或吡啶基,其中取代基團選自鹵素、C1-3 烷基、ROC0-4 烷基、RSC0-4 烷基、硝基、-SOR;取代基R代表氫原子、C1-4 烷基、C1-4 鹵代烷基;取代基R代表C1-3 烷基。
6.權利要求5所述的化合物或其藥學上可接受的鹽,其特徵在於:X=N,Y=C,或者Y=N,X=C原子;取代基R代表氫原子、氯原子、甲基;取代基R代表被一個或多個基團獨立地取代的苯基或吡啶基,其中取代基團選自鹵素、C1-3 烷基、C1-3 烷氧基、RSC0-4 烷基、硝基、-SOR;取代基R代表C1-3 烷基、C1-3 鹵代烷基;取代基R代表甲基。
7.權利要求6所述的化合物或其藥學上可接受的鹽,其特徵在於所述的化合物選自:2-(4-氯-5-苯基-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,5-(甲基磺醯基)-2-(5-苯基-1H-咪唑-1-基)吡啶,2-(4-氯-5-(4-氟苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(4-氟苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-對甲苯基-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,5-(甲基磺醯基)-2-(5-對甲苯基-1H-咪唑-1-基)吡啶,2-(4-氯-5-(2,4-二氯苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(2,4-二氯苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(4-甲氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(4-甲氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(3-氟-4-甲氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(3-氟-4-甲氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(吡啶-3-基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,5-(4-氯-5-苯基-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,2-(甲基磺醯基)-5-(5-苯基-1H-咪唑-1-基)吡啶,5-(4-氯-5-(4-甲氧基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(3-氟-4-甲氧基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(吡啶-3-基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(4-氟苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,2-(4-氯-5-(3-氯-4-甲氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(3-氟苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(3-氟-4-甲基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(2-氟苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(2,4-二氟苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(2,4-二氯苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(3-氟苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(3-氟-4-甲基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(2-氟苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,5-(甲基磺醯基)-2-(5-(4-(三氟甲氧基)苯基)-1H-咪唑-1-基)吡啶,4-甲基-3-(1-(5-(甲基磺醯基)吡啶-2基)-1H-咪唑-5-基)吡啶,2-(5-(2-氟-4-甲氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(3-氯-4甲基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(3-甲氧基-4-甲基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(4-氯苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,4-氯-3-(1-(5-(甲基磺醯基)吡啶-2基)-1H-咪唑-5-基)吡啶,2,4-二氯-3-(1-(5-(甲基磺醯基)吡啶-2基)-1H-咪唑-5-基)吡啶,2-(5-(2-氯-4甲氧基吡啶-3-基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,3,4-二氯-5-(1-(5-(甲基磺醯基)吡啶-2基)-1H-咪唑-5-基)吡啶,5-(甲基磺醯基)-2-(5-(4-丙氧基苯基)-1H-咪唑-1-基)吡啶,2-(5-(3,5-二乙氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(4-乙氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,5-(甲基磺醯基)-2-(5-(4-硝基苯基)-1H-咪唑-1-基)吡啶,2-(5-(4-(亞甲基磺醯基)苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(4-(亞乙磺醯基)苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,N,N-二甲基-4-(1-(5-(甲基磺醯基)吡啶-2基)-1H-咪唑-5-基)苯胺,2-(5-(4-氟苯基)-4-甲基-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(2,4-二氟苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(2-氯-4甲氧基吡啶-3-基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,3,4-二氯-5-(4-氯-1-(5-(甲基磺醯基)吡啶-2基)-1H-咪唑-5-基)吡啶,2-(4-氯-5-(4-丙氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(3,5-二乙氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(4-乙氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(4-硝基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(4-(甲硫基)苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(4-(乙硫基)苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(4-乙氧基吡啶-3-基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-溴-5-(4-氟苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(4-氟苯基)-4-甲基-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(4-(三氟甲氧基)苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(3,4-二氯苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,5-(4-氯-5-(3-氟苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(3-氟-4-甲基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(2-氟苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(4-(三氟甲氧基)苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(5-(4-氟苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,2-(甲基磺醯基)-5-(5-對甲苯基-1H-咪唑-1-基)吡啶,5-(5-(2,4-二氟苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(5-(2,4-二氯苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(5-(4-甲氧基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(5-(3-氟-4-甲氧基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(5-(3-氟苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(5-(3-氟-4-甲基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(5-(2-氟苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,2-(甲基磺醯基)-5-(5-(4-(三氟甲氧基)苯基)-1H-咪唑-1-基)吡啶,4-甲基-3-(1-(6-(甲基磺醯基)吡啶-3-基)-1H-咪唑-5-基)吡啶,5-(5-(2-氟-4-甲氧基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(5-(3-氯-4甲基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(5-(3-甲氧基-4-甲基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(5-(4-氯苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(5-(4-氯吡啶-3-基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,2,4-二氯-3-(1-(6-(甲基磺醯基)吡啶-3-基)-1H-咪唑-5-基)吡啶,2-氯-4-甲氧基-3-(1-(6-(甲基磺醯基)吡啶-3-基)-1H-咪唑-5-基)吡啶,3,4-二氯-5-(1-(6-(甲基磺醯基)吡啶-3-基)-1H-咪唑-5-基)吡啶,2-(甲基磺醯基)-5-(5-(4-丙氧基苯基)-1H-咪唑-1-基)吡啶,5-(5-(3,5-二乙氧基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(5-(4-乙氧基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,2-(甲基磺醯基)-5-(5-(4-硝基苯基)-1H-咪唑-1-基)吡啶,5-(5-(4-(亞甲基磺醯基)苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(5-(4-(乙磺醯基)苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,N,N-二甲基-4-(1-(6-(甲基磺醯基)吡啶-3-基)-1H-咪唑-5-基)苯胺,5-(5-(4-氟苯基)-4-甲基-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-對甲苯基-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(2,4-二氟苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,2-氯-3-(4-氯-1-(6-(甲基磺醯基)吡啶-3-基)-1H-咪唑-5-基)-4-甲氧基吡啶,3,4-二氯-5-(4-氯-1-(6-(甲基磺醯基)吡啶-3-基)-1H-咪唑-5-基)吡啶,5-(4-氯-5-(4-丙氧基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(3,5-二乙氧基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(4-乙氧基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(4-硝基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(4-(甲硫基)苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(4-(乙硫基)苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,3-(4-氯-1-(6-(甲基磺醯基)吡啶-3-基)-1H-咪唑-5-基)-4-乙氧基吡啶,5-(4-溴-5-(4-氟苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(5-(4-氟苯基)-4-甲基-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(3,4-二氯苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(3-氯-4-甲氧基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶。
8.權利要求7所述的化合物或其藥學上可接受的鹽,其特徵在於所述的化合物選自:2-(4-氯-5-苯基-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,5-(甲基磺醯基)-2-(5-苯基-1H-咪唑-1-基)吡啶,2-(4-氯-5-(4-氟苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(4-氟苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-對甲苯基-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,5-(甲基磺醯基)-2-(5-對甲苯基-1H-咪唑-1-基)吡啶,2-(4-氯-5-(2,4-二氯苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(2,4-二氯苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(4-甲氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(4-甲氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(3-氟-4-甲氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(3-氟-4-甲氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(吡啶-3-基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,5-(4-氯-5-苯基-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,2-(甲基磺醯基)-5-(5-苯基-1H-咪唑-1-基)吡啶,5-(4-氯-5-(4-甲氧基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(3-氟-4-甲氧基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(吡啶-3-基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(4-氟苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶。
9.權利要求8所述的化合物或其藥學上可接受的鹽,溶劑合物、異構體或前藥,其特徵在於所述的化合物選自:2-(4-氯-5-苯基-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,5-(甲基磺醯基)-2-(5-苯基-1H-咪唑-1-基)吡啶,2-(4-氯-5-(4-氟苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(4-氟苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-對甲苯基-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,5-(甲基磺醯基)-2-(5-對甲苯基-1H-咪唑-1-基)吡啶,2-(4-氯-5-(2,4-二氯苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(2,4-二氯苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(4-甲氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(4-甲氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(3-氟-4-甲氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(5-(3-氟-4-甲氧基苯基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,2-(4-氯-5-(吡啶-3-基)-1H-咪唑-1-基)-5-(甲基磺醯基)吡啶,5-(4-氯-5-苯基-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(4-甲氧基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(3-氟-4-甲氧基苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶,5-(4-氯-5-(4-氟苯基)-1H-咪唑-1-基)-2-(甲基磺醯基)吡啶。
10.權利要求1-9任一式(I)所示的化合物或其藥學上可接受的鹽,溶劑合物、異構體或前藥的製備工藝,其中所述的化合物的製備工藝包括如下步驟:當R代表氫原子或者C1-5 烷基時,包括以下步驟:
a)用通式II所代表的亞胺與通式III所代表的異腈反應,得到化合物式(IV),其中式(II)中的X、Y、R和R與權利要求1-10中的定義相同,其中式(III)中的L代表一個離去基團;
化學結構式 b)氧化式(IV)所代表的硫醚轉化為化合物式(V),
化學結構式 其中R,R,X和Y與權利要求1-9中的定義相同;當R代表鹵素時,可先通過上述步驟中R代表氫原子時得到化合物式(V),然後再進一步通過與鹵代試劑反應而轉化成化合物式(VI)。
化學結構式 11.權利要求1-9任一所述化合物,或其藥學上可接受的鹽、溶劑合物、異構體或者前體藥物在製備用於治療或預防環氧化酶介導疾病的藥物中的套用。
12.權利要求11所述的套用,其中所述的環氧化酶為環氧化酶-2。
13.權利要求1-9任一所述化合物,或其藥學上可接受的鹽、溶劑合物、異構體或者前體藥物在製備用於治療或預防動物或人的炎症、疼痛和/或者發熱的藥物中的套用。
14.權利要求13所述的套用,其中所述的套用為骨關節炎、類風濕關節炎、
肩周炎 、急性疼痛、圍手術期疼痛、手術後疼痛、腰痛、頸肩腕症候群、
腱鞘炎 、痛經。
15.權利要求1-9任一所述化合物,或其藥學上可接受的鹽、溶劑合物、異構體或者前體藥物在製備用於治療或預防動物或人的
抑鬱症 、精神分裂症、癌症、腦梗死、癲癇、神經退行性疾病、腺瘤息肉的藥物中的套用。
16.權利要求15所述的套用,其中所述的癌症為
結腸癌 、乳腺癌;所述的神經退行性疾病為阿爾茲海默氏病、老年痴呆症;所述的腺瘤息肉為家族性腺瘤直腸息肉。
17.一種藥物組合物,其含有有效劑量的權利要求1-9任一所述化合物,或其藥學上可接受的鹽、溶劑合物、異構體或者前體藥物,和一個或多個可藥用輔料。
18.權利要求17所述的藥物組合物,為片劑、膠囊劑或注射劑。
實施方式 產品說明 toluenesulfonylmethyl isocyanide
meta-chloro peroxybenzoic acid
以下列舉了實施例1~7的製備方法,但不應理解為對《咪唑衍生物、製備方法及用途》的限制。
表1列舉了實施例1-7中的化合物結構式及化學名稱,結構確證數據見表2:
表1:實施例1-7的結構式及化學名稱
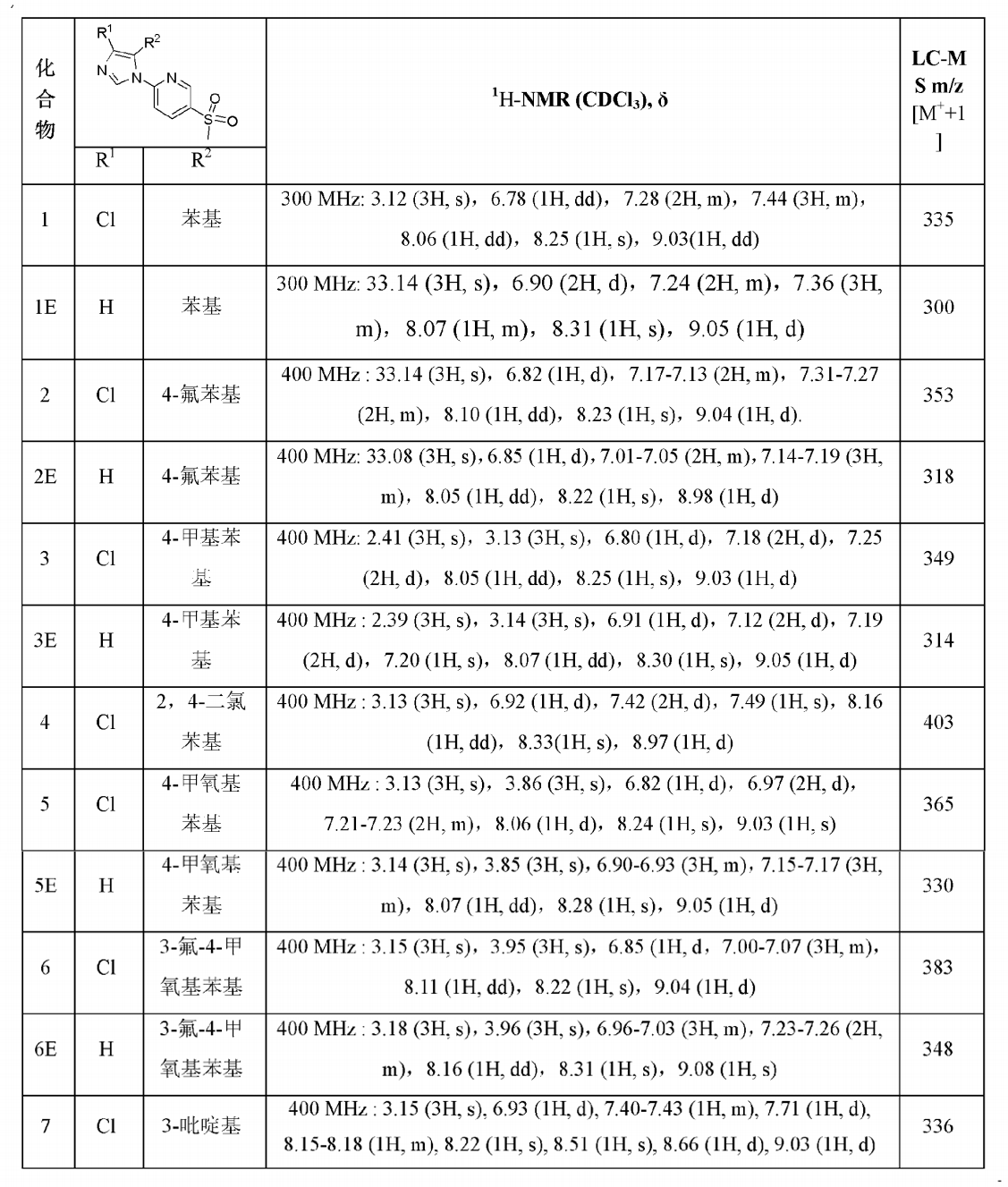
表2:實施例1-7的結構確證數據 實施例1~7的合成路線如下圖所示:
實施例1~7的合成路線 步驟A.化合物5-(甲硫基)-2-硝基吡啶的製備(化合物1A)
在5-氯-2-硝基吡啶(300克)的甲醇(4000毫升)溶液中,將甲硫化鈉(150克)的甲醇(2000毫升)溶液逐滴加入,並保持反應溫度低於0℃。滴加完畢後,反應物升至室溫,攪拌過夜。除去反應混合物的溶劑,然後在殘留物中加入5升水,用乙酸乙酯進行萃取。有機層用飽和食鹽水洗滌,無水硫酸鈉乾燥。過濾,減壓濃縮後得到黃色固體的目標化合物(270克)。H-NMR(300MHz,CDCl3 )δ2.61(3H,s),7.73(1H,dd),8.18(1H,d),8.40(1H,d).LC-MSm/z:171[M+1]。
步驟B.化合物5-(甲硫基)-2-氨基吡啶的製備(化合物1B)
將5-(甲硫基)-2-硝基吡啶(270克)、鐵粉(600克)、乙酸(500毫升)及水(2升)一起加熱回流反應4個小時。然後將飽和的碳酸氫鈉溶液(6升)加入到反應混合物。過濾反應液,並用乙酸乙酯萃取濾液。有機相用飽和食鹽水洗滌,無水硫酸鈉乾燥。過濾後,減壓去除殘留溶液以得到目標化合物(185克)。H-NMR(300MHz,CDCl3 ):δ2.39(3H,s),4.49(2H,brs),6.47(1H,d),7.50(1H,dd),8.11(1H,d)。LC-MSm/z:141[M+1]。
步驟C.化合物N-亞苄基-5-(甲硫基)吡啶-2-胺的製備(化合物1C)
將5-(甲硫基)-2-氨基吡啶(185克)溶於2升四氫呋喃,然後加入500毫升鈦酸四異丙酯和苯甲醛(155克)。反應液加熱回流過夜,然後冷卻到室溫,加入10升水。反應混合物用乙酸乙酯萃取,有機相用飽和食鹽水洗滌,無水硫酸鈉乾燥。過濾後,減壓去除殘留溶劑以得到目標化合物(200克)。
步驟D.化合物5-(甲硫基)-2-(5-苯基-1H-咪唑-1-基)吡啶的製備(化合物1D)
將N-亞苄基-5-(甲硫基)吡啶-2-胺(200克)、對甲苯磺醯甲基異腈(255克)、碳酸鉀(255克)、甲醇(3升)和乙二醇二甲醚(2升)一起回流反應過夜。反應物冷卻至室溫,並加入10升水,用乙酸乙酯萃取。有機相用飽和食鹽水洗滌,無水硫酸鈉乾燥,過濾,減壓去除溶劑。粗產物用柱層析純化而得到棕色固體的目標化合物(118克,產率50%)。H-NMR(300MHz,CDCl3 ):δ2.52(3H,s),6.74-6.77(1H,dd),7.18-7.22(3H,m),7.30-7.33(3H,m),7.45-7.48(1H,dd),8.05-8.05(1H,d),8.38-8.39(1H,d)。LC-MSm/z:268[M+1]。
步驟E.化合物5-(甲磺醯基)-2-(5-苯基-1H-咪唑-1-基)吡啶的製備(化合物1E)
將間氯過氧苯甲酸(230克)和5-(甲硫基)-2-(5-苯基-1H-咪唑-1-基)吡啶(118克)溶於3升二氯甲烷中,在0℃下攪拌反應2小時。反應結束後,加入1000毫升飽和Na2 S2 O3 溶液。混合液用二氯甲烷萃取,有機相用飽和食鹽水洗滌,無水硫酸鈉乾燥。過濾濃縮後,粗品用柱層析純化而得到目標化合物(50克)。H-NMR(300MHz,CDCl3 ):δ3.14(3H,s),6.90(1H,d),7.24(3H,m),7.39(3H,m),8.06(1H,dd),8.30(1H,s),9.05(1H,d);LC-MSm/z:300[M+1],純度(HPLC)>95%。
步驟F.化合物2-(4-氯-5-苯基-1H-咪唑-1-基)-5-(甲磺醯基)吡啶的製備(化合物1)
將5-(甲基磺醯基)-2-(5-苯基-1H-咪唑-1-基)吡啶(50克),N-氯琥珀醯亞胺(20克)偶氮二異丁腈(500毫克)溶於3升四氯甲烷中,一起回流反應過夜。將反應混合液冷卻至室溫,並且減壓去除殘留溶劑。粗品經柱層析純化得到目標化合物(15克)。H-NMR(300MHz,CDCl3 ):δ3.12(3H,s),6.78(1H,dd),7.28(2H,m),7.44(3H,m),8.06(1H,dd),8.25(1H,s),9.03(1H,dd);LC-MSm/z:335[M+1],純度(HPLC)>95%。
步驟A、步驟B同實施例1。
步驟C.化合物2C的合成:化合物1B(340毫克,2.4毫摩爾)溶於(20毫升)THF中,然後分別加入4-氟苯甲醛(301毫克,2.4毫摩爾),Ti(OiPr)4 (2.1毫升)。反應液加熱回流兩天。冷卻至室溫,將反應液倒入飽和NaHCO3 溶液中。混合物用乙酸乙酯萃取,有機層用飽和食鹽水洗滌,無水硫酸鈉乾燥,過濾,濃縮後的產品2C(678毫克,粗品)不純化直接用於下一步反應。
步驟D.化合物2D的合成:化合物2C(678毫克,4.2毫摩爾)溶於(10毫升)DMF中,加入TosMIC(806毫克,4.2毫摩爾),K2 CO3 (951毫克,7.0毫摩爾)的(25毫升)甲醇溶液。混合物加熱回流2天。冷卻至室溫後,反應液倒入水中。用乙酸乙酯萃取。有機層用飽和食鹽水洗滌,無水硫酸鈉乾燥。過濾後,溶劑蒸乾得到的粗品用矽膠柱純化,得到黃色固體化合物2D(160毫克,20%)。H-NMR(400MHz,CDCl3 ):δ2.51(3H,s),6.75(1H,d),7.21(1H,d),7.26-7.29(3H,m),7.40(1H,s),7.48-7.51(1H,m),8.16(1H,d),8.30(1H,d);LC-MS:286[M+1]。
步驟E.化合物2E的合成:化合物2D(160毫克,0.56毫摩爾)溶於(20毫升)DMF中,在-20℃下加入mCPBA(430毫克,2.8毫摩爾)的DMF(10毫升)溶液,反應液在-20℃攪拌5小時,反應結束後,-20℃下加入(30毫升)飽和Na2 S2 O3 水溶液。混合液用DCM(2×50毫升)萃取,有機層用飽和食鹽水洗滌,無水硫酸鈉乾燥。過濾。旋乾溶劑後得到黃色固體化合物2E(192毫克,粗品),不經過純化直接用於下一步反應。H-NMR(400MHz,CDCl3 ):δ3.08(3H,s),6.85(1H,d,7.01-7.05(2H,m),7.14-7.19(3H,m),8.05(1H,dd),8.22(1H,s),8.98(1H,d);LC-MS:318[M+1]。
步驟F.化合物2的合成:化合物2E的粗品(192毫克,0.56毫摩爾)溶於DCM(10毫升)中,然後加入NCS(112毫克,0.84毫摩爾)和AIBN(5.0毫克)的吡啶(10毫升)溶液。混合液室溫攪拌過夜。過濾。溶劑蒸乾後,粗品用矽膠柱純化得到化合物2(42毫克,21%)。H-NMR(400MHz,CDCl3 ):δ3.14(3H,s),6.82(1H,d),7.17-7.13(2H,m),7.31-7.27(2H,m),8.10(1H,dd),8.23(1H,s),9.04(1H,d)。純度(HPLC)>95%,LC-MS:353[M+1]。
步驟A、步驟B同實施例1。
步驟C.化合物3C的合成:化合物1B(490毫克,3.5毫摩爾)溶於THF(30毫升)中,分別加入4-甲基苯甲醛(420毫克,3.5毫摩爾)和Ti(OiPr)4 (5.2毫升)。混合液加熱回流1天,冷至室溫後倒入飽和NaHCO3 水溶液中。混合液用乙酸乙酯萃取,有機層用飽和食鹽水洗滌,無水硫酸鈉乾燥。過濾。溶劑蒸乾後得到化合物3C(110克,粗品),不經過純化直接用於下一步反應。
步驟D.化合物3D的合成:化合物3C(800毫克,3.0毫摩爾)溶於DME(10毫升)中,加入TosMIC(780毫克,4.5毫摩爾),K2 CO3 (1.00克,7.5毫摩爾)的MeOH(25毫升)溶液。混合液加熱回流1天。冷卻至室溫後,反應液倒入水中。混合液用乙酸乙酯萃取,有機層用飽和食鹽水洗滌,無水硫酸鈉乾燥,過濾。蒸除溶劑後的粗品經過矽膠柱純化,得到黃色固體化合物3D(100毫克,12%)。H-NMR(400MHz,CDCl3 ):δ2.36(3H,s),2.53(3H,s),6.76(1H,d),7.07-7.18(5H,m),7.46-7.49(1H,m),8.05(1H,s),8.39(1H,d);LC-MS:282[M+1]。
步驟E.化合物3E的合成:化合物3D(100毫克,0.36毫摩爾)溶於(20毫升)DMF中,在-20℃下加入mCPBA(300毫克,1.8毫摩爾)的DMF(10毫升)溶液,反應液在-20℃攪拌5小時,反應結束後,-20℃下加入(30毫升)飽和Na2 S2 O3 水溶液。混合液用DCM(2×50毫升)萃取,有機層用飽和食鹽水洗滌,無水硫酸鈉乾燥。過濾。旋乾溶劑後得到黃色油狀化合物3E(70毫克,粗品,62%),不經過純化直接用於下一步反應。H-NMR(400MHz,CDCl3 ):δ2.39(3H,s),3.14(3H,s),6.91(1H,d),7.12(2H,d),7.19(2H,d),7.20(1H,s),8.07(1H,dd),8.30(1H,s),9.05(1H,d);LC-MS:314[M+1]。
步驟F.化合物3的合成:化合物3E(70毫克,0.22毫摩爾)溶於DCM(10毫升)中,然後加入NCS(32毫克,0.25毫摩爾)和AIBN(5.0毫克)的吡啶(10毫升)的吡啶溶液,混合液室溫攪拌過夜。溶劑蒸乾後,粗品用矽膠柱純化得到化合物3(19毫克,25%)。H-NMR(400MHz,CDCl3 ):δ2.41(3H,s),3.13(3H,s),6.80(1H,d),7.18(2H,d),7.25(2H,d),8.05(1H,dd),8.25(1H,s),9.03(1H,d).純度HPLC>95%,LC-MS:349[M+1]。
步驟A、步驟B同實施例1。
步驟C.化合物4C的合成:化合物1B(340毫克,2.4毫摩爾)溶於THF(30毫升)中,分別加入2,4-二氯苯甲醛(425毫克,2.4毫摩爾)和Ti(OiPr)4 (2.2毫升)。混合液加熱回流兩天,冷至室溫後倒入飽和NaHCO3 水溶液中。混合液用乙酸乙酯萃取,有機層用飽和食鹽水洗滌,無水硫酸鈉乾燥。過濾。溶劑蒸乾後得到化合物4C(738毫克,粗品),不經過純化直接用於下一步反應。
步驟D.化合物4D的合成:化合物4C(738毫克,2.5毫摩爾)溶於DME(10毫升)中,加入TosMIC(727毫克,3.8毫摩爾),K2 CO3 (857毫克,7.5毫摩爾)的MeOH(25毫升)溶液。混合液加熱回流1天。冷卻至室溫後,反應液倒入水中。混合液用乙酸乙酯萃取,有機層用飽和食鹽水洗滌,無水硫酸鈉乾燥,過濾。蒸除溶劑後的粗品經過矽膠柱純化,得到黃色固體化合物4D(467毫克,56%)。H-NMR(400MHz,CDCl3 ):δ3.13(3H,s),6.97(1H,d),7.23-7.26(2H,d),7.37(1H,s),7.44(1H,s),8.15(1H,dd),8.37(1H,s),8.96-8.97(1H,d);LC-MS:336[M+1]。
步驟E.化合物4E的合成:化合物4D(450毫克,1.30毫摩爾)溶於(20毫升)DMF中,在-20℃下加入mCPBA(1.20克,6.5毫摩爾)的DMF(10毫升)溶液,反應液在-20℃攪拌5小時,反應結束後,-20℃下加入(30毫升)飽和Na2 S2 O3 水溶液。混合液用DCM(2×50毫升)萃取,有機層用飽和食鹽水洗滌,無水硫酸鈉乾燥。過濾。旋乾溶劑後得到黃色油狀化合物4E(234毫克,48%),不經過純化直接用於下一步反應。LC-MS:368[M+1]。
步驟F.化合物4的合成:化合物4E(234毫克粗品,0.64毫摩爾)溶於DCM(10毫升)中,然後加入NCS(127毫克,0.96毫摩爾)和AIBN(5.0毫克)的吡啶(10毫升)溶液。混合液室溫攪拌過夜。溶劑蒸乾後,粗品用矽膠柱純化(PE/EA=1:1)得到化合物4(16毫克,6%)。H-NMR(400MHz,CDCl3 ):δ3.13(3H,s),6.92(1H,d),7.42(2H,d),7.49(1H,s),8.16(1H,dd),8.33(1H,s),8.97(1H,d)。純度(HPLC)>95%,LC-MS:403[M+1]。
步驟A、步驟B同實施例1。
步驟C.化合物5C的合成:化合物1B(560毫克,4.0毫摩爾)溶於(30毫升)THF中,然後分別加入4-甲氧基苯甲醛(540毫克,4.0毫摩爾),Ti(OiPr)4 (2.9毫升)。反應液加熱回流1天。冷卻至室溫,將反應液倒入飽和NaHCO3 溶液中。混合物用乙酸乙酯萃取,有機層用飽和食鹽水洗滌,無水硫酸鈉乾燥,過濾,濃縮後的產品5C(1.01克,粗品)不經過純化直接用於下一步反應。
步驟D.化合物5D的合成:化合物5C(1.01克,4.0毫摩爾)溶於(10毫升)DMF中,加入TosMIC(1.2克,6.0毫摩爾),K2 CO3 (1.4克,10毫摩爾)的(25毫升)甲醇溶液。混合物加熱回流1天。冷卻至室溫後,將反應液倒入水中。用乙酸乙酯萃取。有機層用飽和食鹽水洗滌,無水硫酸鈉乾燥。過濾。溶劑蒸乾後得到的粗品用矽膠柱純化,得到黃色固體化合物5D(170毫克,14%)。LC-MS:298[M+1]。
步驟E.化合物5E的合成:化合物5D(170毫克,0.57毫摩爾,1.0eq)溶於(20毫升)DMF中,在-20℃下加入mCPBA(492毫克,2.9毫摩爾)的DMF(10毫升)溶液,反應液在-20℃攪拌5小時,反應結束後,-20℃下加入(30毫升)飽和Na2 S2 O3 水溶液。混合液用DCM(2×50毫升)萃取,有機層用飽和食鹽水洗滌,無水硫酸鈉乾燥。過濾。旋乾溶劑後得到黃色油狀化合物5E(70毫克,37%),不經過純化直接用於下一步反應。H-NMR(400MHz,CDCl3 ):δ3.14(3H,s),3.85(3H,s),6.90-6.93(3H,m),7.15-7.17(3H,m),8.07(1H,dd),8.28(1H,s),9.05(1H,d);LC-MS:330[M+1]。
步驟F.化合物5的合成:化合物5E(70毫克粗品,0.22毫摩爾)溶於DCM(10毫升)中,然後加入NCS(42毫克,0.96毫摩爾)和AIBN(5.0毫克)的吡啶(10毫升)溶液。混合液室溫攪拌過夜。溶劑蒸乾後,粗品用矽膠柱純化得到化合物5(12毫克,16%)。H-NMR(400MHz,CDCl3 ):δ3.13(3H,s),3.86(3H,s),6.82(1H,d),6.97(2H,d),7.21-7.23(2H,m),8.06(1H,d),8.24(1H,s),9.03(1H,s).純度(HPLC)>95%,LC-MS:365[M+1]。
步驟A、步驟B同實施例1。
步驟C.化合物6C的合成:化合物1B(560毫克,4.0毫摩爾)溶於THF(30毫升)中,分別加入3-氟-4-甲氧基苯甲醛(620毫克,4.0毫摩爾和Ti(OiPr)4 (3.5毫升)。混合液加熱回流1天,冷至室溫後倒入飽和NaHCO3 水溶液中。混合液用乙酸乙酯萃取,有機層用飽和食鹽水洗滌,無水硫酸鈉乾燥。過濾。溶劑蒸乾後得到化合物6C(1.10克,粗品),不經過純化直接用於下一步反應。
步驟D.化合物6D的合成:化合物6C(1.10克,4.0毫摩爾)溶於DME(10毫升)中,加入TosMIC(1.2克,6.0毫摩爾),K2 CO3 (1.4克,10毫摩爾)的MeOH(25毫升)溶液。混合液加熱回流1天。冷卻至室溫後,反應液倒入水中。混合液用乙酸乙酯萃取,有機層用飽和食鹽水洗滌,無水硫酸鈉乾燥,過濾。蒸除溶劑後的粗品經過矽膠柱純化,得到黃色固體化合物6D(140毫克,11%)。LC-MS:316[M+1]。
步驟E.化合物6E的合成:化合物6D(140毫克,0.45毫摩爾)溶於(20毫升)DMF中,在-20℃下加入mCPBA(380毫克,2.2毫摩爾)的DMF(10毫升)溶液,反應液在-20℃攪拌5小時,反應結束後,-20℃下加入(30毫升)飽和Na2 S2 O3 水溶液。混合液用DCM(2×50毫升)萃取,有機層用飽和食鹽水洗滌,無水硫酸鈉乾燥。過濾。旋乾溶劑後得到黃色油狀化合物6E(70毫克,37%),不經過純化直接用於下一步反應。H-NMR(400MHz,CDCl3 ):δ3.18(3H,s),3.96(3H,s),6.96-7.03(3H,m),7.23-7.26(2H,m),8.16(1H,dd),8.31(1H,s),9.08(1H,s);LC-MS:348[M+1]。
步驟F.化合物6的合成:化合物6E(70毫克粗品,0.20毫摩爾)溶於DCM(10毫升)中,然後加入NCS(29毫克,0.22毫摩爾)和AIBN(5.0毫克)的吡啶(10毫升)溶液。混合液室溫攪拌過夜。溶劑蒸乾後,粗品用矽膠柱純化(得到化合物6(22毫克,29%)。H-NMR(400MHz,CDCl3 ):δ3.15(3H,s),3.95(3H,s),6.85(1H,d),7.00-7.07(3H,m),8.11(1H,dd),8.22(1H,s),9.04(1H,d).純度(HPLC)>95%,LC-MS:383[M+1]。
步驟A、步驟B同實施例1。
步驟C.化合物7C的合成:化合物1B(400毫克,3.0毫摩爾)溶於THF(30毫升)中,分別加入3-吡啶甲醛(306毫克,3.0毫摩爾)和Ti(OiPr)
4 (2.5毫升)。混合液加熱回流1天,冷至室溫後倒入飽和NaHCO
3 水溶液中。混合液用乙酸乙酯萃取,有機層用飽和食鹽水洗滌,
無水硫酸鈉 乾燥。過濾。溶劑蒸乾後得到化合物7C(797毫克,粗品),不經過純化直接用於下一步反應。
步驟D.化合物7D的合成:化合物7C(797毫克,3.5毫摩爾)溶於DME(10毫升)中,加入TosMIC(1.02克,5.2毫摩爾)和K2 CO3 (1.20克,8.8毫摩爾)的MeOH(25毫升)溶液。混合液加熱回流2天。冷卻至室溫後,反應液倒入水中。混合液用乙酸乙酯萃取,有機層用飽和食鹽水洗滌,無水硫酸鈉乾燥,過濾。蒸除溶劑後的粗品經過矽膠柱純化,得到黃色固體化合物7D(151毫克,16%)。H-NMR(400MHz,CDCl3 ):δ2.46(3H,s),6.80(1H,d),7.19-7.23(2H,m),7.43-7.49(2H,m),7.97(1H,s),8.29-8.30(1H,m),8.40(1H,s),8.45-8.47(1H,m);LC-MS:269[M+1]。
步驟E.化合物7E的合成:化合物7D(151毫克,0.56毫摩爾)溶於(20毫升)DMF中,在-20℃下加入mCPBA(485毫克,2.8毫摩爾)的DMF(10毫升)溶液,反應液在-20℃攪拌5小時,反應結束後,-20℃下加入(30毫升)飽和Na2 S2 O3 水溶液。混合液用DCM(2×50毫升)萃取,有機層用飽和食鹽水洗滌,無水硫酸鈉乾燥。過濾。旋乾溶劑後得到黃色油狀化合物7E(94毫克,粗品),不經過純化直接用於下一步反應。LC-MS:301[M+1]。
步驟F.化合物7的合成:化合物7E(94毫克粗品,0.31毫摩爾)溶於DCM(10毫升)中,然後加入NCS(63毫克,0.47毫摩爾)和AIBN(5.0毫克)的吡啶(10毫升)溶液。混合液室溫攪拌過夜。溶劑蒸乾後,過濾。粗品用矽膠柱純化得到化合物7(24毫克,23%)。H-NMR(400MHz,CDCl3 ):δ3.15(3H,s),6.93(1H,d),7.40-7.43(1H,m),7.71(1H,d),8.15-8.18(1H,m),8.22(1H,s),8.51(1H,s),8.66(1H,d),9.03(1H,d).純度(HPLC)>95%,LC-MS:336[M+1]。
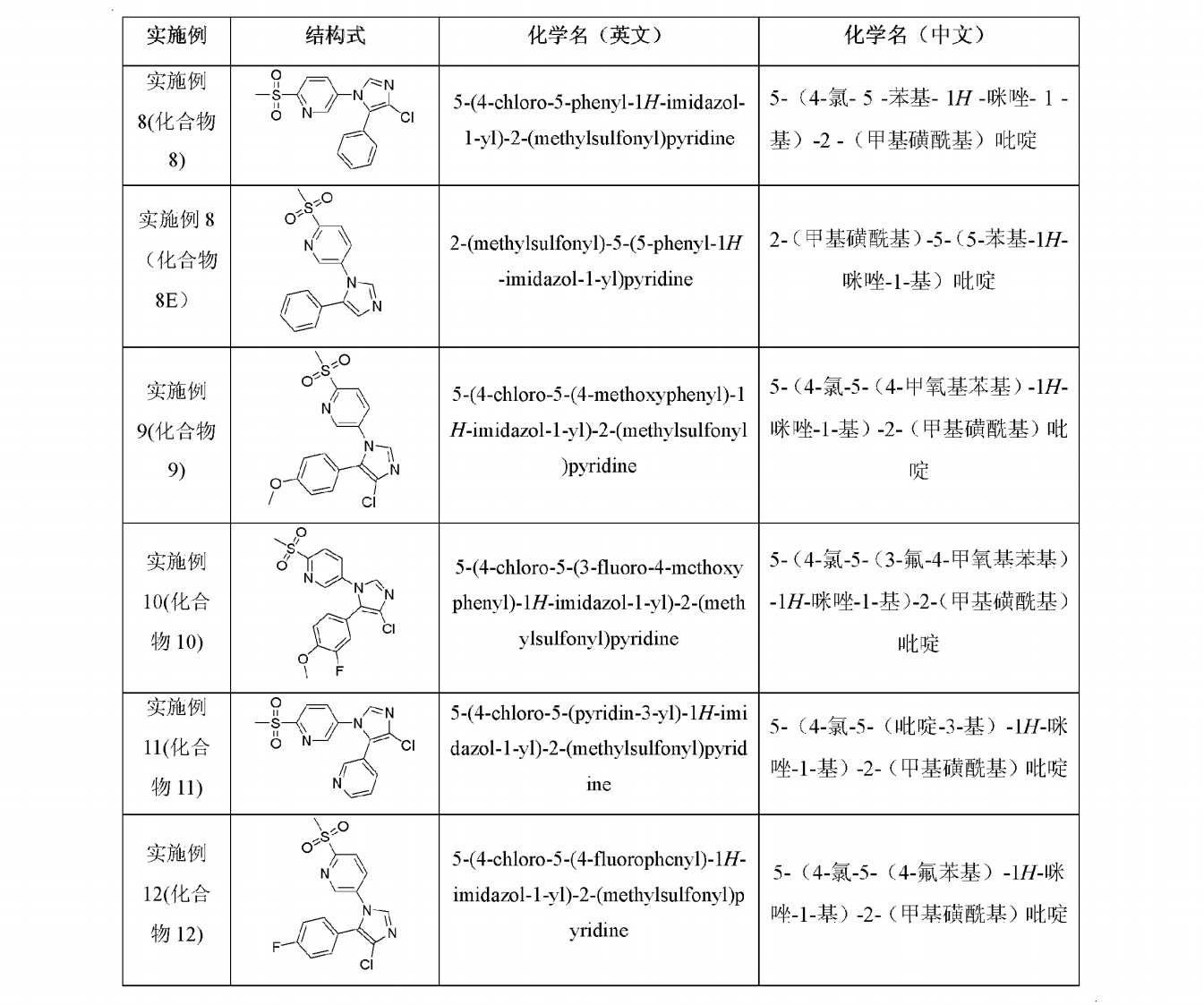
以下列舉了實施例8~12的製備方法,但不應理解為對該發明的限制。實施例8-12中的化合物的結構式及化學名稱見表3,結構確證數據見表4:
表3:實施例8-12的結構式及化學名稱
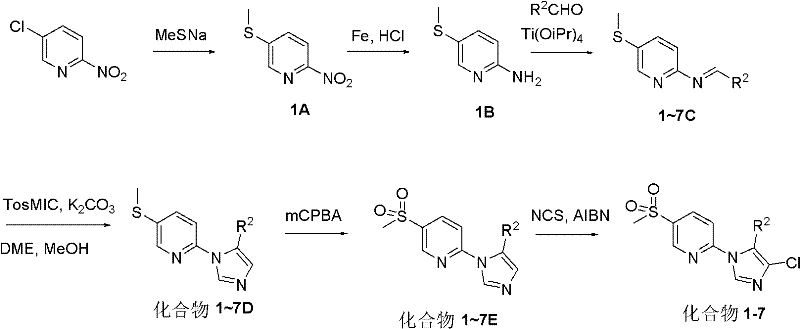
表4:實施例8-12的結構確證數據 實施例8~12的合成路線如下式所示:
實施例8~12的合成路線 步驟A.化合物2-(甲硫基)-5-硝基吡啶的製備(化合物8A)
在0℃下,將甲硫化鈉(6克,86毫摩爾)的甲醇溶液分批加入到2-氯-5-硝基吡啶(2克,13毫摩爾)的甲醇溶液中。然後,將反應混合液升至室溫,攪拌14小時。反應液中倒入20毫升水中,用乙酸乙酯20毫升萃取3次。合併有機相,無水硫酸鈉乾燥,過濾濃縮。殘留物在乙醚中重結晶,從而得到黃色固體2-(甲硫基)-5-硝基吡啶(2克,12毫摩爾)。H-NMR(300MHz,CDCl3 ):δ2.64(3H,s),7.28-7.32(1H,m),9.24(1H,dd),9.26(1H,d);LC-MSm/z:171[M+1];純度(HPLC)>95%。
步驟B.化合物2-(甲硫基)-5-氨基吡啶的製備(化合物8B)
將3克鐵粉、20毫升水和3毫升濃鹽酸混合,然後分批加入2-(甲硫基)-5-硝基吡啶(2克,12毫摩爾)。回流反應2小時後,反應混合液用1N氫氧化鈉鹼化,並用20毫升乙酸乙酯萃取3次。合併的有機相用無水硫酸鈉乾燥,過濾濃縮得到目標化合物(1.54克,11毫摩爾)。
步驟C.化合物N-亞苄基-6-(甲硫基)吡啶-3-胺的製備(化合物8C)
將2-(甲硫基)-5-氨基吡啶(1克,7毫摩爾)、苯甲醛(0.76克,7毫摩爾)、鈦酸四異丙酯(3毫升)和四氫呋喃(25毫升)混合,70℃下攪拌反應24小時。在反應後混合液中加入飽和碳酸鈉溶液,並用20毫升乙酸乙酯萃取3次。合併的有機相用無水硫酸鈉乾燥,過濾濃縮得1.72克殘留物,不需純化,可直接用於下步反應。
步驟D.化合物2-(甲硫基)-5-(5-苯基-1H-咪唑-1-基)吡啶的製備(化合物8D)
將N-亞苄基-6-(甲硫基)吡啶-3-胺(1.72克,上步反應所得)、對甲基苯磺醯甲基異腈(2.2克,11毫摩爾),碳酸鈉(2.1克,16毫摩爾),甲醇(50毫升)和乙二醇二甲醚(20毫升)混合,70℃下攪拌反應3小時。向反應混合液中加入100毫升水用,乙酸乙酯100毫升萃取3次。合併的有機相用無水硫酸鈉乾燥,過濾濃縮。殘留物用柱層析純化(石油醚/乙酸乙酯=10/1)得到白色固體的目標化合物(500毫克,2毫摩爾)。
步驟E.化合物2-(甲磺醯基)-5-(5-苯基-1H-咪唑-1-基)吡啶的製備(化合物8E)
將2-(甲硫基)-5-(5-苯基-1H-咪唑-1-基)吡啶(250毫克,0.94毫摩爾)溶於5毫升二氯甲烷中,在0℃下,逐滴加入間氯過氧苯甲酸(742毫克,4.3毫摩爾)的二氯甲烷(5毫升)。反應混合液室溫下攪拌反應1.5小時。20毫升二氯甲烷稀釋反應混合液,用飽和Na2 S2 O3 水溶液洗2次,有機相用無水硫酸鈉乾燥,過濾並濃縮。粗產物以柱層析(石油醚/乙酸乙酯=20:1)純化得到白色固體目標化合物(100毫克,0.33毫摩爾)。H-NMR(300MHz,CDCl3 ):δ3.27(3H,s),7.12-7.15(2H,m),7.26(1H,s),7.33-7.36(4H,m),7.71(1H,dd),7.80(1H,s),8.12(1H,dd);LC-MSm/z:300[M+1];純度(HPLC)>95%。
步驟F.化合物5-(4-氯-5-苯基-1H-咪唑-1-基)-2-(甲磺醯基)吡啶的製備(化合物8)
將2-(甲基磺醯基)-5-(5-苯基-1H-咪唑-1-基)吡啶(83毫克,0.28毫摩爾)、N-氯琥珀醯亞胺(39毫克,0.29毫摩爾)、偶氮二異丁腈(2毫克)和四氫呋喃(10毫升)加入25毫升圓底燒瓶中,攪拌回流反應18個小時。反應後溶液減壓濃縮,粗產品用柱層析(石油醚/乙酸乙酯=20:1)純化得到白色固體的目標化合物(56毫克,0.17毫摩爾)。H-NMR(300MHz,CDCl3 ):δ3.26(3H,s),7.19-7.22(2H,m),7.38-7.40(3H,m),7.66(1H,dd),7.71(1H,s),8.11(1H,dd),8.58(1H,dd);LC-MSm/z:335[M+1];純度(HPLC)>95%。
步驟A、B同實施例8。
步驟C.化合物9C的合成:化合物8B(560毫克,4.0毫摩爾)溶於THF(30毫升)中,然後分別加入4-甲氧基苯甲醛(550毫克,4.0毫摩爾),Ti(OiPr)4 (3.6毫升)。反應液加熱回流2天。冷卻至室溫,將反應液倒入飽和NaHCO3 溶液中。混合物用乙酸乙酯萃取,有機層用飽和食鹽水洗滌,無水硫酸鈉乾燥,過濾,濃縮後的產品9C(1.10克,粗品)不經過純化直接用於下一步反應。
步驟D.化合物9D的合成:化合物9C(1.10克,3.5毫摩爾)溶於(10毫升)DMF中,加入TosMIC(1.02克,5.2毫摩爾),K2 CO3 (1.40克,10毫摩爾)的(25毫升)甲醇溶液。混合物加熱回流2天。冷卻至室溫後,將反應液倒入水中。用乙酸乙酯萃取。有機層用飽和食鹽水洗滌,無水硫酸鈉乾燥。過濾。溶劑蒸乾後得到的粗品用矽膠柱純化,得到黃色固體化合物9D(400毫克,33%)。LC-MS:298[M+1]。
步驟E.化合物9E的合成:化合物9D(400毫克,1.40毫摩爾)溶於(20毫升)DMF中,在-20℃下加入mCPBA(1.2克,6.7毫摩爾)的DMF(10毫升)溶液,反應液在-20℃攪拌5小時,反應結束後,-20℃下加入(30毫升)飽和Na2 S2 O3 水溶液。混合液用DCM(2×50毫升)萃取,有機層用飽和食鹽水洗滌,無水硫酸鈉乾燥。過濾。旋乾溶劑後得到黃色油狀化合物9E(93毫克,21%),不經過純化直接用於下一步反應。LC-MS:330[M+1]。
步驟F.化合物9的合成:化合物9E的粗品(93毫克,0.28毫摩爾)溶於DCM(10毫升)中,然後加入NCS(41毫克,0.31毫摩爾)和AIBN(5.0毫克)的吡啶(10毫升)溶液。混合液室溫攪拌過夜。溶劑蒸乾後,粗品用矽膠柱純化得到化合物化合物9(30毫克,29%)。H-NMR(400MHz,CDCl3 ):δ3.26(3H,s),3.83(3H,s),6.90(2H,d),7.11(2H,d),7.63-7.66(1H,m),7.68(1H,s),8.10(1H,d),8.56(1H,d);純度(HPLC)>95%,LC-MS:365[M+1]。
步驟A、B同實施例8。
步驟C.化合物10C的合成:化合物8B(420毫克,3.0毫摩爾)溶於THF(30毫升)中,分別加入3-氟-4-甲氧基苯甲醛(460毫克,3.0毫摩爾)和Ti(OiPr)4 (2.6毫升)。混合液加熱回流1天,冷至室溫後倒入飽和NaHCO3 水溶液中。混合液用乙酸乙酯萃取,有機層用飽和食鹽水洗滌,無水硫酸鈉乾燥。過濾。溶劑蒸乾後得到化合物10C(0.80克,粗品),不經過純化直接用於下一步反應。
步驟D.化合物10D的合成:化合物10C(0.72克,2.6毫摩爾)溶於DME(10毫升)中,加入TosMIC(0.76克,3.9毫摩爾),K2 CO3 (0.9克,6.5毫摩爾)的MeOH(25毫升)溶液。混合液加熱回流1天。冷卻至室溫後,反應液倒入水中。混合液用乙酸乙酯萃取,有機層用飽和食鹽水洗滌,無水硫酸鈉乾燥,過濾。蒸除溶劑後的粗品經過矽膠柱純化,得到黃色固體化合物10D(580毫克,71%)。H-NMR(400MHz,CDCl3 ):δ2.58(3H,s),3.88(3H,s),6.85-6.90(3H,m),7.20-7.24(3H,m),7.65(1H,m),8.36(1H,d);LC-MS:316[M+1]。
步驟E.化合物10E的合成:化合物10D(580毫克,1.90毫摩爾)溶於(20毫升)DMF中,在-20℃下加入mCPBA(1.6克,6.3毫摩爾)的DMF(10毫升)溶液,反應液在-20℃攪拌5小時,反應結束後,-20℃下加入(30毫升)飽和Na2 S2 O3 水溶液。混合液用DCM(2×50毫升)萃取,有機層用飽和食鹽水洗滌,無水硫酸鈉乾燥。過濾。旋乾溶劑後得到黃色油狀化合物10E(140毫克,22%),不經過純化直接用於下一步反應。LC-MS:348[M+1]。.
步驟F.化合物10的合成:化合物10D的粗品(140毫克,0.40毫摩爾)溶於DCM(10毫升)中,然後加入NCS(60毫克,0.66毫摩爾)和AIBN(5.0毫克)的吡啶(10毫升)溶液。混合液室溫攪拌過夜。溶劑蒸乾後,粗品用矽膠柱純化得到化合物10(75毫克,50%)。H-NMR(400MHz,CDCl3 ):δ3.27(3H,s),3.91(3H,s),6.84(1H,d),6.93-7.02(2H,m),7.66-7.68(2H,m),8.12(1H,d),8.56(1H,d純度(HPLC)>95%,LC-MS:383[M+1]。
步驟A、B同實施例8。
步驟C.化合物11C的合成:化合物8B(420毫克,3.0毫摩爾)溶於THF(30毫升)中,分別加入3-吡啶甲醛(320毫克,3.0毫摩爾)和Ti(OiPr)4 (2.2毫升)。混合液加熱回流1天,冷至室溫後倒入飽和NaHCO3 水溶液中。混合液用乙酸乙酯萃取,有機層用飽和食鹽水洗滌,無水硫酸鈉乾燥。過濾。溶劑蒸乾後得到化合物11C(0.73克,粗品),不經過純化直接用於下一步反應。
步驟D.化合物11D的合成:化合物11C(0.73克,3.0毫摩爾)溶於DME(10毫升)中,加入TosMIC(0.88克,4.5毫摩爾)和K2 CO3 (1.0克,7.5毫摩爾)的MeOH(25毫升)溶液。混合液加熱回流1天。冷卻至室溫後,反應液倒入水中。混合液用乙酸乙酯萃取,有機層用飽和食鹽水洗滌,無水硫酸鈉乾燥,過濾。蒸除溶劑後的粗品經過矽膠柱純化,得到黃色固體化合物11D(570毫克,71%).H-NMR(400MHz,CDCl3 ):δ2.51(3H,s),7.13-7.20(4H,m),7.34-7.37(1H,m),7.67(1H,s),8.30(1H,d),8.41(1H,d),8.45(1H,dd);LC-MS:269[M+1]。
步驟E.化合物11E的合成:化合物11D(570毫克,2.1毫摩爾)溶於(20毫升)DMF中,在-20℃下加入mCPBA(1.8克,10毫摩爾)的DMF(10毫升)溶液,反應液在-20℃攪拌5小時,反應結束後,-20℃下加入(30毫升)飽和Na2 S2 O3 水溶液。混合液用DCM(2×50毫升)萃取,有機層用飽和食鹽水洗滌,無水硫酸鈉乾燥。過濾。蒸乾溶劑後得到黃色油狀化合物11E(550毫克,粗品),不經過純化直接用於下一步反應。LC-MS:301[M+1]。
步驟F.化合物11的合成:化合物11E(550毫克,1.8毫摩爾)溶於DCM(10毫升)中,然後加入NCS(270毫克,2.0毫摩爾)和AIBN(50毫克)的吡啶(10毫升)溶液。混合液室溫攪拌過夜。溶劑蒸乾後,粗品用矽膠柱純化得到化合物11(69毫克,33%).H-NMR(400MHz,CDCl3 ):δ3.27(3H,s),7.35-7.38(2H,m),7.57-7.60(1H,m),7.67-7.74(1H,m),8.14(1H,d),8.46(1H,d),8.58(1H,d),8.62(1H,d).純度(HPLC)>95%,LC-MS:336[M+1]。
步驟A、B同實施例8。
步驟C.化合物12C的合成:化合物8B(420毫克,3.0毫摩爾)溶於THF(30毫升)中,然後分別加入4-甲氧基苯甲醛(370毫克,3.0毫摩爾),Ti(OiPr)4 (3.6毫升)。反應液加熱回流1天。冷卻至室溫,將反應液倒入飽和NaHCO3 溶液中。混合物用乙酸乙酯萃取,有機層用飽和食鹽水洗滌,無水硫酸鈉乾燥,過濾,濃縮後的產品12C(0.80克,粗品)不經過純化直接用於下一步反應。
步驟D.化合物12D的合成:化合物12C(800毫克,3.2毫摩爾)溶於(10毫升)DMF中,加入TosMIC(0.95克,4.9毫摩爾),K2 CO3 (1.1克,8.1毫摩爾)的(25毫升)甲醇溶液。混合物加熱回流1天。冷卻至室溫後,將反應液倒入水中。用乙酸乙酯萃取。有機層用飽和食鹽水洗滌,無水硫酸鈉乾燥。過濾。溶劑蒸乾後得到的粗品用矽膠柱純化,得到黃色固體化合物12D(745毫克,80%).H-NMR(400MHz,CDCl3 ):δ2.61(3H,s),7.03-7.05(2H,m),7.13-7.15(2H,m),7.22-7.27(3H,m),7.70(1H,s),8.38(1H,d);LC-MS:286[M+1]。
步驟E.化合物12E的合成:化合物12D(740毫克,2.6毫摩爾)溶於(20毫升)DMF中,在-20℃下加入mCPBA(2.3克,13毫摩爾)的DMF(10毫升)溶液,反應液在-20℃攪拌5小時,反應結束後,-20℃下加入(30毫升)飽和Na2 S2 O3 水溶液。混合液用DCM(2×50毫升)萃取,有機層用飽和食鹽水洗滌,無水硫酸鈉乾燥。過濾。旋乾溶劑後得到黃色油狀化合物12E(140毫克,17%),不經過純化直接用於下一步反應。LC-MS:318[M+1]。
步驟F.化合物12的合成:化合物12E(140毫克,0.44毫摩爾)溶於DCM(10毫升)中,然後加入NCS(80毫克,0.66毫摩爾)和AIBN(10毫克)的吡啶(10毫升)溶液。混合液室溫攪拌過夜。溶劑蒸乾後,粗品用矽膠柱純化得到化合物12(32毫克,20%).H-NMR(400MHz,CDCl3 ):δ3.26(3H,s),7.08-7.12(2H,m),7.17-7.21(2H,m),7.65(1H,dd),7.70(1H,s),8.12(1H,d),8.56(1H,d);純度(HPLC)>95%;LC-MS:353[M+1]。
以下化合物也在該發明要求保護的範圍內,可根據上述實施例1的合成方法製備,但不應理解為對該發明的限制,也可採用其它合成方法製備。其結構式和化學名稱見表5:
以下化合物也在該發明要求保護的範圍內,可根據上述實施例8的合成方法製備,但不應理解為對該發明的限制,也可採用其它合成方法製備。其結構式和化學名稱見表6:
該發明中的化合物活性可以用下面的方法檢測:人全血體外活性評價試驗:在人血中對環氧化酶-1(COX-1酶)和環氧化酶-2(COX-2酶)活性的抑制。取血前一周未服用過非甾體抗炎藥並且24小時內未喝酒的健康志願者,採取其全血,並將血樣分成兩份:一份用於檢測COX-1酶的活性,另一份用於測定COX-2酶的活性。將化合物溶於DMSO中,並提前準備好裝有2微升且濃度在500,50,5,0.5,0.05,0.005,0.0005μg/毫升的溶液。在含有藥物的試管中加入200微升不含肝素的全血,然後在37℃下孵育1個小時,通過使用EIA試劑盒檢測血小板合成的血栓素B2 (TXB2 )的量來測定COX-1酶的活性。未加藥的樣品作為陰性對照。對於COX-2而言,將200微升含有肝素的全血加入裝有藥物和10微克/毫升LPS的試管中。LPS對照和只有溶劑的空白對照分別用於所產生PGE2 最大值及背景值的測定。樣品在37℃下孵育24小時,然後離心,收集血清/血漿,儲存在-80℃下用EIA試劑盒進行檢測。依據廠家的說明書,使用Cayman公司的EIA試劑盒分別檢測TXB2 和PGE2 的量,從而分別測定COX-1和COX-2的活性。
表7-1:體外活性測定-人全血試驗 同時,對化合物13~化合物99的人全血體外活性測定結果表明,其對COX-2的IC50 值大部分<10微克/毫升,對環氧化酶-2表現出良好的抑制活性。
參照上述方法,進行比格犬全血體外活性評價試驗,結果見表7-2:
表7-2:體外活性測定-犬全血試驗 體內試驗:化合物1對角叉菜膠致大鼠足腫脹的作用觀察(炎症模型評價)
動物分組及劑量
50隻大鼠,隨機分為5組,每組10隻動物。動物分組情況及給藥劑量、容量如下表:
藥物配製
根據動物的實際體重確定每個劑量組的配製總體積,取相應體積的純化水,之後先加入供試品或陽性對照品,使均勻分散,再加入羧甲基纖維素鈉,使成為均勻混懸液,無明顯團塊。各組溶液配製濃度見下表:
實驗方法:試驗採用Wistar大鼠50隻(3~4周齡,167-199克),雌雄各半,採用隨機分組法,分5組,分別是模型組、陽性對照組、化合物1:低、中、高劑量組;其中陽性對照組給予塞來昔布14毫克/千克,化合物1低、中、高3個劑量組的給藥劑量分別是7毫克/千克、10毫克/千克和14毫克/千克。在灌胃給藥後1小時採用1%角叉菜膠右後足足跖皮內注射0.1毫升進行致炎,致炎後每隔1小時測定一次足跖體積和足跖厚度,連續6次。計算足跖腫脹率和抑制率。
測定方法:使用UGOBasile體積描記儀測定大鼠右後足跖體積,同一隻動物每次測定時的液面位置儘量一致;使用數顯遊標卡尺在足跖中部描線處測定右後足跖厚度。
計算致炎後各時間點各組動物的足腫脹率(%)和抑制率(%),公式如下:
體積腫脹率=(致炎後足跖體積-致炎前足跖體積)/致炎前足跖體積×100%
厚度腫脹率=(致炎後足跖厚度-致炎前足跖厚度)/致炎前足跖厚度×100%
抑制率=(模型組平均腫脹度-給藥組平均腫脹度)/模型組平均腫脹度×100%
計算各組動物的足腫脹率的組平均數和標準差,之後進行以下統計學分析,檢驗水準為0.05,結果分析時同時考慮統計學意義和生物學意義。
採用Levene’s Test進行方差齊性檢驗。如果沒有統計學意義(P>0.05),用單因素方差分析(ANOVA)進行統計分析。如果ANOVA有統計學意義(P≤0.05),則進行Dunnett’s test(參數法)多重比較分析。
如果方差不齊(P≤0.05),則用Kruskal-Wallis檢驗。如果Kruskal-Wallis檢驗有統計學意義(P≤0.05),則進行Dunnett’s test(非參數方法)多重比較分析。
結果:見表8~11,由結果可以看出,與模型組相比,陽性對照組足腫脹率明顯降低,表明動物模型的製作成功;化合物1低、中、高3個劑量組的足腫脹率均有不同程度度的降低,且致炎後4小時的足腫脹抑制率均高於30%,表明化合物1在7毫克/千克、10毫克/千克和14毫克/千克的作用劑量下均可明顯抑制急性炎症。
表8:化合物1對角叉菜膠致大鼠足腫脹的作用觀察-足跖體積腫脹率(n=10,x±s)
表9:化合物1對角叉菜膠致大鼠足腫脹的作用觀察-足跖厚度腫脹率(n=10,x±s)
表:10化合物1對角叉菜膠致大鼠足腫脹的作用觀察-足跖體積腫脹抑制率(n=10,%)
表11:化合物1對角叉菜膠致大鼠足腫脹的作用觀察-足跖厚度腫脹抑制率(n=10,%)
體內試驗:小鼠懸尾試驗(抗抑鬱模型評價)
雄性昆明種小鼠,約20克,隨機分為6組。分別為正常組、陽性藥物組(氟西汀20毫克/千克)、化合物1:A組5毫克/千克、B組10毫克/千克、C組20毫克/千克、D組40毫克/千克。
單次給藥試驗:正常飼養1天適應環境後,禁食(不禁水)16小時後單次灌胃化合物,正常組灌胃等量蒸餾水,給藥後40分鐘,將小鼠倒置固定於懸尾裝置上,頭部距桌面約30厘米,用動物行為分析系統記錄6分鐘內後4分鐘的不動時間,進行統計學處理。
連續給藥三天試驗:正常飼養1天適應環境後,連續灌胃受試藥3天(1次/日),正常組灌胃等量蒸餾水,末次給藥前動物禁食(不禁水)16小時,末次給藥後40分鐘,將小鼠倒置固定於懸尾裝置上,頭部距桌面約30厘米,用動物行為分析系統記錄6分鐘內後4分鐘的不動時間,進行統計學處理。
連續給藥七天試驗:正常飼養1天適應環境後,連續灌胃7天(1次/日),正常組灌胃等量蒸餾水,末次給藥前動物禁食(不禁水)16小時,末次給藥後40分鐘,將小鼠倒置固定於懸尾裝置上,頭部距桌面約30厘米,用動物行為分析系統記錄6分鐘內後4分鐘的不動時間,進行統計學處理。
試驗結果:見表12。實驗結果顯示:單次、連續7天灌胃後陽性組與正常組的懸尾不動時間比較P<0.05,而連續3天灌胃後陽性組與正常組比較P<0.01,均具有顯著性差異,說明模型可靠。單次灌胃後受試藥5毫克/千克組、10毫克/千克組、40毫克/千克組的懸尾不動時間與正常組比較P<0.05;20毫克/千克組的不動時間與正常組比較P<0.01,均具有顯著性差異。連續3天灌胃後受試藥5毫克/千克組、40毫克/千克組的懸尾不動時間與正常組比較P<0.05;10毫克/千克組、20毫克/千克組的不動時間與正常組比較P<0.01,均具有顯著性差異,並有劑量相關性;連續7天灌胃後受試藥10毫克/千克組;A藥20毫克/千克組、40毫克/千克組的不動時間與正常組比較P<0.01,有劑量相關性;均具有顯著性差異;5毫克/千克組不動時間較正常組有減少的趨勢,但無統計學意義。
表12:受試藥灌胃對小鼠懸尾不動時間的影響 體內試驗:小鼠強迫游泳試驗(抗抑鬱模型評價)
雄性昆明種小鼠,約20克,隨機分為6組。分別為正常組、陽性藥物組(氟西汀20毫克/千克)、A組(化合物1,5毫克/千克)、B組(化合物1,10毫克/千克)、C組(化合物1,20毫克/千克)、D組(化合物1,40毫克/千克)。
單次給藥試驗:正常飼養1天適應環境後,禁食(不禁水)16小時後單次灌胃受試藥,正常組灌胃等量蒸餾水,給藥後40分鐘,將小鼠置於強迫游泳試驗裝置中(游泳環境:池直徑12.5厘米缸,水溫25℃,水深10厘米)。游泳6分鐘,動物行為分析系統記錄後4分鐘內不動時間(即四肢完全不動或僅有足部輕拍划水動作時間),進行統計學處理。
連續三天給藥試驗:正常飼養1天適應環境後,連續灌胃受試藥3天(1次/日),正常組灌胃等量蒸餾水,末次給藥前動物禁食(不禁水)16小時,末次給藥後40分鐘,將小鼠置於強迫游泳試驗裝置中(游泳環境:池直徑12.5厘米缸,水溫25℃,水深10厘米)。游泳6分鐘,動物行為分析系統記錄後4分鐘內不動時間(即四肢完全不動或僅有足部輕拍划水動作時間),進行統計學處理。
連續七天給藥試驗:正常飼養1天適應環境後,連續灌胃受試藥7天(1次/日),正常組灌胃等量蒸餾水,末次給藥前動物禁食(不禁水)16小時,末次給藥後40分鐘,將小鼠置於強迫游泳試驗裝置中(游泳環境:池直徑12.5厘米缸,水溫25℃,水深10厘米)。游泳6分鐘,動物行為分析系統記錄後4分鐘內不動時間(即四肢完全不動或僅有足部輕拍划水動作時間),進行統計學處理。
實驗結果:見表13。單次灌胃後陽性組與正常組的強迫游泳不動時間比較P<0.05,而連續3天和連續7天灌胃後陽性組與正常組比較P<0.01,均具有顯著性差異。
單次灌胃後受試藥(化合物1)10毫克/千克組、20毫克/千克組、40毫克/千克組的強迫游泳不動時間與正常組比較具有顯著性差異(P<0.01),有劑量相關性;5毫克/千克組強迫游泳不動時間較正常組有減少的趨勢,但無統計學意義。
連續3天灌胃後受試藥(化合物1)10毫克/千克組、20毫克/千克組、40毫克/千克組的強迫游泳不動時間與正常組比較具有顯著性差異(P<0.01),有劑量相關性;5毫克/千克組強迫游泳不動時間較正常組有減少的趨勢,無統計學意義;連續7天灌胃後受試藥(化合物1)10毫克/千克組、20毫克/千克組、40毫克/千克組的強迫游泳不動時間與正常組比較具有顯著性差異(P<0.01),有劑量相關性;5毫克/千克組強迫游泳不動時間較正常組有減少的趨勢,無統計學意義。
表13:受試藥灌胃對小鼠強迫游泳不動時間的影響 藥代動力學研究
化合物1在SD雄性大鼠體內靜脈給藥[IV2毫克/千克,2毫克/毫升,溶媒:DMSO/PEG400/30%HP-b-CD(5/25/70)],t1/2 為5.37小時。西米考西(Cimicoxib)在SD雄性大鼠體內通過IV[2毫克/千克,2毫克/毫升,溶媒:DMSO/PEG400/30%HP-b-CD(5/25/70)],t1/2 為3.20小時。化合物1的半衰期較西米考昔長。二者的藥代動力學參數如下表:
榮譽表彰 2018年12月20日,《咪唑衍生物、製備方法及用途》獲得第二十屆中國專利銀獎。
相關詞條
咪唑衍生物、製備方法及用途 《咪唑衍生物、製備方法及用途 》是北京歐博方醫藥科技有限公司於2011年6月15日申請的發明專利,該專利的申請號為2011101604965,公布號為CN102464652A,公布日為2012年5月23日,發明人是李靖,該...
咪唑 用作醫藥原料 ,用於製造抗真菌藥、抗霉劑、低血糖治療藥、人造血漿、滴蟲治療藥、支氣管哮喘治療藥、防斑疹劑等 ;用作農藥原料,用於硼酸製劑的增效劑、製取殺蟲劑和殺菌劑;此外,咪唑也用作脲醛樹脂固化劑、攝影藥物、粘合劑、塗料、橡膠硫化劑、防靜電劑等的原料; 有機合成中間體。製備方法 1、由乙二醛經環...
咪唑 啉 製備方法 由乙二胺或其醯化物在氧化鈣存在下加熱製得 。或由脂肪酸或脂肪酸酯與乙二胺縮合製得;也可用乙二醛、甲醛、氨為原料製得咪唑,再加氫製得。套用領域 咪唑啉本身並不重要,但其衍生物,尤其是2-咪唑啉的衍生物,在醫藥和農藥中很重要。如2-苄基-4,5-二氫咪唑是血管擴張劑和降壓藥,2-羥甲基-2-...
咪唑衍生物 配位聚合物的設計、合成和性能研究 金屬有機配位聚合物在主-客體化學、非線性光學、選擇性催化、磁學和氣體貯存等領域具有十分誘人的套用前景 ,因此新型金屬有機配位聚合物的研究是當前配位化學的熱點和前沿之一。本項目擬設計合成大小和形狀各異的咪唑多齒配體衍生物,獲得既具有一定的結構剛性,又具有靈活多樣配位性能的配體,與適當的金屬離子配位,...
2-咪唑 烷酮衍生物 用途:是一種重要的醫藥中間體,主要用於合成阿洛西林等。儲藏:遮光,密封,在乾燥處保存 。 1-氯甲醯基-3-乙醯基-2-咪唑烷酮 英文名稱:3-Acetyl-1-chlorocarbonyl-2-imidazolidone 分子式:C6H7ClN2O3 分子量:190.5844 密度:1.528g/cm 熔點:102-104℃ 沸點:278.5°C at 760 mmHg 閃點:122...
阿苯達唑 阿苯達唑,是一種有機化合物,化學式為CHN₃O₂S,是一種咪唑衍生物 類廣譜驅腸蟲藥物。由葛蘭素史克公司的動物健康實驗室在1972年發現。阿苯達唑已被列入世界衛生組織基本藥物標準清單,是最重要的基本健康藥物之一。阿苯達唑為一高效低毒的廣譜驅蟲藥,臨床可用於驅蛔蟲、蟯蟲、絛蟲、鞭蟲、鉤蟲、糞圓線蟲等...
苯並咪唑衍生物 許多苯井咪哩衍生物 具有抗病毒活性。其中辰重要的是HBB(a-c經芋基苯並咪哩),選擇性地抑制許多組織培養休系中的f小核糖核酸病毒的複製,一可能是在開始期,抑制病毒RNA的合成。衣抗病毒濃度下,HBB對基本細胞變化過程無明顯作用。但是,因為能快速出現抗性突變株,所以沒有用作化學治療劑。( H>3B依賴性突變...
α-取代的 2-甲基-5-硝基咪唑 -1-乙醇衍生物 《α-取代的2-甲基-5-硝基咪唑 -1-乙醇衍生物 》的目的在於提供一種新的具有抗厭氧菌特性的化合物。該發明的另一目的在於提供一種製備 該發明通式(I)新化合物的方法 。該發明的再一目的在於提供一種含有治療有效劑量的發明通式(I)新化合物的組合物,以及,該發明的目的還在於提供該發明通式(I)新化合物的用途 ...
N,N'-硫羰基二咪唑 生產方法及用途 生產方法以硫光氣和1-(三甲基矽基)咪唑 為原料來製備 。1.用於生化合成反應中基團保護及蛋白質肽鏈的連線。2.1,1' -硫碳醯二咪唑(TCDI)在有機合成中主要被用作硫羰基轉移試劑,與具有活性氫的羥基或者氨基反應生成硫羰基衍生物 。羥基生成的硫代羧酸酯可以發生去氧反應,鄰二羥基生成的硫代碳酸酯...
1,2-二甲基咪唑 1,2-二甲基咪唑 (1,2-Dimethylimidazole)是一種化學物質,化學式是C5H8N2,分子量是96.1304。性狀描述 淡黃色結晶或白色棱狀結晶 物理參數 熔點:39-41℃ 用途 說明 1、主要用於醫藥中間體。2、用作環氧樹脂固化劑,可廣泛用於環氧樹脂粘接、塗裝、澆注、包封、浸漬及複合材料等 質量規格 水份:≤0.5% 含量:≥...
用於電子裝置的咪唑 吡嗪衍生物 《用於電子裝置的咪唑 吡嗪衍生物 》是羅門哈斯電子材料韓國有限公司於2016年6月22日申請的專利,該專利公布號為CN107820497B,專利公布日為2021年6月8日,發明人是M·E·昂德瑞、D·M·威爾斯、R·D·弗勒澤、羅弘燁。 對比檔案 WO 2014080319 A1,2014.05.30; WO 2014080319 A1,2014.05.30; WO 200703...
苯並咪唑 苯並咪唑 是一種有機化合物,化學式是C₇H₆N₂,片狀結晶,微溶於冷水、乙醚、稍溶於熱水,易溶於乙醇、酸溶液、強鹼溶液。苯並咪唑可用於製備 殺菌劑抑霉唑、咪鮮胺等的中間體咪唑。基本信息 相關類別: BENZIMIDAZOLE;Pharmaceutical Intermediates;Intermediates;Imidazoles, Pyrroles, Pyrazoles, Pyrrolidines;...
4,5-咪唑 二醯胺 4,5-咪唑 二醯胺是一種化學物質,化學式為C5H6N4O2。InChI編碼 1S\/C5H6N4O2\/c6-4(10)2-3(5(7)11)9-1-8-2\/h1H,(H2,6,10)(H2,7,11)(H,8,9)其他名稱 IMIDAZOLE-4,5-DICARBOXAMIDE(6CI,7CI,8CI);GLYCAMIDE;GLYCAMIDE12;GLYCARBYLAMIDE;安全信息 危險類別碼 R36/37/38:對眼睛、呼吸...
吡咯咪唑 吡咯咪唑 1H-Benzimidazole,1-[(4-chlorophenyl)methyl]-2-(1-pyrrolidinylmethyl)-,是一種化學物質,分子式是CHClN₃。InChI編碼 1S\/C19H20ClN3\/c20-16-9-7-15(8-10-16)13-23-18-6-2-1-5-17(18)21-19(23)14-22-11-3-4-12-22\/h1-2,5-10H,3-4,11-14H2 其他名稱 BENZIMIDAZOLE,1-(...
2-氟-1-甲基咪唑 2-氟-1-甲基咪唑 是一種化學物質,化學式為C4H5FN2。中文名:2-氟-1-甲基咪唑 英文名稱:2-Fluoro-1-methylimidazole 英文別名:2-FLUORO-1-METHYLIMIDAZOLE CAS No.:66787-69-7 分 子 式:C4H5FN2 分 子 量:100.0943032 沸 點:181.5°C at 760 mmHg 折 射 率:1.499 閃 光 點:63.5°C In...
左旋奧硝唑在製備 抗厭氧菌感染藥物的套用 2013年,《左旋奧硝唑在製備 抗厭氧菌感染藥物的套用》獲得第八屆江蘇省專利項目獎優秀獎。專利背景 左旋奧硝唑(1-(3-氯-2-S-(-)羥丙基)-2-甲基-5-硝基咪唑 )為奧硝唑(Ornidazole,CAS16773-42-5)的左旋體,奧硝唑為硝基咪唑類衍生物, 是一種強力抗厭氧菌及抗原蟲感染的藥物,也是繼甲硝唑後新研製...
甲硝唑片 本品能增強華法林等抗凝藥物的作用。與土黴素合用可干擾甲硝唑清除陰道滴蟲的作用。藥物過量 大劑量可致抽搐。藥理毒理 本品為硝基咪唑衍生物, 可抑制阿米巴原蟲的氧化還原反應,使原蟲氮鏈發生斷裂。體外試驗證明,藥物濃度為1~2mg/L時,溶組織阿米巴於6~20小時即可發生形態改變,24小時內全部被殺滅,濃度為0.2...
甲硝唑乳膏 藥理作用:本品為硝基咪唑衍生物, 可抑制阿米巴原蟲的氧化還原反應,使原蟲氮鏈發生斷裂。體外試驗證明,藥物濃度為1~2mg/L時,溶組織阿米巴於6~20小時即可發生形態改變,24小時內全部被殺滅,濃度為0.2mg/L的,72小時內可殺死溶組織阿米巴。本品有強大的殺滅滴蟲的作用,其機理未明。甲硝唑對厭氧微生物有殺滅...
替硝唑 對替硝唑及硝基亞硝基烴咪唑衍生物 過敏者禁用。血液病患者或有血液病史者禁用。器質性神經疾病患者禁用。12歲以下患者禁用或不宜使用。藥物相互作用 該品有抑制乙醛脫氫酶作用,加強酒精的效應服藥後飲酒或服用含乙醇飲料可出現雙硫侖樣反應,可引起腹部痙攣、灼熱感及嘔吐,因而,在使用該品過程中應避免飲酒。該品與...
符立梧 2、吩惡嗪酮類化合物提取製備方法和 製藥用途 申請號:03146847.0 3、羥基蒽醌類衍生物 及其在製備抗癌藥物中的套用 申請號:200310112459.2 4、2,4,5-三取代咪唑 類化合物及其 合成方法和用於逆轉腫瘤多藥抗藥性的作用 申請號為:02149752.4 獲獎成果 1、“逆轉腫瘤多藥抗藥性的系列研究”衛生部科技進步三等獎 第...
程敬麗 20. 程敬麗,趙金浩,周勇,王國平,章初龍,林福呈,朱國念,木黴菌素衍生物 及其合成方法和用途, 200810162582.8 19. 趙金浩,程敬麗,程城,肖豆鑫,李中珊,朱國念. 納米噻唑鋅的製備方法, 201710215759.5(已轉化)18. 趙金浩,程敬麗,張建功,賴聲洪,徐冰融,朱國念. 苯基螺環肟醚烯醇酯類化合物及其用途,...
洛陽太平洋聯合石油化工有限公司 一種具有防鏽極壓能力的水基添加劑及其製備方法和套用 CN104946343B 一種抗高硬水的水基防鏽多功能添加劑及其製備方法和用途 CN104818077B 一種含多硫鍵的苯硼酸酯衍生物 及其製備方法和用途 CN104926845B 一種高水解穩定性的含硼添加劑及其製備方法和用途 CN104893787B 一種硫脲基改性咪唑 啉衍生物緩蝕劑及其製備 ...
專利複審和無效審查決定選編:化學 殺蟲基質和其製備方法案複審請求審查決定(第5626號)無溶劑油溶性減阻聚合物懸浮液案複審請求審查決定(第5628號)洗滌乾燥機案複審請求審查決定(第5629號)4-氨基烷氧基-1H-苯並咪唑衍生物 、它們的製備方法以及 它們作為多巴胺自身受體(D2)激動劑的用途 案複審請求審查決定(第5630號)基於1-(2-氯苯基)-4-(...
專利複審和無效審查決定選編(2005):化學 殺蟲基質和其製備方法案複審請求審查決定(第5626號)無溶劑油溶性減阻聚合物懸浮液案複審請求審查決定(第5628號)洗滌乾燥機案複審請求審查決定(第5629號)4-氨基烷氧基-1H-苯並咪唑衍生物 、它們的製備方法以及 它們作為多巴胺自身受體(D2)激動劑的用途 案複審請求審查決定(第5630號)基於1-(2-氯苯基)-4-(...
DICY 解決這個問題的方法 有兩種,一種是加入促進劑,在不過分損害雙氰胺的貯存期和使用性能的前提下,降低其固化溫度。這類促進劑很多,主要有咪唑 類化合物及其衍生物和 鹽、脲類衍生物、有機胍類衍生物、含磷化合物,過渡金屬配合物及複合促進劑等,這些促進劑都可以使雙氰胺的固化溫度明顯降低,理想的固化溫度可降至120℃左右...
樓宜嘉 6.《一種水菖蒲有效部位提取物及其用途 》公開號:CN1973877, 公開日:2007年6月6日;7.《淫羊藿總黃酮與三七總皂苷組合物的套用》(調節代謝型谷氨酸受體自身受體作用)公開號: CN101229210, 公開日:2008.07.30;8.《8-芳胺基-3H-咪唑 [4,5-g]喹唑啉類衍生物的用途 》(在製備 抗腫瘤藥物中套用)公開號...
向華(中國藥科大學藥學院教授、博士生導師) 3.向華,勞可靜,唐智超,嚴明,寧珊珊,張陸勇,尤啟冬. 4-咪唑 基喹啉酮類芳香化酶抑制劑、製備方法和 醫藥用途 . ZL 201310081971.9(授權)4.向華,寧珊珊,劉元元,孫潔,尋國良,嚴明,徐旭東,張陸勇,廖清江,尤啟冬. 甾體類5α-還原酶抑制劑、其製備方法及其 醫藥用途. ZL 201210001077.1(授權)5. 向華...
鑽井液處理劑實用手冊 本書共分十六章,從產品種類、組分、製備方法 、質量指標、用途 、安全與防護、包裝與儲運等方面,全面、系統地介紹了包括基本化學劑、降濾失劑、降黏劑、增黏劑、頁岩抑制劑、潤滑劑、堵漏劑、絮凝劑、乳化劑、加重劑、解卡劑、泡沫劑與消泡劑、緩蝕劑與殺菌劑、水合物抑制劑和油氣層保護劑等在內的鑽井液處理劑...