在反應過程中,若發生反應的部位位於反應分子平面兩側的稱為反面反應,更多的用異面來表示,用a表示。一般同面和異面的概念常用來描述軌道反應。
在判斷周環反應時,有重要作用。
基本介紹
定義
背景知識
價鍵理論
分子軌道理論
有效成鍵三原則
反面反應的類型

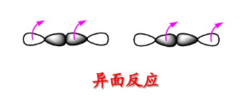

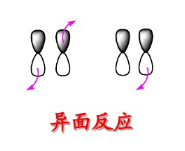

重要的套用-周環反應判斷原則









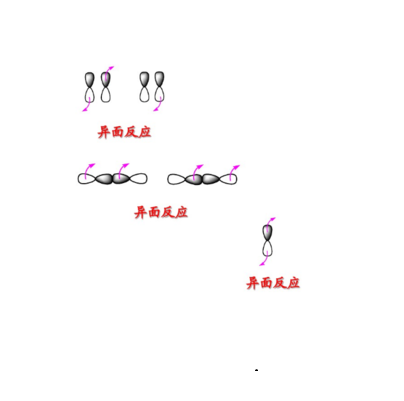
在反應過程中,若發生反應的部位位於反應分子平面兩側的稱為反面反應,更多的用異面來表示,用a表示。一般同面和異面的概念常用來描述軌道反應。
在判斷周環反應時,有重要作用。














在反應過程中,若發生反應的部位位於反應分子平面兩側的稱為反面反應,更多的用異面來表示,用a表示。一般同面和異面的概念常用來描述軌道反應。在判斷周環反應時,有重要作用。定義在反應過程中,若發生反應的部位位於反應分子平面兩側...
對於反面人物韓凌,要求點明他的五大特點:走資派、第一把手、不肯改悔、比還鄉團還厲害、反革命分子的後台。8月底9月初,《反擊》完成全部拍攝工作,進行剪接。9月9日,毛澤東逝世,舉國哀痛。即使遇上這樣天塌下來的大事,攝製組的工作...
消極提示法包括遺憾提示法、反面提示法等,它運用了心理學的褒將不如貶將、請將不如激將的道理,因為顧客往往對“不是”、“不對”、“沒必要”、“太傻了”等詞句的反應更為敏感。因此,運用從消極到不愉快,乃至反面語言的提示方法...
反面效應 在另一些實驗中也發現相反的情況。例如1933年培森進行的一項實驗,被試是一些大學生,讓他們分別在單獨與有別人在場情況下學習無意義音節單詞。實驗的結果表明,有別人在場的情況下,被試平均要經過11.27次才能學會有7個無意義...
除。進行消除反應時,一般強鹼從a位離開基團的反面進攻 進行i3-H由此形成的過渡態能最較低故鏈狀或環狀化 合物的消除反應多為反式消除反應。反式消除是反應本身的 主體化學特徵.這類反應產物的順、反構型取決十反應的 構型。
偏差三——反面社會認同 / 021 當偏差導致的結果適得其反時 偏差四——區別性 / 027 當世界朝左,請朝右 偏差五——習慣 / 035 當大部分行為已成為不假思索的慣常反應時,該如何衝破習慣築起的藩籬 偏差六——付款 / 044...
按化學性質來說,葉綠素是葉綠酸的酯,能發生皂化反應。葉綠酸是雙羧酸,其中一個羧基被甲醇所酯化,另一個被葉醇所酯化。葉綠素分子含有一個卟啉環的“頭部”和一個葉綠醇的“尾巴”。鎂原子居於卟啉環的中央,偏向於帶正電荷,與其...
有關冷核聚變最著名的事件是1989年的弗萊西曼-龐斯實驗,由於這個當時引起轟動的實驗沒能夠重現,20年來一直被視作科學研究的反面典型之一。1989年3月23日,美國猶他大學的彭斯和英國南安普敦大學的弗萊西曼舉行新聞發布會,宣稱在實驗室...
(5)採用電漿刻蝕對硼擴散後矽片進行邊絕緣,在電漿刻蝕機中通入CF₄、O₂,在輝光條件下與矽片進行化學反應,腐蝕矽片邊緣達到邊緣絕緣;(6)化學清洗矽片背面的硼矽玻璃,並且通過氧化性酸溶液在矽片的正反面形成氧化矽鈍化...
