化學計量計算
相關詞條
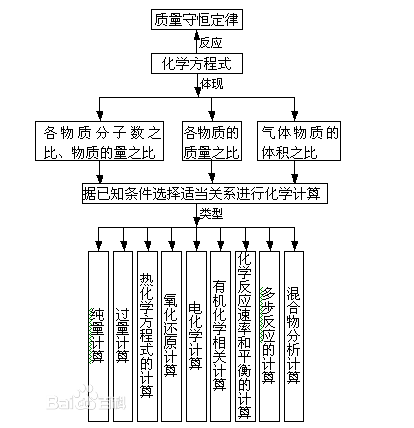
- 化學計量計算
有關化學組成、化學變化中,量和能量的關係及其計算。其根本出發點是原子論、質能守恆定律及一些化學的基本定律。 化學計量包括反應物和產物量的計算、化學平衡的計算、化學反應速率的計算、化學反應中能量的計算等。其中涉及許多物理量...
- 化學計量方法
化學計量方法是有關物質化學組成、化學反應中物質量和能量變化的計算方法,包括化學反應中反應物和生成物量的計算、化學平衡的計算、化學反應速率的計算、化學反應中能量的計算等。計算的理論依據是電子守恆、質量守恆及能量守恆定律及一些...
- 化學計算
巧妙結合數學和函式圖象簡化化學計算 例:氯氣和二氧化氮在室溫下可以化合生成一種新的氣態化合物A,為了測定A的組成進行以下實驗:取Cl2、NO2混合氣體總體積5L,測定反應後所得氣體體積隨Cl2在原混合氣體中所占體積分數 的變化而變化的...
- 化學計量法
化學計量法是指被分析物質與某試劑反應時,加入的試劑量少於化學計量時的一種測定元素的方法。通常對金屬離子進行分離時,加入反應的試劑量大大超過化學計算量。如果加入反應的試劑量少於化學計算量(一般為化學計量的5~7%),則被分離...
- 化學計算學
化學計算學 化學計算學(stoichiometry)是2015年公布的計量學名詞。定義 通過化學分子式、化學反應式、原子量或分子量等計算化學元素、化合物彼此反應的比例關係或數量的學科。出處 《計量學名詞》第一版。
- 化學計量學(化學分支學科)
國際化學計量學學會給化學計量學作出了如下的定義:化學計量學是一門通過統計學或數學方法將對化學體系的測量值與體系的狀態之間建立聯繫的學科。由於化學反應而引起反應物系組成變化的計算方法,是對反應過程進行物料衡算和熱量衡算的依據...
- 化學計量聚合反應
化學計量聚合反應是指在陰離子聚合反應過程中,嚴格控制反應條件,得到接連單分散聚合物為目標的聚合反應。化學計量包括反應物和產物量的計算、化學平衡的計算、化學反應速率的計算、化學反應中能量的計算等。其中涉及許多物理量、單位和符號...
- 化學方程式配平
化學方程式配平是一種化學方程式的計算方式。化學反應方程式嚴格遵守質量守恆定律,書寫化學反應方程式寫出反應物和生成物後,往往左右兩邊各原子數目不相等,不滿足質量守恆定律,這就需要通過計算配平來解決。原理 遵循兩個原則 ①質量守恆定律...
- 化學計量學——統計學與計算機在分析化學中的套用
也可供相關從業人員參考。圖書目錄 1 什麼是化學計量學 2 基礎統計學 3 信號處理與時間序列分析 4 最佳化與實驗設計 5 模式識別與分類 6 建模 7 分析化學資料庫 8 知識處理與軟計算 9 質量保證與實驗室管理規範 附錄 ...
- 化學方程式
化學計算題是從“量”的方面來反映物質及其變化規律的。化學計算包括化學和數學兩個因素,其中化學知識是數學計算的基礎,數學又是化學計算的工具。根據化學方程式的計算,必須對有關的化學知識有清晰的理解,熟練掌握有關反應的化學方程式。
- 高中化學-化學計算
第二講 關於化學常用計量的計算 本講知識整合 第三講 關於化學方程式的計算 3.1 化學方程式計算 3.2 熱化學方程式的計算 3.3 化學反應速率和化學平衡的計算 3.4 有機化學計算 本講知識整合 第四講 關於溶液計算 4.1 溶液...
- 分析化學手冊·10·化學計量學(第三版)
《分析化學手冊·10·化學計量學(第三版)》是2016年11月化學工業出版社出版的圖書,作者是梁逸曾、吳海龍、俞汝勤。內容簡介 本書的編寫依照分析化學研究的全過程,從選擇分析方法和採樣開始,經化學量測的試驗設計、信號預處理、定性...
- Excel中的化學計量學
第7章Excel中的矩陣計算067 7.1基本信息067 7.1.1地區及語言067 7.1.2工作簿、工作表和單元格069 7.1.3地址070 7.1.4區域072 7.1.5簡單運算073 7.1.6函式073 7.1.7重要函式075 7.1.8公式中的錯誤078 7.1.9公式...
- 龍門專題·高中化學:化學計算
第二講關於化學常用計量的計算 本講知識整合 本講高水平測試題 第三講關於化學方程式的計算 3.1化學方程式計算 3.2熱化學方程式的計算 3.3化學反應速率和化學平衡的計算 3.4有機化學計算 本講知識整合 本講高水平測試題 第四講關於...
- 化學計量學 : 一些重要方法的原理及套用
《化學計量學 : 一些重要方法的原理及套用》是2004年科學出版社出版的圖書,作者是許祿。內容簡介 本書介紹了化學計量學中的一些重要方法。全書共10章。其中,第1章概略地回顧了化學計量學的發展歷史及現狀;第2~4章介紹了主成分分析...
- 化學計量在實驗中的套用
《化學計量在實驗中的套用》是隆德中學提供的微課課程,主講教師為王芳通 。課程簡介 本專題包括: 1.物質的量 摩爾質量 2.氣體摩爾體積 3.突破阿伏加德羅常數的“五個陷阱” 4.物質的量濃度及有關計算 5.一定物質的量濃度溶液的...
- 物質的量
在使用摩爾表示物質的量時,應該用化學式指明粒子的種類,而不使用該粒子的中文名稱。例如說“1mol氧”,是指1mol氧原子,還是指1mol氧分子,含義就不明確。又如說“1mol碳原子”,是指1mol C-12,還是指1mol C-13,含義也不...
- 濃度
溶質含量越多,濃度越大。濃度可以用一定的溶液中溶質的克數、克分子數或克當量數計算。一般用單位溶液所含溶質的重量的百分比來表示。表示方法 符號為C,單位為mol/L。計算式為:C=n/V. C=1000ρω/M 濃度 指某物質在總量中所...
- 氣體摩爾體積
(5)直接將氣體摩爾體積代入有關化學方程式進行計算;(6)氣體反應物的體積比即分子數比可便於找出過量氣體。定律推論 阿伏加德羅定律及推論都可由理想氣體狀態方程及其變形推出( 壓強、體積、絕對溫度、物質的量、氣體常數、密度)。由...
- 摩爾(物質的量單位)
摩爾是化學上套用最廣的計量單位,如用於化學反應方程式的計算,溶液中的計算,溶液的配製及其稀釋,有關化學平衡的計算,氣體摩爾體積及熱化學中都離不開這個基本單位。摩爾消光係數、摩爾吸光係數、摩爾吸收係數 分光光度法是基於不同...
- 阿伏伽德羅常量
在化學計算中套用摩爾十分方便。資料二 阿伏加德羅常數,0.012kg¹²C中所含的原子數目叫做阿伏加德羅常數。阿伏加德羅常數的符號為N。阿伏加德羅常數的近似值為:6.02×10²³mol。符號:N 含義:1mol任何粒子所含的粒子數均為...
- mol/L
摩爾是由克分子發展而來的,起著統一克分子、克原子、克離子、克當量等許多概念的作用,同時把物理上的光子、電子及其他粒子群等“物質的量”也概括在內,使在物理和化學中計算“物質的量”有了一個統一的單位。 [1] ...
