體內一些代謝物可與某些酶的活性中心外的某個部位非共價可逆結合,引起酶的構象變化,從而改變酶的活性,引起酶的別構效應的物質稱為別構效應劑。
別構效應,別(變)構蛋白質(酶),別構效應的意義,
別構效應
別構效應亦稱變構效應,是指一個蛋白質與它的配體結合後,蛋白質的構象發生變化,使它更適合於功能的需要,這一類變化稱為別構效應。
別(變)構蛋白質(酶)
是指具有別構效應的蛋白質或酶。
別構效應的意義
別構效應的意義-----主要是構成代謝的負反饋調節
即當一個代謝途徑的代謝產物增多時,反饋抑制關鍵酶,使代謝速度減慢,避免代謝產物的大量堆積。
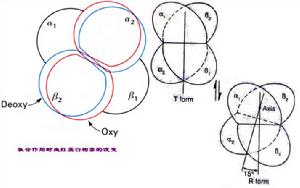
血紅蛋白的別構效應
Hb與O2結合前,Hb的構象處於緊張態,不利於與O2的結合Hb的4個亞基通過鹽鍵、疏水鍵聚合在一起,在2個β-亞基之間夾著1分子2,3-二磷酸甘油酸(2,3-DPG),2,3-DPG的3個負電基團與β-亞基的3個正電基團形成鹽鍵,此時Hb的構象處於緊張態(tensestate,T態),各亞基對O2的親和力比較低,不易與O2結合。
此時鐵原子5個配位鍵中的4個分別與血紅素卟啉環上N原子相連線,1個與F8位組氨酸的N原子相連,鐵原子仍具有不成對電子,故此時鐵原子的直徑較大(比卟啉環當中的孔大),突出卟啉平面約為0.075nm。
即當一個代謝途徑的代謝產物增多時,反饋抑制關鍵酶,使代謝速度減慢,避免代謝產物的大量堆積。
血紅蛋白的別構效應
Hb與O2結合前,Hb的構象處於緊張態,不利於與O2的結合Hb的4個亞基通過鹽鍵、疏水鍵聚合在一起,在2個β-亞基之間夾著1分子2,3-二磷酸甘油酸(2,3-DPG),2,3-DPG的3個負電基團與β-亞基的3個正電基團形成鹽鍵,此時Hb的構象處於緊張態(tensestate,T態),各亞基對O2的親和力比較低,不易與O2結合。
此時鐵原子5個配位鍵中的4個分別與血紅素卟啉環上N原子相連線,1個與F8位組氨酸的N原子相連,鐵原子仍具有不成對電子,故此時鐵原子的直徑較大(比卟啉環當中的孔大),突出卟啉平面約為0.075nm。
Hb與O2結合後,Hb的構象處於松馳態,有利於與O2的結合O2與鐵原子以配位鍵結合後,鐵的配位數由5變為6,鐵原子直徑減少(因沒有不成對電子),能移動0.075nm進到卟啉環當中的孔穴中,這一移動通過F8位組氨酸牽動了它所在的肽段,進而影響Hb亞基間的相互作用,破壞了鹽鍵和其它次級鍵,擠出了β-亞基間的2,3-DPG,使亞基間的聚合變得疏鬆,整個分子處於鬆弛態(relaxedstate,R態),有利於與O2的結合。
血紅素鐵與氧結合時構象改變圖
血紅素鐵與氧結合時構象改變圖
Hb與O2的結合呈正協同效應
由於Hb亞基間的次級鍵限制了亞基肽段的移動,所以第一個亞基與O2結合時,肽段的移動最為因難,第二及第三個亞基與O2結合時肽段移動相對容易些,到第四個亞基與O2結合時,已沒有了束縛。因此Hb的氧飽和曲線呈S形。
Hb的運O2功能通過R態和T態構象的互變實現