酶(enzyme)由生物體內細胞產生的一種生物催化劑。由蛋白質組成(少數為RNA)。能在機體中十分溫和的條件下,高效率地催化各種生物化學反應,促進生物體的新陳代謝。
基本介紹
- 中文名:甘油磷酸酶
- 外文名:glycerophosphatase
- 組成:蛋白質、RNA
- 催化作用實質:降低化學反應活化能
- 特性:高效丶專一丶多樣丶溫和
簡介,酶的發現,酶的活力,酶的催化,影響酶活力的因素,酶的分類,酶的命名,酶的套用,
簡介
酶(enzyme)由生物體內細胞產生的一種生物催化劑。由蛋白質組成(少數為RNA)。能在機體中十分溫和的條件下,高效率地催化各種生物化學反應,促進生物體的新陳代謝。生命活動中的消化、吸收、呼吸、運動和生殖都是酶促反應過程。酶是細胞賴以生存的基礎。細胞新陳代謝包括的所有化學反應幾乎都是在酶的催化下進行的。如哺乳動物的細胞就含有幾千種酶。它們或是溶解於細胞液中,或是與各種膜結構結合在一起,或是位於細胞內其他結構的特定位置上。這些酶統稱胞內酶;另外,還有一些在細胞內合成後再分泌至細胞外的酶──胞外酶。酶催化化學反應的能力叫酶活力(或稱酶活性)。酶活力可受多種因素的調節控制,從而使生物體能適應外界條件的變化,維持生命活動。沒有酶的參與,新陳代謝只能以極其緩慢的速度進行,生命活動就根本無法維持。例如食物必須在酶的作用下降解成小分子,才能透過腸壁,被組織吸收和利用。在胃裡有胃蛋白酶,在腸里有胰臟分泌的胰蛋白酶、胰凝乳蛋白酶、脂肪酶和澱粉酶等。又如食物的氧化是動物能量的來源,其氧化過程也是在一系列酶的催化下完成的。
甘油磷酸酶 酶催化作用實質:降低化學反應活化能
酶與無機催化劑比較:
1、相同點:1)改變化學反應速率,本身幾乎不被消耗;2)只催化已存在的化學反應;3)加快化學反應速率,縮短達到平衡時間,但不改變平衡點;4)降低活化能,使化學反應速率加快。5)都會出現中毒現象。
2、不同點:即酶的特性
酶的特性
1、高效性:酶的催化效率比無機催化劑更高,使得反應速率更快;2、專一性:一種酶只能催化一種或一類底物,如蛋白酶只能催化蛋白質水解成多肽;3、多樣性:酶的種類很多,大約有4000多種;4、溫和性:是指酶所催化的化學反應一般是在較溫和的條件下進行的。
一般來說,動物體內的酶最適溫度在35到40攝氏度之間,植物體內的酶最適溫度在40-50攝氏度之間;細菌和真菌體內的酶最適溫度差別較大,有得酶最適溫度可高達70攝氏度。動物體內的酶最適PH大多在6.5-8.0之間,但也有例外,如胃蛋白酶的最適PH為1.5,植物體內的酶最適PH大多在4.5-6.5之間。
酶的這些性質使細胞內錯綜複雜的物質代謝過程能有條不紊地進行,使物質代謝與正常的生理機能互相適應.若因遺傳缺陷造成某個酶缺損,或其它原因造成酶的活性減弱,均可導致該酶催化的反應異常,使物質代謝紊亂,甚至發生疾病.因此酶與醫學的關係十分密切。 甘油磷酸酶
甘油磷酸酶
酶與無機催化劑比較:
1、相同點:1)改變化學反應速率,本身幾乎不被消耗;2)只催化已存在的化學反應;3)加快化學反應速率,縮短達到平衡時間,但不改變平衡點;4)降低活化能,使化學反應速率加快。5)都會出現中毒現象。
2、不同點:即酶的特性
酶的特性
1、高效性:酶的催化效率比無機催化劑更高,使得反應速率更快;2、專一性:一種酶只能催化一種或一類底物,如蛋白酶只能催化蛋白質水解成多肽;3、多樣性:酶的種類很多,大約有4000多種;4、溫和性:是指酶所催化的化學反應一般是在較溫和的條件下進行的。
一般來說,動物體內的酶最適溫度在35到40攝氏度之間,植物體內的酶最適溫度在40-50攝氏度之間;細菌和真菌體內的酶最適溫度差別較大,有得酶最適溫度可高達70攝氏度。動物體內的酶最適PH大多在6.5-8.0之間,但也有例外,如胃蛋白酶的最適PH為1.5,植物體內的酶最適PH大多在4.5-6.5之間。
酶的這些性質使細胞內錯綜複雜的物質代謝過程能有條不紊地進行,使物質代謝與正常的生理機能互相適應.若因遺傳缺陷造成某個酶缺損,或其它原因造成酶的活性減弱,均可導致該酶催化的反應異常,使物質代謝紊亂,甚至發生疾病.因此酶與醫學的關係十分密切。
 甘油磷酸酶
甘油磷酸酶酶的發現
1773年,義大利科學家斯帕蘭扎尼(L.Spallanzani,1729—1799)設計了一個巧妙的實驗:將肉塊放入小巧的金屬籠中,然後讓鷹吞下去。過一段時間他將小籠取出,發現肉塊消失了。於是,他推斷胃液中一定含有消化肉塊的物質。但是什麼,他不清楚。
1836年,德國科學家施旺(T.Schwann,1810—1882)從胃液中提取出了消化蛋白質的物質。解開胃的消化之謎。
1926年,美國科學家薩姆鈉(J.B.Sumner,1887—1955)從刀豆種子中提取出脲酶的結晶,並通過化學實驗證實脲酶是一種蛋白質。
20世紀30年代,科學家們相繼提取出多種酶的蛋白質結晶,並指出酶是一類具有生物催化作用的蛋白質。
20世紀80年代,美國科學家切赫(T.R.Cech,1947—)和奧特曼(S.Altman,1939—)發現少數RNA也具有生物催化作用。
1836年,德國科學家施旺(T.Schwann,1810—1882)從胃液中提取出了消化蛋白質的物質。解開胃的消化之謎。
1926年,美國科學家薩姆鈉(J.B.Sumner,1887—1955)從刀豆種子中提取出脲酶的結晶,並通過化學實驗證實脲酶是一種蛋白質。
20世紀30年代,科學家們相繼提取出多種酶的蛋白質結晶,並指出酶是一類具有生物催化作用的蛋白質。
20世紀80年代,美國科學家切赫(T.R.Cech,1947—)和奧特曼(S.Altman,1939—)發現少數RNA也具有生物催化作用。
酶的活力
酶活力單位(U,active unit):
酶活力單位的量度。1961年國際酶學會議規定:1個酶活力單位是指在特定條件(25oC,其它為最適條件)下,在1min內能轉化1μmol底物的酶量,或是轉化底物中1μmol的有關基團的酶量。
比活(specific activity):每分鐘每毫克酶蛋白在25oC下轉化的底物的微摩爾數。比活是酶純度的測量。
活化能(activation energy):將1mol反應底物中所有分子由其態轉化為過度態所需要的能量。
活性部位(active site):酶中含有底物結合部位和參與催化底物轉化為產物的胺基酸殘基部分。活性部位通常位於蛋白質的結構域或亞基之間的裂隙或是蛋白質表面的凹陷部位,通常都是由在三維空間上靠得很進的一些胺基酸殘基組成。
酶活測定
初速度(initial velocity):酶促反應最初階段底物轉化為產物的速度,這一階段產物的濃度非常低,其逆反應可以忽略不計。
米氏方程(Michaelis-Mentent equation):表示一個酶促反應的起始速度(υ)與底物濃度([s])關係的速度方程:υ=υmax[s]/(Km+[s])
米氏常數(Michaelis constant):對於一個給定的反應,異至酶促反應的起始速度(υ0)達到最大反應速度(υmax)一半時的底物濃度。
催化常數(catalytic number)(Kcat):也稱為轉換數。是一個動力學常數,是在底物處於飽和狀態下一個酶(或一個酶活性部位)催化一個反應有多快的測量。
催化常數等於最大反應速度除以總的酶濃度(υmax/[E]total)。或是每摩酶活性部位每秒鐘轉化為產物的底物的量(摩[爾])。
雙倒數作圖(double-reciprocal plot):那稱為Lineweaver_Burk作圖。一個酶促反應的速度的倒數(1/V)對底物度的倒數(1/LSF)的作圖。x和y軸上的截距分別代表米氏常數和最大反應速度的倒數。
酶活調節
競爭性抑制作用(competitive inhibition):通過增加底物濃度可以逆轉的一種酶抑制類型。競爭性抑制劑通常與正常的底物或配體競爭同一個蛋白質的結合部位。這種抑制使Km增大而υmax不變。
非競爭性抑制作用(noncompetitive inhibition): 抑制劑不僅與游離酶結合,也可以與酶-底物複合物結合的一種酶促反應抑制作用。這種抑制使Km不變而υmax變小。
反競爭性抑制作用(uncompetitive inhibition): 抑制劑只與酶-底物複合物結合而不與游離的酶結合的一種酶促反應抑制作用。這種抑制使Km和υmax都變小但υmax/Km不變。
很大一類複雜的蛋白質物質 [enzyme;ferment],在促進可逆反應(如水解和氧化)方面起著像催化劑一樣的作用。在許多工業過程中是有用的(如發酵、皮革鞣製及乾酪生產)
酶是一種有機的膠狀物質,由蛋白質組成,對於生物的化學變化起催化作用,發酵就是靠它的作用:~原。
酶活力單位的量度。1961年國際酶學會議規定:1個酶活力單位是指在特定條件(25oC,其它為最適條件)下,在1min內能轉化1μmol底物的酶量,或是轉化底物中1μmol的有關基團的酶量。
比活(specific activity):每分鐘每毫克酶蛋白在25oC下轉化的底物的微摩爾數。比活是酶純度的測量。
活化能(activation energy):將1mol反應底物中所有分子由其態轉化為過度態所需要的能量。
活性部位(active site):酶中含有底物結合部位和參與催化底物轉化為產物的胺基酸殘基部分。活性部位通常位於蛋白質的結構域或亞基之間的裂隙或是蛋白質表面的凹陷部位,通常都是由在三維空間上靠得很進的一些胺基酸殘基組成。
酶活測定
初速度(initial velocity):酶促反應最初階段底物轉化為產物的速度,這一階段產物的濃度非常低,其逆反應可以忽略不計。
米氏方程(Michaelis-Mentent equation):表示一個酶促反應的起始速度(υ)與底物濃度([s])關係的速度方程:υ=υmax[s]/(Km+[s])
米氏常數(Michaelis constant):對於一個給定的反應,異至酶促反應的起始速度(υ0)達到最大反應速度(υmax)一半時的底物濃度。
催化常數(catalytic number)(Kcat):也稱為轉換數。是一個動力學常數,是在底物處於飽和狀態下一個酶(或一個酶活性部位)催化一個反應有多快的測量。
催化常數等於最大反應速度除以總的酶濃度(υmax/[E]total)。或是每摩酶活性部位每秒鐘轉化為產物的底物的量(摩[爾])。
雙倒數作圖(double-reciprocal plot):那稱為Lineweaver_Burk作圖。一個酶促反應的速度的倒數(1/V)對底物度的倒數(1/LSF)的作圖。x和y軸上的截距分別代表米氏常數和最大反應速度的倒數。
酶活調節
競爭性抑制作用(competitive inhibition):通過增加底物濃度可以逆轉的一種酶抑制類型。競爭性抑制劑通常與正常的底物或配體競爭同一個蛋白質的結合部位。這種抑制使Km增大而υmax不變。
非競爭性抑制作用(noncompetitive inhibition): 抑制劑不僅與游離酶結合,也可以與酶-底物複合物結合的一種酶促反應抑制作用。這種抑制使Km不變而υmax變小。
反競爭性抑制作用(uncompetitive inhibition): 抑制劑只與酶-底物複合物結合而不與游離的酶結合的一種酶促反應抑制作用。這種抑制使Km和υmax都變小但υmax/Km不變。
很大一類複雜的蛋白質物質 [enzyme;ferment],在促進可逆反應(如水解和氧化)方面起著像催化劑一樣的作用。在許多工業過程中是有用的(如發酵、皮革鞣製及乾酪生產)
酶是一種有機的膠狀物質,由蛋白質組成,對於生物的化學變化起催化作用,發酵就是靠它的作用:~原。
酶的催化
酸-鹼催化(acid-base catalysis):質子轉移加速反應的催化作用。
共價催化(covalent catalysis):一個底物或底物的一部分與催化劑形成共價鍵,然後被轉移給第二個底物。許多酶催化的基團轉移反應都是通過共價方式進行的。
催化機理
酶的催化機理和一般化學催化劑基本相同,也是先和反應物(酶的底物)結合成絡合物,通過降低反應的能來提高化學反應的速度,在恆定溫度下,化學反應體系中每個反應物分子所含的能量雖然差別較大,但其平均值較低,這是反應的初態。
S(底物)→P(產物)這個反應之所以能夠進行,是因為有相當部分的S分子已被激活成為活化(過渡態)分子,活化分子越多,反應速度越快。在特定溫度時,化學反應的活化能是使1摩爾物質的全部分子成為活化分子所需的能量(千卡)。
酶(E)的作用是:與S暫時結合形成一個新化合物ES,ES的活化狀態(過渡態)比無催化劑的該化學反應中反應物活化分子含有的能量低得多。ES再反應產生P,同時釋放E。E可與另外的S分子結合,再重複這個循環。降低整個反應所需的活化能,使在單位時間內有更多的分子進行反應,反應速度得以加快。如沒有催化劑存在時,過氧化氫分解為水和氧的反應(2H2O2→2H2O+O2)需要的活化能為每摩爾18千卡(1千卡=4.187焦耳),用過氧化氫酶催化此反應時,只需要活化能每摩爾2千卡,反應速度約增加10^11倍。
酶作用的分子基礎
一、酶的化學組成
按照酶的化學組成可將酶分為單純酶和結合酶兩大類。單純酶分子中只有胺基酸殘基組成的肽鏈,結合酶分子中則除了多肽鏈組成的蛋白質,還有非蛋白成分,如金屬離子、鐵卟啉或含B族維生素的小分子有機物。結合酶的蛋白質部分稱為酶蛋白(apoenzyme),非蛋白質部分統稱為輔助因子 (cofactor),兩者一起組成全酶(holoenzyme);只有全酶才有催化活性,如果兩者分開則酶活力消失。非蛋白質部分如鐵卟啉或含B族維生素的化合物若與酶蛋白以共價鍵相連的稱為輔基(prosthetic group),用透析或超濾等方法不能使它們與酶蛋白分開;反之兩者以非共價鍵相連的稱為輔酶(coenzyme),可用上述方法把兩者分開。表4-1為以金屬離子作結合酶輔助因子的一些例子。表4-2列出含B族維生素的幾種輔酶(基)及其參與的反應。
結合酶中的金屬離子有多方面功能,它們可能是酶活性中心的組成成分;有的可能在穩定酶分子的構象上起作用;有的可能作為橋樑使酶與底物相連線。輔酶與輔基在催化反應中作為氫(H+和e)或某些化學基團的載體,起傳遞氫或化學基團的作用。體內酶的種類很多,但酶的輔助因子種類並不多,從表4—1中已見到幾種酶均用某種相同的金屬離子作為輔助因子的例子,同樣的情況亦見於輔酶與輔基,如3-磷酸甘油醛脫氫酶和乳酸脫氫酶均以NAD+作為輔酶。酶催化反應的特異性決定於酶蛋白部分,而輔酶與輔基的作用是參與具體的反應過程中氫(H+和e)及一些特殊化學基團的運載。
二、酶的活性中心
酶屬生物大分子,分子質量至少在1萬以上,大的可達百萬。酶的催化作用有賴於酶分子的一級結構及空間結構的完整。若酶分子變性或亞基解聚均可導致酶活性喪失。一個值得注意的問題是酶所催化的反應物即底物(substrate),卻大多為小分物質它們的分子質量比酶要小几個數量級。
酶的活性中心(active center)只是酶分子中的很小部分,酶蛋白的大部分胺基酸殘基並不與底物接觸。組成酶活性中心的胺基酸殘基的側鏈存在不同的功能基團,如-NH2、-COOH、-SH、-OH和咪唑基等,它們來自酶分子多肽鏈的不同部位。有的基團在與底物結合時起結合基團(binding group)的作用,有的在催化反應中起催化基團(catalytic group)的作用。但有的基團既在結合中起作用,又在催化中起作用,所以常將活性部位的功能基團統稱為必需基團(essential group)。它們通過多肽鏈的盤曲摺疊,組成一個在酶分子表面、具有三維空間結構的孔穴或裂隙,以容納進入的底物與之結合(圖4-1)並催化底物轉變為產物,這個區域即稱為酶的活性中心。
而酶活性中心以外的功能集團則在形成並維持酶的空間構象上也是必需的,故稱為活性中心以外的必需基團。對需要輔助因子的酶來說,輔助因子也是活性中心的組成部分。酶催化反應的特異性實際上決定於酶活性中心的結合基團、催化基團及其空間結構。
三、酶的分子結構與催化活性的關係
酶的分子結構的基礎是其胺基酸的序列,它決定著酶的空間結構和活性中心的形成以及酶催化的專一性。如哺乳動物中的磷酸甘油醛脫氫酶的胺基酸殘基序列幾乎完全相同,說明相同的一級結構是酶催化同一反應的基礎。又如消化道的糜蛋白酶,胰蛋白酶和彈性蛋白酶都能水解食物蛋白質的肽鍵,但三者水解的肽鍵有各自的特異性,糜蛋白酶水解含芳香族胺基酸殘基提供羧基的肽鍵,胰蛋白酶水解賴氨酸等鹼性胺基酸殘基提供羧基的肽鍵,而彈性蛋白酶水解側鏈較小且不帶電荷胺基酸殘基提供羧基的肽鍵.這三種酶的胺基酸序列分析顯示40%左右的胺基酸序列相同,都以絲氨酸殘基作為酶的活性中心基團,三種酶在絲氨酸殘基周圍都有G1y-Asp-Ser-Gly-Pro序列,X線衍射研究提示這三種酶有相似的空間結構,這是它們都能水解肽鍵的基礎。而它們水解肽鍵時的特異性則來自酶的底物結合部位上胺基酸組成上有微小的差別所致。
圖說明這三個酶的底物結合部位均有一個袋形結構,糜蛋白酶該處能容納芳香基或非極性基;胰蛋白酶袋子底部稍有不同其中一個胺基酸殘基為天冬氨酸取代,使該處負電荷增強,故該處對帶正電荷的賴氨酸或精酸殘基結合有利;彈性蛋白酶口袋二側為纈氨酸和蘇氨酸殘基所取代,因此該處只能結合較小側鏈和不帶電荷的基團.說明酶的催化特異性與酶分子結構的緊密關係。
四、酶原與酶原激活(zymogen andactivation of zymogen)
有些酶如消化系統中的各種蛋白酶以無活性的前體形式合成和分泌,然後,輸送到特定的部位,當體內需要時,經特異性蛋白水解酶的作用轉變為有活性的酶而發揮作用。這些不具催化活性的酶的前體稱為酶原(zymogen)。如胃蛋白酶原(pepsinogen)、胰蛋白酶原(trypsinogen)和胰凝乳蛋白酶原(chymotrypsinogen)等。某種物質作用於酶原使之轉變成有活性的酶的過程稱為酶原的激活。使無活性的酶原轉變為有活性的酶的物質稱為活化素。活化素對於酶原的激活作用具有一定的特異性。
例如胰腺細胞合成的糜蛋白酶原為245個胺基酸殘基組成的單一肽鏈,分子內部有5對二硫鍵相連,該酶原的激活過程如圖4-3所示.首先由胰蛋白酶水解15位精氨酸和16位異亮氨酸殘基間的肽鍵,激活成有完全催化活性的p-糜蛋白酶,但此時酶分子尚未穩定,經p-糜蛋白酶自身催化,去除二分子二肽成為有催化活性井具穩定結構的α—糜蛋白酶。
在正常情況下,血漿中大多數凝血因子基本上是以無活性的酶原形式存在,只有當組織或血管內膜受損後,無活性的酶原才能轉變為有活性的酶,從而觸發一系列的級聯式酶促反應,最終導致可溶性的纖維蛋白原轉變為穩定的纖維蛋白多聚體,網羅血小板等形成血凝塊。
酶原激活的本質是切斷酶原分子中特異肽鍵或去除部分肽段後有利於酶活性中心的形成酶原激活有重要的生理意義,一方面它保證合成酶的細胞本身不受蛋白酶的消化破壞,另一方面使它們在特定的生理條件和規定的部位受到激活並發揮其生理作用。如組織或血管內膜受損後激活凝血因子;胃主細胞分泌的胃蛋白酶原和胰腺細胞分泌的糜蛋白酶原、胰蛋白酶原、彈性蛋白酶原等分別在胃和小腸激活成相應的活性酶,促進食物蛋白質的消化就是明顯的例證。特定肽鍵的斷裂所導致的酶原激活在生物體內廣泛存在,是生物體的一種重要的調控酶活性的方式。如果酶原的激活過程發生異常,將導致一系列疾病的發生。出血性胰腺炎的發生就是由於蛋白酶原在未進小腸時就被激活,激活的蛋白酶水解自身的胰腺細胞,導致胰腺出血、腫脹。
四、同工酶(isoenzyme)
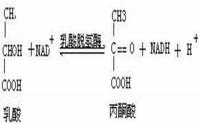
同工酶的概念:即同工酶是一類催化相同的化學反應,但酶蛋白的分子結構、理化性質和免疫原性各不相同的一類酶。 它們存在於生物的同一種族或同一個體的不同組織,甚至在同一組織、同一細胞的不同細胞器中。至今已知的同工酶已不下幾十種,如己糖激酶,乳酸脫氫酶等,其中以乳酸脫氫酶(lactic acid dehydrogenase,LDH)研究得最為清楚。人和脊柱動物組織中,有五種分子形式,它們催化下列相同的化學反應:
五種同工酶均由四個亞基組成。LDH的亞基有骨骼肌型(M型)和心肌型(H型)之分,兩型亞基的胺基酸組成不同,由兩種亞基以不同比例組成的四聚體,存在五種LDH形式.即H4(LDHl)、H3M1(LDH2)、H2M2 (LDH3)、H1M3(LDH4)和M4 (LDH5)。
M、H亞基的胺基酸組成不同,這是由基因不同所決定。五種LDH中的M、H亞基比例各異,決定了它們理化性質的差別.通常用電冰法可把五種LDH分開,LDH1向正極泳動速度最快,而LDH5泳動最慢,其它幾種介於兩者之間,依次為LDH2、LDH3和LDH4(圖4-5) 圖4-5還說明了不同組織中各種LDH所含的量不同,心肌中以LDHl及LDH2的量較多,而骨骼肌及肝中LDH5和LDH4為主.不同組織中LDH同工酶譜的差異與組織利用乳酸的生理過程有關.LDH1和LDH2對乳酸的親和力大,使乳酸脫氫氧化成丙酮酸,有利於心肌從乳酸氧化中取得能量。LDH5和LDH4對丙酮酸的親和力大,有使丙酮酸還原為乳酸的作用,這與肌肉在無氧酵解中取得能量的生理過程相適應(詳見糖代謝章).在組織病變時這些同工酶釋放入血,由於同工酶在組織器官中分布差異,因此血清同工酶譜就有了變化。故臨床常用血清同工酶譜分析來診斷疾病(圖4-5)。
五、 別構酶
別構酶(allosteric enzyme)往往是具有四級結構的多亞基的寡聚酶,酶分子中除有催化作用的活性中心也稱催化位點(catalytic site)外;還有別構位點(allosteric site).後者是結合別構劑(allesteric effector)的位置,當它與別構劑結合時,酶的分子構象就會發生輕微變化,影響到催化位點對底物的親和力和催化效率。若別構劑結合使酶與底物親和力或催化效率增高的稱為別構激活劑(allostericactivator),反之使酶底物的r親和力或催化效率降低的稱為別構抑制劑(allostericinhibitor)。酶活性受別構劑調節的作用稱為別構調節(allosteric regulation)作用.別構酶的催化位點與別構位點可共處一個亞基的不同部位,但更多的是分別處於不同亞基上.在後一種情況下具催化位點的亞基稱催化亞基,而具別構位點的稱調節亞基。多數別構酶處於代謝途徑的開端,而別構酶的別構劑往往是一些生理性小分子及該酶作用的底物或該代謝途徑的中間產物或終產物。故別構酶的催化活性受細胞內底物濃度、代謝中間物或終產物濃度的調節。終產物抑制該途徑中的別構酶稱反饋抑制(feedback inhibition).說明一旦細胞內終產物增多,它作為別構抑制劑抑制處於代謝途徑起始的酶,及時調整該代謝途徑的速度,以適應細胞生理機能的需要。別構酶在細胞物質代謝上的調節中發揮重要作用。故別構酶又稱調節酶。(regulatory enzyme)
六、修飾酶
體內有些酶需在其它酶作用下,對酶分子結構進行修飾後才具催化活性,這類酶稱為修飾酶(modification enzyme)。其中以共價修飾為多見,如酶蛋白的絲氨酸,蘇氨酸殘基的功能基團-OH可被磷酸化,這時伴有共價鍵的修飾變化生成,故稱共價修飾(covalent modification)。由於這種修飾導致酶活力改變稱為酶的共價修飾調節(covalent modification regulation)。體內最常見的共價修飾是酶的磷酸化與去磷酸化,此外還有酶的乙醯化與去乙醯化、尿苷酸化與去尿苷酸化、甲基化與去甲基化。由於共價修飾反應迅速,具有級聯式放大效應所以亦是體內調節物質代謝的重要方式。如催化糖原分解第一步反應的糖原磷酸化酶存在有活性和無活性兩種形式,有活性的稱為磷酸化酶a,無活性的稱為磷酸化酶b,這兩種形式的互變就是通過酶分子的磷酸化與去磷酸化的過程(詳見糖代謝章)
七、多酶複合體與多酶體系
體內有些酶彼此聚合在一起,組成一個物理的結合體,此結合體稱為多酶複合體(multienzyme complex)。若把多酶複合體解體,則各酶的催化活性消失。參與組成多酶複合體的酶有多有少,如催化丙酮酸氧化脫羧反應的丙酮酸脫氫酶多酶複合體由三種酶組成,而線上粒體中催化脂肪酸β-氧化的多酶複合體由四種酶組成。多酶複合體第一個酶催化反應的產物成為第二個酶作用的底物,如此連續進行,直至終產物生成.
多酶複合體由於有物理結合,在空間構象上有利於這種流水作業的快速進行,是生物體提高酶催化效率的一種有效措施。
體內物質代謝的各條途逕往往有許多酶共同參與,依次完成反應過程,這些酶不同於多酶複合體,在結構上無彼此關聯。故稱為多酶體系(multienzyme system)。如參與糖酵解的11個酶均存在於胞液,組成一個多酶體系。
八、多功能酶
近年來發現有些酶分子存在多種催化活性,例如大腸桿菌DNA聚合酶I是一條分子質量為109kDa的多肽鏈,具有催化DNA鏈的合成、3’-5’核酸外切酶和5’-3’核酸外切酶的活性,用蛋白水解酶輕度水解得兩個肽段,一個含5’-3’核酸外切酶活性,另一個含另兩種酶的活性,表明大腸桿菌DNA聚合酶分子中含多個活性中心。哺乳動物的脂肪酸合成酶由兩條多肽鏈組成,每一條多肽鏈均含脂肪酸合成所需的七種酶的催化活性。這種酶分子中存在多種催化活性部位的酶稱為多功能酶(multifunctional enzyme)或串聯酶(tandem enzyme)。多功能酶在分子結構上比多酶複合體更具有優越性,因為相關的化學反應在一個酶分子上進行,比多酶複合體更有效,這也是生物進化的結果。
共價催化(covalent catalysis):一個底物或底物的一部分與催化劑形成共價鍵,然後被轉移給第二個底物。許多酶催化的基團轉移反應都是通過共價方式進行的。
催化機理
酶的催化機理和一般化學催化劑基本相同,也是先和反應物(酶的底物)結合成絡合物,通過降低反應的能來提高化學反應的速度,在恆定溫度下,化學反應體系中每個反應物分子所含的能量雖然差別較大,但其平均值較低,這是反應的初態。
S(底物)→P(產物)這個反應之所以能夠進行,是因為有相當部分的S分子已被激活成為活化(過渡態)分子,活化分子越多,反應速度越快。在特定溫度時,化學反應的活化能是使1摩爾物質的全部分子成為活化分子所需的能量(千卡)。
酶(E)的作用是:與S暫時結合形成一個新化合物ES,ES的活化狀態(過渡態)比無催化劑的該化學反應中反應物活化分子含有的能量低得多。ES再反應產生P,同時釋放E。E可與另外的S分子結合,再重複這個循環。降低整個反應所需的活化能,使在單位時間內有更多的分子進行反應,反應速度得以加快。如沒有催化劑存在時,過氧化氫分解為水和氧的反應(2H2O2→2H2O+O2)需要的活化能為每摩爾18千卡(1千卡=4.187焦耳),用過氧化氫酶催化此反應時,只需要活化能每摩爾2千卡,反應速度約增加10^11倍。
酶作用的分子基礎
一、酶的化學組成
按照酶的化學組成可將酶分為單純酶和結合酶兩大類。單純酶分子中只有胺基酸殘基組成的肽鏈,結合酶分子中則除了多肽鏈組成的蛋白質,還有非蛋白成分,如金屬離子、鐵卟啉或含B族維生素的小分子有機物。結合酶的蛋白質部分稱為酶蛋白(apoenzyme),非蛋白質部分統稱為輔助因子 (cofactor),兩者一起組成全酶(holoenzyme);只有全酶才有催化活性,如果兩者分開則酶活力消失。非蛋白質部分如鐵卟啉或含B族維生素的化合物若與酶蛋白以共價鍵相連的稱為輔基(prosthetic group),用透析或超濾等方法不能使它們與酶蛋白分開;反之兩者以非共價鍵相連的稱為輔酶(coenzyme),可用上述方法把兩者分開。表4-1為以金屬離子作結合酶輔助因子的一些例子。表4-2列出含B族維生素的幾種輔酶(基)及其參與的反應。
結合酶中的金屬離子有多方面功能,它們可能是酶活性中心的組成成分;有的可能在穩定酶分子的構象上起作用;有的可能作為橋樑使酶與底物相連線。輔酶與輔基在催化反應中作為氫(H+和e)或某些化學基團的載體,起傳遞氫或化學基團的作用。體內酶的種類很多,但酶的輔助因子種類並不多,從表4—1中已見到幾種酶均用某種相同的金屬離子作為輔助因子的例子,同樣的情況亦見於輔酶與輔基,如3-磷酸甘油醛脫氫酶和乳酸脫氫酶均以NAD+作為輔酶。酶催化反應的特異性決定於酶蛋白部分,而輔酶與輔基的作用是參與具體的反應過程中氫(H+和e)及一些特殊化學基團的運載。
二、酶的活性中心
酶屬生物大分子,分子質量至少在1萬以上,大的可達百萬。酶的催化作用有賴於酶分子的一級結構及空間結構的完整。若酶分子變性或亞基解聚均可導致酶活性喪失。一個值得注意的問題是酶所催化的反應物即底物(substrate),卻大多為小分物質它們的分子質量比酶要小几個數量級。
酶的活性中心(active center)只是酶分子中的很小部分,酶蛋白的大部分胺基酸殘基並不與底物接觸。組成酶活性中心的胺基酸殘基的側鏈存在不同的功能基團,如-NH2、-COOH、-SH、-OH和咪唑基等,它們來自酶分子多肽鏈的不同部位。有的基團在與底物結合時起結合基團(binding group)的作用,有的在催化反應中起催化基團(catalytic group)的作用。但有的基團既在結合中起作用,又在催化中起作用,所以常將活性部位的功能基團統稱為必需基團(essential group)。它們通過多肽鏈的盤曲摺疊,組成一個在酶分子表面、具有三維空間結構的孔穴或裂隙,以容納進入的底物與之結合(圖4-1)並催化底物轉變為產物,這個區域即稱為酶的活性中心。
而酶活性中心以外的功能集團則在形成並維持酶的空間構象上也是必需的,故稱為活性中心以外的必需基團。對需要輔助因子的酶來說,輔助因子也是活性中心的組成部分。酶催化反應的特異性實際上決定於酶活性中心的結合基團、催化基團及其空間結構。
三、酶的分子結構與催化活性的關係
酶的分子結構的基礎是其胺基酸的序列,它決定著酶的空間結構和活性中心的形成以及酶催化的專一性。如哺乳動物中的磷酸甘油醛脫氫酶的胺基酸殘基序列幾乎完全相同,說明相同的一級結構是酶催化同一反應的基礎。又如消化道的糜蛋白酶,胰蛋白酶和彈性蛋白酶都能水解食物蛋白質的肽鍵,但三者水解的肽鍵有各自的特異性,糜蛋白酶水解含芳香族胺基酸殘基提供羧基的肽鍵,胰蛋白酶水解賴氨酸等鹼性胺基酸殘基提供羧基的肽鍵,而彈性蛋白酶水解側鏈較小且不帶電荷胺基酸殘基提供羧基的肽鍵.這三種酶的胺基酸序列分析顯示40%左右的胺基酸序列相同,都以絲氨酸殘基作為酶的活性中心基團,三種酶在絲氨酸殘基周圍都有G1y-Asp-Ser-Gly-Pro序列,X線衍射研究提示這三種酶有相似的空間結構,這是它們都能水解肽鍵的基礎。而它們水解肽鍵時的特異性則來自酶的底物結合部位上胺基酸組成上有微小的差別所致。
圖說明這三個酶的底物結合部位均有一個袋形結構,糜蛋白酶該處能容納芳香基或非極性基;胰蛋白酶袋子底部稍有不同其中一個胺基酸殘基為天冬氨酸取代,使該處負電荷增強,故該處對帶正電荷的賴氨酸或精酸殘基結合有利;彈性蛋白酶口袋二側為纈氨酸和蘇氨酸殘基所取代,因此該處只能結合較小側鏈和不帶電荷的基團.說明酶的催化特異性與酶分子結構的緊密關係。
四、酶原與酶原激活(zymogen andactivation of zymogen)
有些酶如消化系統中的各種蛋白酶以無活性的前體形式合成和分泌,然後,輸送到特定的部位,當體內需要時,經特異性蛋白水解酶的作用轉變為有活性的酶而發揮作用。這些不具催化活性的酶的前體稱為酶原(zymogen)。如胃蛋白酶原(pepsinogen)、胰蛋白酶原(trypsinogen)和胰凝乳蛋白酶原(chymotrypsinogen)等。某種物質作用於酶原使之轉變成有活性的酶的過程稱為酶原的激活。使無活性的酶原轉變為有活性的酶的物質稱為活化素。活化素對於酶原的激活作用具有一定的特異性。
例如胰腺細胞合成的糜蛋白酶原為245個胺基酸殘基組成的單一肽鏈,分子內部有5對二硫鍵相連,該酶原的激活過程如圖4-3所示.首先由胰蛋白酶水解15位精氨酸和16位異亮氨酸殘基間的肽鍵,激活成有完全催化活性的p-糜蛋白酶,但此時酶分子尚未穩定,經p-糜蛋白酶自身催化,去除二分子二肽成為有催化活性井具穩定結構的α—糜蛋白酶。
在正常情況下,血漿中大多數凝血因子基本上是以無活性的酶原形式存在,只有當組織或血管內膜受損後,無活性的酶原才能轉變為有活性的酶,從而觸發一系列的級聯式酶促反應,最終導致可溶性的纖維蛋白原轉變為穩定的纖維蛋白多聚體,網羅血小板等形成血凝塊。
酶原激活的本質是切斷酶原分子中特異肽鍵或去除部分肽段後有利於酶活性中心的形成酶原激活有重要的生理意義,一方面它保證合成酶的細胞本身不受蛋白酶的消化破壞,另一方面使它們在特定的生理條件和規定的部位受到激活並發揮其生理作用。如組織或血管內膜受損後激活凝血因子;胃主細胞分泌的胃蛋白酶原和胰腺細胞分泌的糜蛋白酶原、胰蛋白酶原、彈性蛋白酶原等分別在胃和小腸激活成相應的活性酶,促進食物蛋白質的消化就是明顯的例證。特定肽鍵的斷裂所導致的酶原激活在生物體內廣泛存在,是生物體的一種重要的調控酶活性的方式。如果酶原的激活過程發生異常,將導致一系列疾病的發生。出血性胰腺炎的發生就是由於蛋白酶原在未進小腸時就被激活,激活的蛋白酶水解自身的胰腺細胞,導致胰腺出血、腫脹。
四、同工酶(isoenzyme)
同工酶的概念:即同工酶是一類催化相同的化學反應,但酶蛋白的分子結構、理化性質和免疫原性各不相同的一類酶。 它們存在於生物的同一種族或同一個體的不同組織,甚至在同一組織、同一細胞的不同細胞器中。至今已知的同工酶已不下幾十種,如己糖激酶,乳酸脫氫酶等,其中以乳酸脫氫酶(lactic acid dehydrogenase,LDH)研究得最為清楚。人和脊柱動物組織中,有五種分子形式,它們催化下列相同的化學反應:
五種同工酶均由四個亞基組成。LDH的亞基有骨骼肌型(M型)和心肌型(H型)之分,兩型亞基的胺基酸組成不同,由兩種亞基以不同比例組成的四聚體,存在五種LDH形式.即H4(LDHl)、H3M1(LDH2)、H2M2 (LDH3)、H1M3(LDH4)和M4 (LDH5)。
M、H亞基的胺基酸組成不同,這是由基因不同所決定。五種LDH中的M、H亞基比例各異,決定了它們理化性質的差別.通常用電冰法可把五種LDH分開,LDH1向正極泳動速度最快,而LDH5泳動最慢,其它幾種介於兩者之間,依次為LDH2、LDH3和LDH4(圖4-5) 圖4-5還說明了不同組織中各種LDH所含的量不同,心肌中以LDHl及LDH2的量較多,而骨骼肌及肝中LDH5和LDH4為主.不同組織中LDH同工酶譜的差異與組織利用乳酸的生理過程有關.LDH1和LDH2對乳酸的親和力大,使乳酸脫氫氧化成丙酮酸,有利於心肌從乳酸氧化中取得能量。LDH5和LDH4對丙酮酸的親和力大,有使丙酮酸還原為乳酸的作用,這與肌肉在無氧酵解中取得能量的生理過程相適應(詳見糖代謝章).在組織病變時這些同工酶釋放入血,由於同工酶在組織器官中分布差異,因此血清同工酶譜就有了變化。故臨床常用血清同工酶譜分析來診斷疾病(圖4-5)。
五、 別構酶
別構酶(allosteric enzyme)往往是具有四級結構的多亞基的寡聚酶,酶分子中除有催化作用的活性中心也稱催化位點(catalytic site)外;還有別構位點(allosteric site).後者是結合別構劑(allesteric effector)的位置,當它與別構劑結合時,酶的分子構象就會發生輕微變化,影響到催化位點對底物的親和力和催化效率。若別構劑結合使酶與底物親和力或催化效率增高的稱為別構激活劑(allostericactivator),反之使酶底物的r親和力或催化效率降低的稱為別構抑制劑(allostericinhibitor)。酶活性受別構劑調節的作用稱為別構調節(allosteric regulation)作用.別構酶的催化位點與別構位點可共處一個亞基的不同部位,但更多的是分別處於不同亞基上.在後一種情況下具催化位點的亞基稱催化亞基,而具別構位點的稱調節亞基。多數別構酶處於代謝途徑的開端,而別構酶的別構劑往往是一些生理性小分子及該酶作用的底物或該代謝途徑的中間產物或終產物。故別構酶的催化活性受細胞內底物濃度、代謝中間物或終產物濃度的調節。終產物抑制該途徑中的別構酶稱反饋抑制(feedback inhibition).說明一旦細胞內終產物增多,它作為別構抑制劑抑制處於代謝途徑起始的酶,及時調整該代謝途徑的速度,以適應細胞生理機能的需要。別構酶在細胞物質代謝上的調節中發揮重要作用。故別構酶又稱調節酶。(regulatory enzyme)
六、修飾酶
體內有些酶需在其它酶作用下,對酶分子結構進行修飾後才具催化活性,這類酶稱為修飾酶(modification enzyme)。其中以共價修飾為多見,如酶蛋白的絲氨酸,蘇氨酸殘基的功能基團-OH可被磷酸化,這時伴有共價鍵的修飾變化生成,故稱共價修飾(covalent modification)。由於這種修飾導致酶活力改變稱為酶的共價修飾調節(covalent modification regulation)。體內最常見的共價修飾是酶的磷酸化與去磷酸化,此外還有酶的乙醯化與去乙醯化、尿苷酸化與去尿苷酸化、甲基化與去甲基化。由於共價修飾反應迅速,具有級聯式放大效應所以亦是體內調節物質代謝的重要方式。如催化糖原分解第一步反應的糖原磷酸化酶存在有活性和無活性兩種形式,有活性的稱為磷酸化酶a,無活性的稱為磷酸化酶b,這兩種形式的互變就是通過酶分子的磷酸化與去磷酸化的過程(詳見糖代謝章)
七、多酶複合體與多酶體系
體內有些酶彼此聚合在一起,組成一個物理的結合體,此結合體稱為多酶複合體(multienzyme complex)。若把多酶複合體解體,則各酶的催化活性消失。參與組成多酶複合體的酶有多有少,如催化丙酮酸氧化脫羧反應的丙酮酸脫氫酶多酶複合體由三種酶組成,而線上粒體中催化脂肪酸β-氧化的多酶複合體由四種酶組成。多酶複合體第一個酶催化反應的產物成為第二個酶作用的底物,如此連續進行,直至終產物生成.
多酶複合體由於有物理結合,在空間構象上有利於這種流水作業的快速進行,是生物體提高酶催化效率的一種有效措施。
體內物質代謝的各條途逕往往有許多酶共同參與,依次完成反應過程,這些酶不同於多酶複合體,在結構上無彼此關聯。故稱為多酶體系(multienzyme system)。如參與糖酵解的11個酶均存在於胞液,組成一個多酶體系。
八、多功能酶
近年來發現有些酶分子存在多種催化活性,例如大腸桿菌DNA聚合酶I是一條分子質量為109kDa的多肽鏈,具有催化DNA鏈的合成、3’-5’核酸外切酶和5’-3’核酸外切酶的活性,用蛋白水解酶輕度水解得兩個肽段,一個含5’-3’核酸外切酶活性,另一個含另兩種酶的活性,表明大腸桿菌DNA聚合酶分子中含多個活性中心。哺乳動物的脂肪酸合成酶由兩條多肽鏈組成,每一條多肽鏈均含脂肪酸合成所需的七種酶的催化活性。這種酶分子中存在多種催化活性部位的酶稱為多功能酶(multifunctional enzyme)或串聯酶(tandem enzyme)。多功能酶在分子結構上比多酶複合體更具有優越性,因為相關的化學反應在一個酶分子上進行,比多酶複合體更有效,這也是生物進化的結果。
影響酶活力的因素
米契里斯(Michaelis)和門坦(Menten)根據中間產物學說推導出酶促反應速度方程式,即米-門公式(具體參考《環境工程微生物學》第四章微生物的生理)。由米門公式可知:酶促反應速度受酶濃度和底物濃度的影響,也受溫度、pH、激活劑和抑制劑的影響。
(1)酶濃度對酶促反應速度的影響
從米門公式和酶濃度與酶促反應速度的關係圖解可以看出:酶促反應速度與酶分子的濃度成正比。當底物分子濃度足夠時,酶分子越多,底物轉化的速度越快。但事實上,當酶濃度很高時,並不保持這種關係,曲線逐漸趨向平緩。根據分析,這可能是高濃度的底物夾帶夾帶有許多的抑制劑所致。
(2)底物濃度對酶促反應速度的影響
在生化反應中,若酶的濃度為定值,底物的起始濃度較低時,酶促反應速度與底物濃度成正比,即隨底物濃度的增加而增加。當所有的酶與底物結合生成中間產物後,即使在增加底物濃度,中間產物濃度也不會增加,酶促反應速度也不增加。
還可以得出,在底物濃度相同條件下,酶促反應速度與酶的初始濃度成正比。酶的初始濃度大,其酶促反應速度就大。
在實際測定中,即使酶濃度足夠高,隨底物濃度的升高,酶促反應速度並沒有因此增加,甚至受到抑制。其原因是:高濃度底物降低了水的有效濃度,降低了分子擴散性,從而降低了酶促反應速度。過量的底物聚集在酶分子上,生成無活性的中間產物,不能釋放出酶分子,從而也會降低反應速度。
(3)溫度對酶促反應速度的影響
各種酶在最適溫度範圍內,酶活性最強,酶促反應速度最大。在適宜的溫度範圍內,溫度每升高10℃,酶促反應速度可以相應提高1~2倍。不同生物體內酶的最適溫度不同。如,動物組織中各種酶的最適溫度為37~40℃;微生物體內各種酶的最適溫度為25~60℃,但也有例外,如黑曲糖化酶的最適溫度為62~64℃;巨大芽孢桿菌、短乳酸桿菌、產氣桿菌等體內的葡萄糖異構酶的最適溫度為80℃;枯草桿菌的液化型澱粉酶的最適溫度為85~94℃。可見,一些芽孢桿菌的酶的熱穩定性較高。過高或過低的溫度都會降低酶的催化效率,即降低酶促反應速度。
最適溫度在60℃以下的酶,當溫度達到60~80℃時,大部分酶被破壞,發生不可逆變性;當溫度接近100℃時,酶的催化作用完全喪失。
(4)pH對酶促反應速度的影響
酶在最適pH範圍內表現出活性,大於或小於最適pH,都會降低酶活性。主要表現在兩個方面:①改變底物分子和酶分子的帶電狀態,從而影響酶和底物的結合;②過高或過低的pH都會影響酶的穩定性,進而使酶遭受不可逆破壞。
(5)激活劑對酶促反應速度的影響
能激活酶的物質稱為酶的激活劑。激活劑種類很多,有①無機陽離子,如鈉離子、鉀離子、銅離子、鈣離子等;②無機陰離子,如氯離子、溴離子、碘離子、硫酸鹽離子磷酸鹽離子等;③有機化合物,如維生素C、半胱氨酸、還原性谷胱甘肽等。許多酶只有當某一種適當的激活劑存在時,才表現出催化活性或強化其催化活性,這稱為對酶的激活作用。而有些酶被合成後呈現無活性狀態,這種酶稱為酶原。它必須經過適當的激活劑激活後才具活性。
(6)抑制劑對酶促反應速度的影響
能減弱、抑制甚至破壞酶活性的物質稱為酶的抑制劑。它可降低酶促反應速度。酶的抑制劑有重金屬離子、一氧化碳、硫化氫、氫氰酸、氟化物、碘化乙酸、生物鹼、染料、對-氯汞苯甲酸、二異丙基氟磷酸、乙二胺四乙酸、表面活性劑等。
對酶促反應的抑制可分為競爭性抑制和非競爭性抑制。與底物結構類似的物質爭先與酶的活性中心結合,從而降低酶促反應速度,這種作用稱為競爭性抑制。競爭性抑制是可逆性抑制,通過增加底物濃度最終可解除抑制,恢復酶的活性。與底物結構類似的物質稱為競爭性抑制劑。抑制劑與酶活性中心以外的位點結合後,底物仍可與酶活性中心結合,但酶不顯示活性,這種作用稱為非競爭性抑制。非競爭性抑制是不可逆的,增加底物濃度並不能解除對酶活性的抑制。與酶活性中心以外的位點結合的抑制劑,稱為非競爭性抑制劑。
有的物質既可作為一種酶的抑制劑,又可作為另一種酶的激活劑。
(1)酶濃度對酶促反應速度的影響
從米門公式和酶濃度與酶促反應速度的關係圖解可以看出:酶促反應速度與酶分子的濃度成正比。當底物分子濃度足夠時,酶分子越多,底物轉化的速度越快。但事實上,當酶濃度很高時,並不保持這種關係,曲線逐漸趨向平緩。根據分析,這可能是高濃度的底物夾帶夾帶有許多的抑制劑所致。
(2)底物濃度對酶促反應速度的影響
在生化反應中,若酶的濃度為定值,底物的起始濃度較低時,酶促反應速度與底物濃度成正比,即隨底物濃度的增加而增加。當所有的酶與底物結合生成中間產物後,即使在增加底物濃度,中間產物濃度也不會增加,酶促反應速度也不增加。
還可以得出,在底物濃度相同條件下,酶促反應速度與酶的初始濃度成正比。酶的初始濃度大,其酶促反應速度就大。
在實際測定中,即使酶濃度足夠高,隨底物濃度的升高,酶促反應速度並沒有因此增加,甚至受到抑制。其原因是:高濃度底物降低了水的有效濃度,降低了分子擴散性,從而降低了酶促反應速度。過量的底物聚集在酶分子上,生成無活性的中間產物,不能釋放出酶分子,從而也會降低反應速度。
(3)溫度對酶促反應速度的影響
各種酶在最適溫度範圍內,酶活性最強,酶促反應速度最大。在適宜的溫度範圍內,溫度每升高10℃,酶促反應速度可以相應提高1~2倍。不同生物體內酶的最適溫度不同。如,動物組織中各種酶的最適溫度為37~40℃;微生物體內各種酶的最適溫度為25~60℃,但也有例外,如黑曲糖化酶的最適溫度為62~64℃;巨大芽孢桿菌、短乳酸桿菌、產氣桿菌等體內的葡萄糖異構酶的最適溫度為80℃;枯草桿菌的液化型澱粉酶的最適溫度為85~94℃。可見,一些芽孢桿菌的酶的熱穩定性較高。過高或過低的溫度都會降低酶的催化效率,即降低酶促反應速度。
最適溫度在60℃以下的酶,當溫度達到60~80℃時,大部分酶被破壞,發生不可逆變性;當溫度接近100℃時,酶的催化作用完全喪失。
(4)pH對酶促反應速度的影響
酶在最適pH範圍內表現出活性,大於或小於最適pH,都會降低酶活性。主要表現在兩個方面:①改變底物分子和酶分子的帶電狀態,從而影響酶和底物的結合;②過高或過低的pH都會影響酶的穩定性,進而使酶遭受不可逆破壞。
(5)激活劑對酶促反應速度的影響
能激活酶的物質稱為酶的激活劑。激活劑種類很多,有①無機陽離子,如鈉離子、鉀離子、銅離子、鈣離子等;②無機陰離子,如氯離子、溴離子、碘離子、硫酸鹽離子磷酸鹽離子等;③有機化合物,如維生素C、半胱氨酸、還原性谷胱甘肽等。許多酶只有當某一種適當的激活劑存在時,才表現出催化活性或強化其催化活性,這稱為對酶的激活作用。而有些酶被合成後呈現無活性狀態,這種酶稱為酶原。它必須經過適當的激活劑激活後才具活性。
(6)抑制劑對酶促反應速度的影響
能減弱、抑制甚至破壞酶活性的物質稱為酶的抑制劑。它可降低酶促反應速度。酶的抑制劑有重金屬離子、一氧化碳、硫化氫、氫氰酸、氟化物、碘化乙酸、生物鹼、染料、對-氯汞苯甲酸、二異丙基氟磷酸、乙二胺四乙酸、表面活性劑等。
對酶促反應的抑制可分為競爭性抑制和非競爭性抑制。與底物結構類似的物質爭先與酶的活性中心結合,從而降低酶促反應速度,這種作用稱為競爭性抑制。競爭性抑制是可逆性抑制,通過增加底物濃度最終可解除抑制,恢復酶的活性。與底物結構類似的物質稱為競爭性抑制劑。抑制劑與酶活性中心以外的位點結合後,底物仍可與酶活性中心結合,但酶不顯示活性,這種作用稱為非競爭性抑制。非競爭性抑制是不可逆的,增加底物濃度並不能解除對酶活性的抑制。與酶活性中心以外的位點結合的抑制劑,稱為非競爭性抑制劑。
有的物質既可作為一種酶的抑制劑,又可作為另一種酶的激活劑。
酶的分類
根據酶所催化的反應性質的不同,將酶分成六大類:
1.氧化還原酶類(oxidoreductase)
促進底物的氧化或還原。
2.轉移酶類(transferases)
促進不同物質分子間某種化學基團的交換或轉移。
3.水解酶類(hydrolases )
促進水解反應。
4.裂解酶類(lyases)
催化從底物分子雙鍵上加基團或脫基團反應,即促進一種化合物分裂為兩種化合物,或由兩種化合物合成一種化合物。
5.異構酶類(isomerases)
促進同分異構體互相轉化,即催化底物分子內部的重排反應。
6.合成酶類(ligase)
促進兩分子化合物互相結合,同時ATP分子(或其它三磷酸核苷)中的高能磷酸鍵斷裂,即催化分子間締合反應。
按照國際生化協會公布的酶的統一分類原則,在上述六大類基礎上,在每一大類酶中又根據底物中被作用的基團或鍵的特點,分為若干亞類;為了更精確地表明底物或反應物的性質,每一個亞類再分為幾個組(亞亞類);每個組中直接包含若干個酶。
例如:乳酸脫氫酶(EC1.1.1.27)催化下列反應:
圖例1
其編號解釋如下:
圖例2
1.氧化還原酶類(oxidoreductase)
促進底物的氧化或還原。
2.轉移酶類(transferases)
促進不同物質分子間某種化學基團的交換或轉移。
3.水解酶類(hydrolases )
促進水解反應。
4.裂解酶類(lyases)
催化從底物分子雙鍵上加基團或脫基團反應,即促進一種化合物分裂為兩種化合物,或由兩種化合物合成一種化合物。
5.異構酶類(isomerases)
促進同分異構體互相轉化,即催化底物分子內部的重排反應。
6.合成酶類(ligase)
促進兩分子化合物互相結合,同時ATP分子(或其它三磷酸核苷)中的高能磷酸鍵斷裂,即催化分子間締合反應。
按照國際生化協會公布的酶的統一分類原則,在上述六大類基礎上,在每一大類酶中又根據底物中被作用的基團或鍵的特點,分為若干亞類;為了更精確地表明底物或反應物的性質,每一個亞類再分為幾個組(亞亞類);每個組中直接包含若干個酶。
例如:乳酸脫氫酶(EC1.1.1.27)催化下列反應:
圖例1
其編號解釋如下:
圖例2
甘油磷酸酶(圖)甘油磷酸酶
 甘油磷酸酶
甘油磷酸酶 甘油磷酸酶
甘油磷酸酶酶的命名
通常有習慣命名和系統命名兩種方法。
【習慣命名】
常根據兩個原則:
1.根據酶所催化的底物:如水解澱粉的酶稱為澱粉酶,水解蛋白質的稱為蛋白酶;有時還加上來源,以區別不同來源的同一類酶,如胃蛋白酶、胰蛋白酶等等。
2.根據酶所催化的反應類型:催化底物分子水解的稱為水解酶,催化還原反應的稱為還原酶。
也有根據上述兩項原則綜合命名或加上酶的其它特點,如琥珀酸脫氫酶、鹼性磷酸酶等等。
習慣命名較簡單,習用較久,但缺乏系統性又不甚合理,以致造成某些酶的名稱混亂。如:腸激酶和肌激酶,從字面看,很似來源不同而作用相似的兩種酶,實際上它們的作用方式截然不同。又比如:銅硫解酶和乙醯輔酶A轉醯基酶實際上是同一種酶,但名稱卻完全不同。
鑒於上述情況和新發現的酶不斷增加,為適應酶學發展的新情況,國際生化協會酶委員會推薦了一套系統的酶命名方案和分類方法,決定每一種酶應有系統名稱和習慣名稱。同時每一種酶有一個固定編號。
【系統命名】
酶的系統命名是以酶所催化的整體反應為基礎的。規定,每種酶的名稱應明確寫出底物名稱及其催化性質。若酶反應中有兩種底物起反應,則這兩種底物均需列出,當中用“:”分隔開。
例如:谷丙轉氨酶(習慣名稱)寫成系統名時,應將它的兩個底物“L-丙氨酸”“α-酮戊二酸”同時列出,它所催化的反應性質為轉氨基,也需指明,故其名稱為“L-丙氨酸:α-酮戊二酸轉氨酶”。
由於系統命名一般都很長,使用時不方便,因此敘述時可採用習慣名。
[編輯本段]酶促反應
一、酶促反應的特點
(一)酶促反應具有高度的催化速率
酶是高效生物催化劑,比一般催化劑的效率高107-1013倍。酶能加快化學反應的速度,但酶不能改變化學反應的平衡點,也就是說酶在促進正向反應的同時也以相同的比例促進逆向的反應,所以酶的作用是縮短了到達平衡所需的時間,但平衡常數不變,在無酶的情況下達到平衡點需幾個小時,在有酶時可能只要幾秒鐘就可達到平衡。
酶和一般催化劑都是通過降低反應活化能的機制來加快化學反應速度的。
(二) 酶催化具有高度特異性
酶的催化特異性表現在它對底物的選擇性和催化反應的特異性兩方面。體內的化學反應除了個別自發進行外,絕大多數都由專一的酶催化,一種酶能從成千上萬種反應物中找出自己作用的底物,這就是酶的特異性。根據酶催化特異性程度上的差別,分為絕對特異性(absolute specificity)、相對特異性(relative specificity)和立體異構特異性(stereospecificity)三類。一種酶只催化一種底物進行反應的稱絕對特異性,如脲酶只能水解尿素使其分解為二氧化碳和氨;若一種酶能催化一類化合物或一類化學鍵進行反應的稱為相對特異性,如酯酶既能催化甘油三脂水解,又能水解其他酯鍵。具有立體異構特異性的酶對底物分子立體構型有嚴格要求,如L乳酸脫氫酶只催化L-乳酸脫氫,對D-乳酸無作用。
(三) 酶活性的可調節性
有些酶的催化活性可受許多因素的影響,如別構酶受別構劑的調節,有的酶受共價修飾的調節,激素和神經體液通過第二信使對酶活力進行調節,以及誘導劑或阻抑劑對細胞內酶含量(改變酶合成與分解速度)的調節等。
二、酶促反應的作用機制
酶(E)與底物(S)形成酶-底物複合物(ES)
酶的活性中心與底物定向結合生成ES複合物是酶催化作用的第一步。定向結合的能量來自酶活性中心功能基團與底物相互作用時形成的多種非共價鍵,如離子鍵、氫鍵、疏水鍵,也包括范德瓦力。它們結合時產生的能量稱為結合能(binding energy)。這就不難理解各個酶對自己的底物的結合有選擇性。
(二)酶與底物的過渡狀態互補
若酶只與底物互補生成ES複合物,不能進一步促使底物進入過渡狀態,那么酶的催化作用不能發生。這是因為酶與底物生成ES複合物後尚需通過酶與底物分子間形成更多的非共價鍵,生成酶與底物的過渡狀態互補的複合物(圖4-8),才能完成酶的催化作用。實際上在上述更多的非共價鍵生成的過程中底物分子由原來的基態轉變成過渡狀態。即底物分子成為活化分子,為底物分子進行化學反應所需的基團的組合排布、瞬間的不穩定的電荷的生成以及其他的轉化等提供了條件。所以過渡狀態不是一種穩定的化學物質,不同於反應過程中的中間產物。就分子的過渡狀態而言,它轉變為產物(P)或轉變為底物(S)的機率是相等的。
當酶與底物生成ES複合物並進一步形成過渡狀態,這過程已釋放較多的結合能,現知這部分結合能可以抵消部分反應物分子活化所需的活化能,從而使原先低於活化能閾的分子也成為活化分子,於是加速化學反應的速度
(三)酶促反應作用機制
1.鄰近效應與定向排列
2.多元催化(multielement catalysis)
3.表面效應(surface effect)
應該指出的是,一種酶的催化反應常常是多種催化機制的綜合作用,這是酶促反應高效率的重要原因。
【習慣命名】
常根據兩個原則:
1.根據酶所催化的底物:如水解澱粉的酶稱為澱粉酶,水解蛋白質的稱為蛋白酶;有時還加上來源,以區別不同來源的同一類酶,如胃蛋白酶、胰蛋白酶等等。
2.根據酶所催化的反應類型:催化底物分子水解的稱為水解酶,催化還原反應的稱為還原酶。
也有根據上述兩項原則綜合命名或加上酶的其它特點,如琥珀酸脫氫酶、鹼性磷酸酶等等。
習慣命名較簡單,習用較久,但缺乏系統性又不甚合理,以致造成某些酶的名稱混亂。如:腸激酶和肌激酶,從字面看,很似來源不同而作用相似的兩種酶,實際上它們的作用方式截然不同。又比如:銅硫解酶和乙醯輔酶A轉醯基酶實際上是同一種酶,但名稱卻完全不同。
鑒於上述情況和新發現的酶不斷增加,為適應酶學發展的新情況,國際生化協會酶委員會推薦了一套系統的酶命名方案和分類方法,決定每一種酶應有系統名稱和習慣名稱。同時每一種酶有一個固定編號。
【系統命名】
酶的系統命名是以酶所催化的整體反應為基礎的。規定,每種酶的名稱應明確寫出底物名稱及其催化性質。若酶反應中有兩種底物起反應,則這兩種底物均需列出,當中用“:”分隔開。
例如:谷丙轉氨酶(習慣名稱)寫成系統名時,應將它的兩個底物“L-丙氨酸”“α-酮戊二酸”同時列出,它所催化的反應性質為轉氨基,也需指明,故其名稱為“L-丙氨酸:α-酮戊二酸轉氨酶”。
由於系統命名一般都很長,使用時不方便,因此敘述時可採用習慣名。
[編輯本段]酶促反應
一、酶促反應的特點
(一)酶促反應具有高度的催化速率
酶是高效生物催化劑,比一般催化劑的效率高107-1013倍。酶能加快化學反應的速度,但酶不能改變化學反應的平衡點,也就是說酶在促進正向反應的同時也以相同的比例促進逆向的反應,所以酶的作用是縮短了到達平衡所需的時間,但平衡常數不變,在無酶的情況下達到平衡點需幾個小時,在有酶時可能只要幾秒鐘就可達到平衡。
酶和一般催化劑都是通過降低反應活化能的機制來加快化學反應速度的。
(二) 酶催化具有高度特異性
酶的催化特異性表現在它對底物的選擇性和催化反應的特異性兩方面。體內的化學反應除了個別自發進行外,絕大多數都由專一的酶催化,一種酶能從成千上萬種反應物中找出自己作用的底物,這就是酶的特異性。根據酶催化特異性程度上的差別,分為絕對特異性(absolute specificity)、相對特異性(relative specificity)和立體異構特異性(stereospecificity)三類。一種酶只催化一種底物進行反應的稱絕對特異性,如脲酶只能水解尿素使其分解為二氧化碳和氨;若一種酶能催化一類化合物或一類化學鍵進行反應的稱為相對特異性,如酯酶既能催化甘油三脂水解,又能水解其他酯鍵。具有立體異構特異性的酶對底物分子立體構型有嚴格要求,如L乳酸脫氫酶只催化L-乳酸脫氫,對D-乳酸無作用。
(三) 酶活性的可調節性
有些酶的催化活性可受許多因素的影響,如別構酶受別構劑的調節,有的酶受共價修飾的調節,激素和神經體液通過第二信使對酶活力進行調節,以及誘導劑或阻抑劑對細胞內酶含量(改變酶合成與分解速度)的調節等。
二、酶促反應的作用機制
酶(E)與底物(S)形成酶-底物複合物(ES)
酶的活性中心與底物定向結合生成ES複合物是酶催化作用的第一步。定向結合的能量來自酶活性中心功能基團與底物相互作用時形成的多種非共價鍵,如離子鍵、氫鍵、疏水鍵,也包括范德瓦力。它們結合時產生的能量稱為結合能(binding energy)。這就不難理解各個酶對自己的底物的結合有選擇性。
(二)酶與底物的過渡狀態互補
若酶只與底物互補生成ES複合物,不能進一步促使底物進入過渡狀態,那么酶的催化作用不能發生。這是因為酶與底物生成ES複合物後尚需通過酶與底物分子間形成更多的非共價鍵,生成酶與底物的過渡狀態互補的複合物(圖4-8),才能完成酶的催化作用。實際上在上述更多的非共價鍵生成的過程中底物分子由原來的基態轉變成過渡狀態。即底物分子成為活化分子,為底物分子進行化學反應所需的基團的組合排布、瞬間的不穩定的電荷的生成以及其他的轉化等提供了條件。所以過渡狀態不是一種穩定的化學物質,不同於反應過程中的中間產物。就分子的過渡狀態而言,它轉變為產物(P)或轉變為底物(S)的機率是相等的。
當酶與底物生成ES複合物並進一步形成過渡狀態,這過程已釋放較多的結合能,現知這部分結合能可以抵消部分反應物分子活化所需的活化能,從而使原先低於活化能閾的分子也成為活化分子,於是加速化學反應的速度
(三)酶促反應作用機制
1.鄰近效應與定向排列
2.多元催化(multielement catalysis)
3.表面效應(surface effect)
應該指出的是,一種酶的催化反應常常是多種催化機制的綜合作用,這是酶促反應高效率的重要原因。
酶的套用
一.酶在生物體內
在生物體內的酶是具有生物活性的蛋白質,存在於生物體內的細胞和組織中,作為生物體內化學反應的催化劑,不斷地進行自我更新,使生物體內及其複雜的代謝活動不斷地、有條不紊地進行.
酶的催化效率特別高(即高效性),比一般的化學催化劑的效率高10^7~10^18倍,這就是生物體內許多化學反應很容易進行的原因之一.
酶的催化具有高度的化學選擇性和專一性.一種酶往往只能對某一種或某一類反應起催化作用,且酶和被催化的反應物在結構上往往有相似性.
一般在37℃左右,接近中性的環境下,酶的催化效率就非常高,雖然它與一般催化劑一樣,隨著溫度升高,活性也提高,但由於酶是蛋白質,因此溫度過高,會失去活性(變性),因此酶的催化溫度一般不能高於60℃,否則,酶的催化效率就會降低,甚至會失去催化作用.強酸、強鹼、重金屬離子、紫外線等的存在,也都會影響酶的催化作用.
人體記憶體在大量酶,結構複雜,種類繁多,到目前為止,已發現3000種以上(即多樣性).如米飯在口腔內咀嚼時,咀嚼時間越長,甜味越明顯,是由於米飯中的澱粉在口腔分泌出的唾液澱粉酶的作用下,水解成葡萄糖的緣故.因此,吃飯時多咀嚼可以讓食物與唾液充分混合,有利於消化.此外人體內還有胃蛋白酶,胰蛋白酶等多種水解酶.人體從食物中攝取的蛋白質,必須在胃蛋白酶等作用下,水解成胺基酸,然後再在其它酶的作用下,選擇人體所需的20多種胺基酸,按照一定的順序重新結合成人體所需的各種蛋白質,這其中發生了許多複雜的化學反應.可以這樣說,沒有酶就沒有生物的新陳代謝,也就沒有自然界中形形色色、豐富多彩的生物界.
二.酶在醫療上
隨著對酶研究的發展,酶在醫學上的重要性越來越引起了人們的注意,套用越來越廣泛.下面分三個方面介紹.
1.酶與某些疾病的關係
酶缺乏所致之疾病多為先天性或遺傳性,如白化症是因酪氨酸羥化酶缺乏,蠶豆病或對伯氨喹啉敏感患者是因6-磷酸葡萄糖脫氫酶缺乏.許多中毒性疾病幾乎都是由於某些酶被抑制所引起的.如常用的有機磷農藥(如敵百蟲、敵敵畏、1059以及樂果等)中毒時,就是因它們與膽鹼酯酶活性中心必需基團絲氨酸上的一個-OH結合而使酶失去活性.膽鹼酯酶能催化乙醯膽鹼水解成膽鹼和乙酸,當膽鹼酯酶被抑制失活後,乙醯膽鹼水解作用受抑,造成乙醯膽鹼推積,出現一系列中毒症狀,如肌肉震顫、瞳孔縮小、多汗、心跳減慢等.某些金屬離子引起人體中毒,則是因金屬離子(如Hg2+)可與某些酶活性中心的必需基團(如半胱氨酸的-SH)結合而使酶失去活性.
2.酶在疾病診斷上的套用
正常人體內酶活性較穩定,當人體某些器官和組織受損或發生疾病後,某些酶被釋放入血、尿或體液內.如急性胰腺炎時,血清和尿中澱粉酶活性顯著升高;肝炎和其它原因肝臟受損,肝細胞壞死或通透性增強,大量轉氨酶釋放入血,使血清轉氨酶升高;心肌梗塞時,血清乳酸脫氫酶和磷酸肌酸激酶明顯升高;當有機磷農藥中毒時,膽鹼酯酶活性受抑制,血清膽鹼酯酶活性下降;某些肝膽疾病,特別是膽道梗阻時,血清r-谷氨醯移換酶增高等等.因此,藉助血、尿或體液內酶的活性測定,可以了解或判定某些疾病的發生和發展.
3.酶在臨床治療上的套用
近年來,酶療法已逐漸被人們所認識,廣泛受到重視,各種酶製劑在臨床上的套用越來越普遍.如胰蛋白酶、糜蛋白酶等,能催化蛋白質分解,此原理已用於外科擴創,化膿傷口淨化及胸、腹腔漿膜粘連的治療等.在血栓性靜脈炎、心肌梗塞、肺梗塞以及瀰漫性血管內凝血等病的治療中,可套用纖溶酶、鏈激酶、尿激酶等,以溶解血塊,防止血栓的形成等.
一些輔酶,如輔酶A、輔酶Q等,可用於腦、心、肝、腎等重要臟器的輔助治療.另外,還利用酶的競爭性抑制的原理,合成一些化學藥物,進行抑菌、殺菌和抗腫瘤等的治療.如磺胺類藥和許多抗菌素能抑制某些細菌生長所必需的酶類,故有抑菌和殺菌作用;許多抗腫瘤藥物能抑制細胞內與核酸或蛋白質合成有關的酶類,從而抑制瘤細胞的分化和增殖,以對抗腫瘤的生長;硫氧嘧啶可抑制碘化酶,從而影響甲狀腺素的合成,故可用於治療甲狀腺機能亢進等.
三.酶在生產、生活中
如釀酒工業中使用的酵母菌,就是通過有關的微生物產生的,酶的作用將澱粉等通過水解、氧化等過程,最後轉化為酒精;醬油、食醋的生產也是在酶的作用下完成的;用澱粉酶和纖維素酶處理過的飼料,營養價值提高;洗衣粉中加入酶,可以使洗衣粉效率提高,使原來不易除去的汗漬等很容易除去等等……
由於酶的套用廣泛,酶的提取和合成就成了重要的研究課題.目前酶可以從生物體內提取,如從鳳梨皮中可提取鳳梨蛋白酶.但由於酶在生物體內的含量很低,因此,它不能適應生產上的需要.工業上大量的酶是採用微生物的發酵來製取的.一般需要在適宜的條件下,選育出所需的菌種,讓其進行繁殖,獲得大量的酶製劑.另外,人們正在研究酶的人工合成.總之隨著科學水平的提高,酶的套用將具有非常廣闊的前景.
在生物體內的酶是具有生物活性的蛋白質,存在於生物體內的細胞和組織中,作為生物體內化學反應的催化劑,不斷地進行自我更新,使生物體內及其複雜的代謝活動不斷地、有條不紊地進行.
酶的催化效率特別高(即高效性),比一般的化學催化劑的效率高10^7~10^18倍,這就是生物體內許多化學反應很容易進行的原因之一.
酶的催化具有高度的化學選擇性和專一性.一種酶往往只能對某一種或某一類反應起催化作用,且酶和被催化的反應物在結構上往往有相似性.
一般在37℃左右,接近中性的環境下,酶的催化效率就非常高,雖然它與一般催化劑一樣,隨著溫度升高,活性也提高,但由於酶是蛋白質,因此溫度過高,會失去活性(變性),因此酶的催化溫度一般不能高於60℃,否則,酶的催化效率就會降低,甚至會失去催化作用.強酸、強鹼、重金屬離子、紫外線等的存在,也都會影響酶的催化作用.
人體記憶體在大量酶,結構複雜,種類繁多,到目前為止,已發現3000種以上(即多樣性).如米飯在口腔內咀嚼時,咀嚼時間越長,甜味越明顯,是由於米飯中的澱粉在口腔分泌出的唾液澱粉酶的作用下,水解成葡萄糖的緣故.因此,吃飯時多咀嚼可以讓食物與唾液充分混合,有利於消化.此外人體內還有胃蛋白酶,胰蛋白酶等多種水解酶.人體從食物中攝取的蛋白質,必須在胃蛋白酶等作用下,水解成胺基酸,然後再在其它酶的作用下,選擇人體所需的20多種胺基酸,按照一定的順序重新結合成人體所需的各種蛋白質,這其中發生了許多複雜的化學反應.可以這樣說,沒有酶就沒有生物的新陳代謝,也就沒有自然界中形形色色、豐富多彩的生物界.
二.酶在醫療上
隨著對酶研究的發展,酶在醫學上的重要性越來越引起了人們的注意,套用越來越廣泛.下面分三個方面介紹.
1.酶與某些疾病的關係
酶缺乏所致之疾病多為先天性或遺傳性,如白化症是因酪氨酸羥化酶缺乏,蠶豆病或對伯氨喹啉敏感患者是因6-磷酸葡萄糖脫氫酶缺乏.許多中毒性疾病幾乎都是由於某些酶被抑制所引起的.如常用的有機磷農藥(如敵百蟲、敵敵畏、1059以及樂果等)中毒時,就是因它們與膽鹼酯酶活性中心必需基團絲氨酸上的一個-OH結合而使酶失去活性.膽鹼酯酶能催化乙醯膽鹼水解成膽鹼和乙酸,當膽鹼酯酶被抑制失活後,乙醯膽鹼水解作用受抑,造成乙醯膽鹼推積,出現一系列中毒症狀,如肌肉震顫、瞳孔縮小、多汗、心跳減慢等.某些金屬離子引起人體中毒,則是因金屬離子(如Hg2+)可與某些酶活性中心的必需基團(如半胱氨酸的-SH)結合而使酶失去活性.
2.酶在疾病診斷上的套用
正常人體內酶活性較穩定,當人體某些器官和組織受損或發生疾病後,某些酶被釋放入血、尿或體液內.如急性胰腺炎時,血清和尿中澱粉酶活性顯著升高;肝炎和其它原因肝臟受損,肝細胞壞死或通透性增強,大量轉氨酶釋放入血,使血清轉氨酶升高;心肌梗塞時,血清乳酸脫氫酶和磷酸肌酸激酶明顯升高;當有機磷農藥中毒時,膽鹼酯酶活性受抑制,血清膽鹼酯酶活性下降;某些肝膽疾病,特別是膽道梗阻時,血清r-谷氨醯移換酶增高等等.因此,藉助血、尿或體液內酶的活性測定,可以了解或判定某些疾病的發生和發展.
3.酶在臨床治療上的套用
近年來,酶療法已逐漸被人們所認識,廣泛受到重視,各種酶製劑在臨床上的套用越來越普遍.如胰蛋白酶、糜蛋白酶等,能催化蛋白質分解,此原理已用於外科擴創,化膿傷口淨化及胸、腹腔漿膜粘連的治療等.在血栓性靜脈炎、心肌梗塞、肺梗塞以及瀰漫性血管內凝血等病的治療中,可套用纖溶酶、鏈激酶、尿激酶等,以溶解血塊,防止血栓的形成等.
一些輔酶,如輔酶A、輔酶Q等,可用於腦、心、肝、腎等重要臟器的輔助治療.另外,還利用酶的競爭性抑制的原理,合成一些化學藥物,進行抑菌、殺菌和抗腫瘤等的治療.如磺胺類藥和許多抗菌素能抑制某些細菌生長所必需的酶類,故有抑菌和殺菌作用;許多抗腫瘤藥物能抑制細胞內與核酸或蛋白質合成有關的酶類,從而抑制瘤細胞的分化和增殖,以對抗腫瘤的生長;硫氧嘧啶可抑制碘化酶,從而影響甲狀腺素的合成,故可用於治療甲狀腺機能亢進等.
三.酶在生產、生活中
如釀酒工業中使用的酵母菌,就是通過有關的微生物產生的,酶的作用將澱粉等通過水解、氧化等過程,最後轉化為酒精;醬油、食醋的生產也是在酶的作用下完成的;用澱粉酶和纖維素酶處理過的飼料,營養價值提高;洗衣粉中加入酶,可以使洗衣粉效率提高,使原來不易除去的汗漬等很容易除去等等……
由於酶的套用廣泛,酶的提取和合成就成了重要的研究課題.目前酶可以從生物體內提取,如從鳳梨皮中可提取鳳梨蛋白酶.但由於酶在生物體內的含量很低,因此,它不能適應生產上的需要.工業上大量的酶是採用微生物的發酵來製取的.一般需要在適宜的條件下,選育出所需的菌種,讓其進行繁殖,獲得大量的酶製劑.另外,人們正在研究酶的人工合成.總之隨著科學水平的提高,酶的套用將具有非常廣闊的前景.
