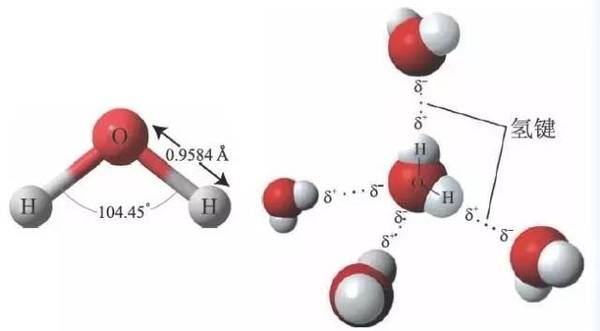
氫鍵含義
分子間氫鍵一般粘度較大。例如
甘油、
磷酸、
濃硫酸等多
羥基化合物,由於分子間可形成眾多的
氫鍵,這些物質通常為粘稠狀液體。
熔點、
沸點分子間有氫鍵的物質熔化或氣化時,除了要克服純粹的分子間力外,還必須提高溫度,額外地供應一份能量來破壞分子間的氫鍵,所以這些物質的熔點、沸點比同系列
氫化物的熔點、沸點高。分子內生成氫鍵,熔、沸點常降低。例如有分子內氫鍵的
鄰硝基苯酚熔點(45℃)比有分子間氫鍵的間位熔點(96℃)和對位熔點(114℃)都低。
氫鍵形成
氫鍵分類
分子間氫鍵
現以HF為例說明
氫鍵的形成。在HF分子中,由於F的
電負性(4.0)很大,
共用電子對強烈偏向F原子一邊,而H
原子核外只有一個電子,其
電子云向F原子偏移的結果,使得它幾乎要
呈質子狀態。這個半徑很小、無內層電子的帶部分
正電荷的氫原子,使附近另一個HF分子中含有
孤電子對並帶部分負電荷的F原子有可能充分靠近它,從而產生靜電吸引作用。這個靜電吸引作用力就是所謂氫鍵。不同種分子之間僅同種分子之間可以存在氫鍵,某些不同種分子之間也可能形成氫鍵。
分子內氫鍵
某些分子內,例如HNO
3、
鄰硝基苯酚分子可以形成分子內
氫鍵。分子內氫鍵由於受環狀結構的限制,X-H…Y往往不能在同一直線上。
形成條件
⑴與
電負性很大的原子A形成強
極性鍵的氫原子⑵較小半徑、較大電負性、含
孤電子對、帶有部分負電荷的原子B(F、O、N)
氫鍵的本質:強極性鍵(A-H)上的氫核,與電負性很大的、含孤電子對並帶有部分負電荷的原子B之間的
靜電引力。}⑶表示氫鍵結合的通式
氫鍵結合的情況如果寫成通式,可用X-H…Y①表示。式中X和Y代表F,O,N等電負性大而
原子半徑較小的非金屬原子。X和Y可以是兩種相同的元素,也可以是兩種不同的元素。⑷對氫鍵的理解氫鍵存在雖然很普遍,對它的研究也在逐步深入,但是人們對氫鍵的定義至今仍有兩種不同的理解。第一種把X-H…Y整個結構叫氫鍵,因此氫鍵的
鍵長就是指X與Y之間的距離,例如F-H…F的鍵長為255pm。第二種把H…Y叫做氫鍵,這樣H…F之間的距離163pm才算是氫鍵的鍵長。這種差別,我們在選用氫鍵鍵長數據時要加以注意。不過,對
氫鍵鍵能的理解上是一致的,都是指把X-H…Y-H分解成為HX和HY所需的能量。
氫鍵強度
氫鍵的牢固程度——
鍵強度也可以用
鍵能來表示。粗略而言,氫鍵鍵能是指每拆開單位物質的量的H…Y鍵所需的能量。氫鍵的鍵能一般在42kJ·mol
-1以下,比
共價鍵的鍵能小得多,而與分子間力更為接近些。例如,
水分子中共價鍵與氫鍵的鍵能是不同的。
而且,氫鍵的形成和破壞所需的
活化能也小,加之其形成的空間條件較易出現,所以在物質不斷運動情況下,氫鍵可以不斷形成和
斷裂。
對性質影響
氫鍵通常是物質在
液態時形成的,但形成後有時也能繼續存在於某些
晶態甚至氣態物質之中。例如在氣態、液態和固態的HF中都有氫鍵存在。能夠形成氫鍵的物質是很多的,如水、水合物、
氨合物、
無機酸和某些有機化合物。氫鍵的存在,影響到物質的某些性質。
(1)
熔點、
沸點分子間有氫鍵的物質熔化或氣化時,除了要克服純粹的分子間力外,還必須提高溫度,額外地供應一份能量來破壞分子間的氫鍵,所以這些物質的熔點、沸點比同系列
氫化物的熔點、沸點高。分子內生成氫鍵,熔、沸點常降低。例如有分子內氫鍵的
鄰硝基苯酚熔點(45℃)比有分子間氫鍵的間位熔點(96℃)和對位熔點(114℃)都低。
(2)
溶解度在
極性溶劑中,如果
溶質分子與溶劑分子之間可以形成
氫鍵,則溶質的溶解度增大。HF和NH3在水中的溶解度比較大,就是這個緣故。
(3)粘度分子間有氫鍵的液體,一般粘度較大。例如
甘油、磷酸、
濃硫酸等多
羥基化合物,由於分子間可形成眾多的氫鍵,這些物質通常為粘稠狀液體。
(4)密度液體分子間若形成氫鍵,有可能發生
締合現象,例如
液態HF,在通常條件下,除了正常簡單的HF分子外,還有通過氫鍵聯繫在一起的複雜分子(HF)n。nHF(HF)n
其中n可以是2,3,4…。這種由若干個簡單分子聯成複雜分子而又不會改變原物質
化學性質的現象,稱為
分子締合。分子締合的結果會影響液體的密度。
H
2O分子之間也有締合現象。
常溫下液態水中除了簡單H
2O分子外,還有(H2O)2,(H2O)3,…,(H2O)n等
締合分子存在。降低溫度,有利於
水分子的締合。溫度降至0℃時,全部水分子結成巨大的
締合物——冰。