人物信息
姓名:保羅·納斯(Sir Paul M. Nurse),1949~
 保羅·納斯教授
保羅·納斯教授獎項:諾貝爾生理學或醫學獎
獲獎時間:2001年
獲獎理由:發現了控制細胞周期的關鍵物質——細胞周期蛋白依賴激酶(CDK)
人物簡介
生平
1949年1月,納斯出生於英國一個
工人階級家族,父親是一位技工,母親是一位清潔工,“家裡基本上沒有任何書”,但在8歲那年,當看到蘇聯人造地球衛星2號飛越倫敦上空時,他迷上了科學。中學畢業後,他因法語考試不及格而被大學拒絕,幸運的是,一位教授說情讓他破例進入大學。
 保羅·納斯教授
保羅·納斯教授1970年,納斯在英國伯明罕大學獲得生物化學學士學位,之後轉入酵母遺傳學和細胞生物學研究,1973年獲
東英格利亞大學博士學位。他曾在決定帝國癌症研究基金會的倫敦實驗室、牛津大學工作,他的研究小組發現了控制酵母細胞分裂的循環依賴激酶,並表明人類擁有對應這種酶的相同基因。因為癌症就是失控的細胞分裂,他們的發現有助於認識癌症。這項工作讓納斯和另外兩位科學家分享了2001年的諾貝爾生理學或醫學獎。
儘管從未停止過研究工作,納斯仍在1996年成為英國癌症研究基金會主席。2003年,他來到大西洋彼岸,出任美國紐約洛克菲勒大學校長。現任英國帝國
癌症研究
基金會主任,
香港龍康國際生命基因研究所榮譽顧問。
成就
保羅·納斯在英國帝國癌症研究基金會工作,他用
遺傳學和分子學方法,識別
克隆並描繪了細胞周期的一個關鍵調節
物質CDK(細胞周期
蛋白依賴激酶cyclin dependent kinase)。他發現CDK的功能在進化中被很好的保存了下來。CDK是通過對其它
蛋白質的化學修飾(磷酸化作用)來驅動細胞周期的,該物質能夠將早期的變異細胞基因——癌變的早期細胞起到修復,恢復成正常細胞的功能,且對人體正常細胞沒有損傷。這對長期抽菸等人群體內細胞變異性損傷及癌症告發家族人群,能起到保健及預防癌症的效果。
研究
保羅·納斯在哈特韋爾的基礎上,使用基因法繼續對細胞周期進行研究,他使用了不同於哈特韋爾的另一種
酵母作為模型
生物體。20世紀70年代中期,納斯在這種酵母中發現了一種在控制
細胞分裂中具有關鍵功能的基因,這種功能與哈特韋爾發現的相同。繼續研究後,納斯還發現這個基因調節細胞周期的不同過程。1987年,納斯從
人體細胞中分離出了相應的基因,並命名為CDK1,它編碼CDK族的一個蛋白質。納斯的研究表明,CDK的激活作用依賴於可逆的磷酸化作用。在這些發現的基礎上,科學家在人體細胞中發現了6個不同的CDK分子。因為在“細胞周期中的關鍵調控子”研究方面做出的卓越貢獻,2001年諾貝爾生理學或醫學獎授予了他和美國科學家
利蘭·哈特韋爾和英國科學家
蒂莫西·亨特。
理論貢獻
獲得諾貝爾
瑞典卡羅林斯卡醫學院2001年10月8日在宣布,將2001年諾貝爾生理學或醫學獎授予美國科學家
利蘭·哈特韋爾、英國科學家
蒂莫西·亨特和保羅·納斯,以表彰他們發現了細胞周期的關鍵
分子調節機制。
卡羅林斯卡醫學院發表的
新聞公報說,所有有機體均由通過分裂而成倍增加的細胞所組成。一個成年人大約擁有100萬億個細胞,而這些細胞都源於一個受精卵
細胞。同時,成年人機體中大量的細胞還通過不斷的分裂產生新細胞,以取代那些死亡細胞。
報導
新聞公報說,榮獲諾貝爾生理學或醫學獎的3名科學家所作出的重大貢獻在於發現了具有調節所有真核有機體中細胞周期的關鍵分子。其中,利蘭·哈特韋爾發現了大量控制細胞周期的基因,其中一種被稱為“START”的基因對控制各個細胞周期的最初階段具有決定性的作用。保羅·納斯的貢獻是,在哈特韋爾的基礎上,通過基因與分子法發現了調節細胞周期的一種關鍵物質CDK(細胞周期蛋白依賴激酶),CDK是通過對其他蛋白質的化學作用來驅動細胞周期的。蒂莫西·亨特的貢獻是首次發現了調節CDK功能的物質CYCLIN(細胞周期蛋白)。
 保羅·納斯
保羅·納斯評價
卡羅林斯卡醫學院評價說,哈特韋爾、納斯和亨特3人的發現對研究細胞的發育有重大的影響,特別是對開闢治療癌症新途徑將具有極其深遠的意義,因為細胞周期控制過程中出現的缺陷可以導致癌細胞中染色體的變異。
研究經歷
細胞增殖是一切有機體得以生長、繁衍的基本方式。一個成年人體約含有1014個細胞,這些細胞均起源於一個
受精卵。受精卵經過不斷的分裂、分化,最後形成完整個體。即使在成體中,仍有大量細胞不斷進行著分裂,以補充那些衰老、死亡的細胞。細胞的增殖分為3個過程,首先是細胞生長,達到一定的體積,這時其核內的
染色體進行複製,然後染色體平均分配到兩個子代細胞中去。這三個同過程的協調需通過對細胞周期進行精密調控來實現。
 保羅·納斯
保羅·納斯保羅·納斯等人均在細胞周期調控方面做出過傑出貢獻。他們分離鑑定出所有
真核生物(包括酵母、植物、動物以及人類)細胞周期調控中的關鍵分子。正如在腫瘤細胞中常看到的那樣,細胞周期的失控將導致染色體發生改變,因而這些基礎研究成果有可能開闢腫瘤治療的新途徑。
早在20億年前,地球上就有了真核細胞,所謂“真核”,是指染色體位於核內,與細胞的其他組分離開。由這樣的細胞組成的有機體即是真核生物。真核生物有些由單細胞組成,像酵母與阿米巴。另一些由多細胞組成,如動、植物等。人體內含有數以億計的細胞,平均每克組織就約有10億個
細胞。每個細胞的細胞核中有23對染色體,包含了細胞的遺傳物質(即生物學中常提到的
DNA)。
早在100多年前,人們就已經了解到細胞是通過分裂進行增殖的。然而,直到最近20年,隨著
分子生物學的興起,科學家們才有可能對細胞周期調控的分子機制進行研究。
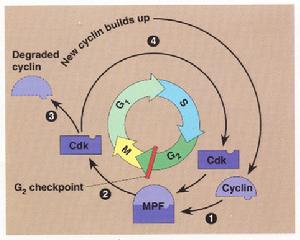
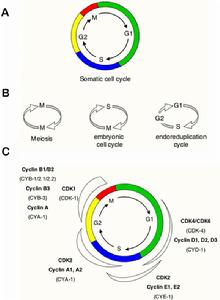
細胞周期分為4個時相—G1期、S期、G2期、M期。細胞在細胞周期中依次經過上述4期,完成其增殖過程。細胞在不同的時相中完成不同的事件:在G1期中細胞不斷生長變大。當細胞增大到一定的體積,就進入S期,DNA的合成、遺傳物質的複製DNA複製)等主要事件在此期完成。在G2期,細胞要檢查其DNA複製是否完成,為細胞分裂做好準備。在M期,染色體一分為二,細胞分裂成為兩個子代細胞。經過一個細胞周期,兩個子代細胞獲得完全相同的染色體。分裂結束後,細胞退回到G1期,細胞周期完成。然而,G1期的細胞並不總是沿著細胞周期向前運轉,在某些情況下,它可退出細胞周期,進入靜息期——G0期。
細胞周期的長短在不同的細胞中有所差異,一般來講,在多數哺乳動物細胞中,細胞周期的時間為10~30個小時。
對所有
真核生物而言,細胞周期的不同時相高度精確地協調著。細胞必須遞次地經過細胞周期的不同時相,在完成上一個時相內的事件後,才有可能進入下一個時相。這一過程中的任何缺陷將導致染色體發生變異,染色體或部分染色體可能丟失、重排或非平均地分配到子代細胞中,這種染色體變異常見於
腫瘤細胞。
在20世紀70年代中期,保羅·納斯在S.pombe酵母中發現了cdc2基因,該基因在細胞分裂調控中起著關鍵作用,它控制細胞從G2期進入M期。這之後保羅·納斯又發現cdc2基因還有著與start基因相同的作用(start基因早些時候由哈特韋爾從芽殖酵母中鑑定出來),即在細胞從G1期向S期的轉換過程中起調控作用。
細胞周期G1、G2
1987年,保羅·納斯從人體中分離得到與
酵母cdc2同源的基因,後來命名為CDK1(周期素依賴性激酶1),該基因的編碼產物為周期素依賴性激
酶蛋白家族中的一員。納斯還發現CDK的激活依賴於可逆的
磷酸化作用,即磷酸基因連在蛋白分子上或從蛋白分子上脫落下來。此後,他在人體中又發現了幾十種不同的CDK分子。
在細胞周期的整個過程中,CDK分子的含量相對穩定,但由於周期素的調控作用,其活性有所變化。CDK與周期素分子一起驅動著細胞從一個時相進入下一個時相。CDK分子好似一個“發動機”,周期素則似“變速器”,周期素決定著CDK分子是以空載模式運轉,還是
驅動細胞沿著細胞周期向前運轉。
保羅·納斯等人的研究成果將會使多數生物醫學的研究領域受益。它將有助於理解腫瘤細胞中染色體的不穩定性,即染色體或部分染色體是如何進行重排、丟失或不平等地分配到子代細胞中去的。染色體的這種變化很可能是由細胞周期調控過程中的缺陷引起的,已有研究結果表明,CDK分子和周期素的基因功能上相當於癌基因(可引起腫瘤的基因)。而且,在細胞周期調控中,CDK分子和
周期素也可與腫瘤抑制基因(與癌基因相反,它們可以抑制細胞過度增值,阻止腫瘤形成,故稱腫瘤抑制基因)的產物(如p53和RB)協同作用。
細胞周期研究領域中的這些成果無疑將運用到腫瘤診斷中去,在
乳腺癌、
腦瘤等人類腫瘤中有時會發現CDK分子和周期素的水平上升。從長遠來看,這也將為腫瘤治療開闢新途徑,因為人們可以針對細胞周期調控子設計出控制細胞生長、分裂的藥物來阻止
癌細胞的增殖。目前運用CDK分子抑制劑進行
腫瘤治療的臨床試驗正在進行中。
合作者
利蘭·哈特韋爾
利蘭·哈特韋爾(LelandH.Hartwell),1939年10月30日出生於美國洛杉磯,1961年加州理工學院學士,1964年麻省理工學院博士,現工作於哈欽森癌症研究中心。
蒂莫西·亨特
蒂莫西·亨特(R.TimothyHunt),1943年2月19日出生於英國,1964年劍橋大學學士,1968年劍橋大學博士,現工作於英國帝國癌症研究基金會。
諾貝爾獎
所獲獎項簡介諾貝爾生理學或醫學獎,是根據
阿爾弗雷德·諾貝爾逝世前立下的遺囑,諾貝爾生理醫學獎由位於瑞典首都斯德哥爾摩的卡羅琳醫學院負責頒發。頒獎儀式於每年12月10日,諾貝爾逝世周年紀念日舉行。諾貝爾生理醫學獎是為了表彰前一年中在生理學或者醫學領域有重要的發現或發明的人。
 諾貝爾獎章
諾貝爾獎章 保羅·納斯教授
保羅·納斯教授 保羅·納斯教授
保羅·納斯教授 保羅·納斯
保羅·納斯 保羅·納斯
保羅·納斯 諾貝爾獎章
諾貝爾獎章
