基本性質,基因特點,作用機理,在啤酒工業中的套用,雙乙醯,α-乙醯乳酸脫羧酶在啤酒發酵中的套用,α-乙醯乳酸脫羧酶基因的克隆表達研究,α-乙醯乳酸脫羧酶的酶學性質研究,
基本性質
α-乙醯乳酸脫羧酶(α-acetolactate decarboxylase, α-ALDC)是酵母中 2, 3-丁二醇合成途徑第二步催化反應的關鍵酶,也是 α-乙醯乳酸分解代謝流向纈氨酸、亮氨酸的生物合成關鍵調控點。儘管不同來源的α-乙醯乳酸脫羧酶分子量及理化特性有所不同,但是大多數微生物合成的 α-ALDC 由兩個大小相同的亞基組成,分子量約為 20~40 kDa,pI 值為 4.7左右,最適 pH 在 5.0~7.0 之間,最適反應溫度約為 40 ℃。
基因特點
各種細菌來源的α-乙醯乳酸脫羧酶基因同源性差異很大,通過分子生物學軟體對GeneBank上的一些序列進行同源性比較:Bacillus subtilis和Coxiella burnetii之間48%;Bacillus subrilis和Bacillus licheniformis之間49%;Bacillus subtilis和Lactococcus lactis之間54%;Coxiella burnetii和Bacilluslicheniformis僅有15%;Coxiella burnetii和Lactococcus lactis 之間20%,Bacilluslicheniformis和Lactococcus lactis之間為20%。
對枯草芽飽桿菌α-乙醯乳酸脫羧酶基因alsD分析,其中有5個編碼精氨酸的大腸桿菌的稀有密碼子:1個CGA密碼子,編碼第3個胺基酸殘基;另外4個AGA密碼子分別編碼第124、142、170和226位的精氨酸殘基。枯草芽抱桿菌α-乙醯乳酸脫羧酶基因alsD是處於一個叫alsSD的操縱子下游的基因。alsSD操縱子約4.5 kb,由als操縱子調節蛋白基因口括尺,乙酞乳酸合成酶基因alsS和a-乙醯乳酸脫羧酶基因alsD串連組成;在aIsR和alsS之間有兩個彼此分開的核糖體結合位點(RBS),在alsS和alsD之間有一個核糖體結合位點(RBS),alsD後面串聯著該基因的終止子。
在乳酸乳球菌α-乙醯乳酸脫羧酶基因aldB,它是leu-ilv-ald操縱子的第2個基因,編碼3種支鏈鏈胺基酸(BCAA)殘基亮氨酸、異亮氨酸和擷氨酸的合成。該基因在細胞中起到雙重作用①催化乙偶姻途徑的第二步反應。②控制亮氨酸和擷氨酸合成過程中α-乙醯乳酸池。它轉錄可以從Ieu基因和ilv基因的啟動子(P1和P2)開始,或者從自身啟動子(P3)開始。
篩選了Leuconostoc oenos的基因組文庫,得到了編碼α-乙醯乳酸脫羧酶基因的alsD基因,該基因翻譯為239個胺基酸殘基。研究表明篩選到的片斷轉錄為alsS和alsD基因,表明這兩個基因位於同一個操縱子中。
可以推測α-乙醯乳酸脫羧酶基因在微生物的基因組可能有相同或者相似的組織形式。
作用機理
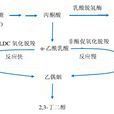
α-乙醯乳酸生成乙偶姻的方式有兩種:一種是先經過非酶促氧化脫羧生成雙乙醯,雙乙醯再經過雙乙醯還原酶的催化生成乙偶姻,該方式反應速度慢,且會生成雙乙醯;另一種是通過 α-ALDC 的催化直接生成乙偶姻和二氧化碳,該方式反應速度快,且能夠避免雙乙醯的形成。
在啤酒工業中的套用
雙乙醯
雙乙醯(diacetyl)是啤酒發酵中的風味物質,但是啤酒中雙乙醯含量超過0.15 mg/L 時就能產生令人不愉快的餿飯味,嚴重影響啤酒的風味,國家標準(GB4927-2008)規定優級啤酒中雙乙醯含量不得高於0.10 mg/L。
在啤酒發酵過程中,已經研究清楚的酵母代謝生成雙乙醯的途徑主要有兩種:一種是由羥乙基硫胺素的焦磷酸鹽與乙醯輔酶 A 直接縮合得到,另一種是由 α-乙醯乳酸經非酶促氧化脫羧得到。酵母合成纈氨酸必須先生成中間產物 α-乙醯乳酸,而 α-乙醯乳酸在酵母中的合成代謝要快於分解代謝,這使得它在酵母細胞中逐漸積累。當積累量達到一定程度時,一部分被分泌到啤酒發酵液中,這部分 α-乙醯乳酸會進一步生成雙乙醯,這無疑會給雙乙醯含量的控制帶來很多困難。因此,控制 α-乙醯乳酸的生成量也成了控制雙乙醯含量的一個重要因素。
α-乙醯乳酸脫羧酶在啤酒發酵中的套用
為了在不增加設備投資的前提下,縮短啤酒生產周期以達到提高效益的目的。可以通過一系列的方法來控制啤酒中的雙乙醯含量,例如選育低產 α-乙醯乳酸菌株,選育高α-乙醯乳酸轉化率菌株,或者改進生產工藝等。當然,也可以直接在發酵過程中添加α-ALDC 來減少啤酒中的雙乙醯含量。
1983 年,Godtfredsen從一株地衣芽孢桿菌中分離純化出α-ALDC,將所得α-ALDC添加到啤酒發酵過程中,結果發現,添加 α-ALDC 會使啤酒發酵的成熟期縮短到 6 d 左右。1986 年,丹麥嘉士伯研究中心研發了一種以 α-ALDC 作為啤酒後熟助劑的先進啤酒發酵工藝,該工藝在 7 d 後熟和發酵時間內,酒液中的雙乙醯含量明顯低於閾值,且α-ALDC 酶製劑對酵母的發酵活力和速率沒有不良影響。陳煒將 α-ALDC 用於啤酒主發酵和後發酵試驗,結果表明,α-ALDC 對降低主發酵和後發酵啤酒中的 α-乙醯乳酸和雙乙醯均有一定效果,對後發酵的作用效果尤為顯著。也有研究發現,如果開始發酵時,在冷卻麥汁中加入比例為 2 ppm(活性單位為 2000 U/mL)的 α-ALDC,滿罐 5~6 d,可使啤酒發酵時間將縮短 7 天以上,且在過濾到成品啤酒的過程中,雙乙醯的含量不出現回升現象。此外,大量研究表明,使用添加 α-ALDC 的方法來控制雙乙醯不會改變啤酒的風味。丹麥的諾和諾德公司採用重組枯草芽孢桿菌生產出了 α-ALDC 製劑 Maturex L,並將該酶製劑進行了商品化銷售,但其價格比較高,中、小型啤酒廠難以接受。凌建華比較了進口α-ALDC 和國產的α-ALDC,結果發現國產α-ALDC 的使用效果也很可靠,可替代進口同類製劑,但是同樣面臨著價格偏高的問題。因此,選育新型 α-ALDC 高產菌株,通過基因工程等手段提高 α-ALDC 產量以降低生產成本顯得尤為重要。
α-乙醯乳酸脫羧酶基因的克隆表達研究
為了獲得更多的 α-ALDC,除了從自然界篩選獲得高產的 α-ALDC 產生菌外,還可以將 α-ALDC 基因克隆到模式菌株中,構建基因工程菌進行過量表達。上世紀八十年代開始,就有許多國外學者克隆了不同來源的 α-ALDC 基因並進行不同載體的表達。
Fujii從產氣腸桿菌中克隆得到 α-ALDC 基因,並將其連線到質粒 YIP 上,轉化酵母受體菌 IP00751,將 α-ALDC 基因克隆並整合到受體菌的染色體上,最終獲得的轉化菌株的 α-ALDC 基因在非選擇條件下能夠保持穩定。Sone 等人克隆了產氣腸桿菌中的 α-ALDC 基因,並分別在大腸桿菌和啤酒酵母細胞中表達,結果顯示,轉化子每毫克蛋白含 2 到 3 個 α-ALDC 酶活單位。Goelling也用利用篩選表達文庫的方法,從一株鏈球菌中克隆得到 α-ALDC 基因,並證明該基因位於 1.3 kb 的 DNA片段內。國內對 α-ALDC 克隆表達的研究工作起步較晚,但近些年發展迅速。目前有許多來自不同細菌的 α-ALDC 基因己被克隆表達,如地衣芽飽桿菌、枯草芽抱桿菌、乙醯短桿菌、醋酸桿菌、短芽抱桿菌和產氣腸桿菌等。選用的表達體系多為枯草芽孢桿菌、大腸桿菌以及釀酒酵母等。鄭曉東用 PCR 方法擴增產氣腸桿菌的 α-ALDC 基因,得到 0.78 kb 的 DNA 片斷,選用載體 pQE30 在大腸桿菌中高效表達,獲得的酶活性可達 180U/mL,重組菌株穩定性較高,在 37 ℃連續培養 67 代仍能夠保持酶活性。
α-乙醯乳酸脫羧酶的酶學性質研究
工業中使用的酶製劑多為純酶,而純酶的酶學性質和粗酶的酶學性質具有很大差異。因此,在獲得粗酶的基礎上,對其進行純化並研究純酶的酶學性質具有非常重要的意義。
早在 1970 年,Loken就研究了從產氣氣桿菌中提取純化的 α-ALDC 的酶學性質,結果顯示,該酶的最適 pH 值為 6.2~6.4,金屬離子對該酶有不同程度的抑制作用。1985年, Rasmussen利用 FPLC Mono Q 柱層析和 Fractogel DE 650S 陰離子交換柱提純乾酪乳桿菌產生的 α-ALDC,研究該酶的一些基本的酶學性質發現,該酶含有兩個相同的亞基分子(分子量為 24, 000),等電點為 4.7,最適 pH 值為 5.0~6.0,最適溫度為 40 ℃。該酶的穩定性較差,37 ℃、pH 5.0 條件下的半衰期只有 15 min。而 Godtfredsen研究發現,乳鏈球菌 α-ALDC 的活性較高,穩定性也很好,但溶解性較差,會給後處理帶來困難。大量的關於 α-ALDC 酶學性質的研究發現,不同來源的基因所表達 α-ALDC 在酶學特性有一定的差距,即使來源於同一個菌屬,在菌種不同或培養條件不同時,所表達的α-ALDC 的酶學特性也不盡相同。