成份與性狀:
本疫苗每 0.5 ml 劑量含各型多糖共 16μg(多糖總量):6B 型 4μg,4、9V、14、18C、19F 和23F 型各 2μg;各型多糖與 CRM 197 載體蛋白結合後吸附於磷酸鋁佐劑(0.5 mg) 。另含氯化鈉和注射用水。
性狀:
本品為白色、均勻混懸液。
接種對象:
本品用於 3月齡~2 歲嬰幼兒、 未接種過本疫苗的 2 歲~5 歲兒童 (高危人群請參見 【注意事項】 ) 。
推薦常規免疫接種程式:3、4、5 月齡進行基礎免疫、12~15 月齡加強免疫。
作用與用途:
本品接種用於嬰幼兒主動免疫,以預防由本疫苗包括的 7 種血清型(4、6B、9V、14、18C、19F 和 23F)肺炎球菌引起的侵襲性疾病。
肺炎球菌是引起侵襲性感染(包括敗血症、腦膜炎、菌血症性肺炎和菌血症),以及肺炎等上呼吸道感染的常見病因,2 歲以下嬰幼兒發生侵襲性疾病的危險性最高。
本疫苗的使用應考慮到不同地區肺炎球菌引起疾病流行的血清型別的差異以及侵襲性疾病對不同年齡組的影響。本疫苗不預防疫苗所包括血清型以外的其它肺炎球菌型別的感染,也不預防其它微生物導致的侵襲性感染。
規格:
0.5 ml/支;每 0.5 ml 劑量含各型多糖共 16μg;其中 6B 型 4μg,4、9V、14、18C、19F 和 23F型各 2μg。
免疫程式和劑量:
本疫苗使用前應充分搖勻,僅供肌肉注射接種。首選部位為嬰兒的大腿前外側區域(股外側肌)或兒童的上臂三角肌。肌肉注射劑量為 0.5 mL,注意不要注射到臨近的神經和血管中。疫苗不能注射到臀部。
本品在美國和歐洲批准可與其它兒童用疫苗(DTwP, DTaP, Hib, IPV, OPV, B肝疫苗,MMR,水痘疫苗)同時接種。但目前在國內暫不推薦本疫苗與其它兒童計畫免疫疫苗或常規兒童用疫苗同時接種。
3 ~6 月齡嬰兒 :基礎免疫接種 3 劑,每劑 0.5 ml;首次接種在 3 月齡,免疫程式為 3、4、5 月齡各一劑,每次接種至少間隔 1 個月。建議在 12~15 月齡接種第 4 劑。
未接種過本疫苗的幼兒和兒童(基於國外免疫原性和安全性臨床試驗) :
7 ~11 月齡嬰兒 :基礎免疫接種 2 劑、每劑 0.5 ml,每次接種至少間隔 1 個月。建議在 12 月齡以後接種第 3 劑,與第 2 次接種至少間隔 2 個月。
12 ~23 月齡幼兒 :接種 2 劑、每劑 0.5 ml,每次接種至少間隔 2 個月。
24 月齡~5 歲兒童 :接種 1 劑。
不良反應:
1. 國外臨床不良反應
本品在國外有超過18,000例健康嬰兒(6周~18個月)進行了多個有對照的臨床研究,評價了本疫苗的安全性。以下絕大多數安全性結果主要來自17,066例嬰兒,總共接受55,352劑本品的臨床有效性試驗(NCKP)。此外還對未免疫接種過本疫苗的大齡兒童進行了安全性評估。
在所有的臨床試驗中,本疫苗與其它推薦使用的兒童疫苗聯合接種,最常見的不良反應是注射部位的局部不良反應和發熱。在基礎免疫或加強免疫期間,重複接種未見持續增加的局部或全身不良反應。
對於使用單劑量免疫接種方案的2~5歲兒童,局部不良反應的發生率高於嬰兒,主要還是以一過性反應為主。
針對所有年齡組臨床試驗中報告的或來自上市後本品使用經驗的不良反應,按照身體器官類別和發生率分類,以嚴重程度遞減方式列表如下。
按CIOMS不良反應發生率的分類:很常見(≥10%);常見(≥1%且<10%);偶見(≥0.1%且<1%);罕見(≥0.01%且<0.1%);非常罕見(<0.01%)。
國外上市後接種的其它不良反應:
此類發生率以自發性報告率為基礎,並且採用報告數量和銷售劑量的數量進行計算。
與其它兒童期使用的疫苗一樣,本品有呼吸暫停的自發報告,與接種本疫苗有時間相關性。多數病例在接種本品時同時接種了其他疫苗,包括白喉-破傷風-百日咳疫苗(DTP)、白喉-破傷風-無細胞百日咳疫苗(DTaP) 、B型肝炎疫苗、滅活脊髓灰質炎病毒疫苗(IPV) 、流感嗜血桿菌 b 疫苗(Hib) 、麻疹-腮腺炎-風疹疫苗(MMR)和/或水痘疫苗,但在多數報告中存在諸如呼吸暫停、感染、早產和/或驚厥病史的基礎性疾病。
據一項嬰兒監測研究報導,發現與歷史對照相比,接種本疫苗的嬰兒發生“喘鳴” 而住院的相關風險增加,由於存在著混雜因素,如同時接種更換的疫苗、呼吸道合胞病毒(RSV)或流感病毒感染的逐年變異、呼吸道疾病日益增加的趨勢等,本次研究中其它分析以及對關鍵的大規模、多中心、對照有效性研究所作的長期隨訪分析還不能證實這一現象與本品相關。
2. 國內臨床不良反應
國內註冊臨床試驗總計有 592 名受試者接種了本品,將局部反應、全身反應以及和本疫苗相關的不良事件合併分析後的安全性信息概括如下:
本疫苗與 DTaP 分開接種時(297 例),最常見的全身不良反應依次為發熱(>37.5°C)和睡眠中斷(26.60%)、易激惹(21.89%)、食慾下降(15.49%)和腹瀉(14.81%),大多數症狀為輕度,體
溫>39°C 發生 2 例 (0.79%);接種部位的局部不良反應有紅斑 (11.11%)、硬結 (7.74%)和疼痛(9.09%),直徑>2.5cm 的紅斑、硬結為 1%。以上不良反應的發生率在第 1 劑接種後最高,第 2 劑和第 3 劑接種後不同程度減少。
本疫苗與 DTaP 同時接種時(295 例),最常見的全身不良反應依次為發熱(>37.5°C) (28.81%)、睡眠中斷(26.78%)、易激惹(26.44%)、腹瀉(24.07%)和食慾下降(16.61%),大多數症狀為輕度,體溫>39°C 發生 4 例(1.36%) ;接種部位的局部不良反應有紅斑(10.85%) 、硬結(7.46%)和疼痛(11.86%) ,直徑〉2.5cm 的紅斑、硬結為 1%。以上不良反應同樣在第 1 劑接種後發生率最高,第 2劑和第 3 劑接種後不同程度減少。
以上臨床試驗未發現國外說明書中未列出的不良事件。常見不良反應與國外說明書中的安全性信息基本一致。
禁忌:
對本疫苗中任何成份過敏,或對白喉類毒素過敏者禁用。
注意事項:
1. 僅供肌肉注射。
2. 本疫苗可能不會對接種疫苗的所有個體都有保護作用。
3. 高風險嬰幼兒/兒童接種本品應基於個體化接種的考慮。目前本疫苗對患鐮狀紅細胞病嬰幼兒/兒童的安全性和免疫原性資料有限;尚未獲得本疫苗對患肺炎球菌侵襲性疾病的其它高危嬰幼兒/兒童(如患先天性和獲得性脾臟功能障礙、HIV 感染、惡性腫瘤、腎病綜合徵等)的安全性和免疫原性資料。
4. 接種本品對於 24 月齡以下幼兒(包括高危嬰幼兒在內)應使用與其年齡相對應的免疫程式和劑量。在年齡≥24 個月患有肺炎鏈球菌所致侵襲性疾病高風險的患兒(如鐮狀紅細胞病、無脾、HIV 感染、慢性病或免疫功能受損)中,使用本結合疫苗並不能代替 23 價肺炎球菌多糖疫苗。
5. 比較輕微的疾病,如伴或不伴低熱的輕度呼吸道感染,一般不是接種疫苗的禁忌症。患急性發熱性疾病的嬰幼兒應暫緩接種本疫苗。
6. 同所有其它注射用疫苗一樣,接種本品應常備有相應的醫療及搶救措施(如 1:1000 腎上腺素等)以防接種後出現罕見的過敏性事件。
7. 本疫苗禁止靜脈注射。
8. 儘管免疫接種本疫苗可出現一定的白喉毒素抗體反應,但並不能替代常規的預防白喉的免疫接種。
9. 除非受益明確高於接種風險,否則對患有血小板減少症,任何凝血障礙或接受抗凝治療的嬰幼兒禁止肌肉注射接種本品。
10. 因遺傳性缺陷、HIV 感染、使用免疫抑制藥物(包括放射藥物、皮質激素、抗代謝藥物、烷化劑和細胞毒藥物) 、或其它原因導致的免疫應答受損的嬰幼兒,對本品主動免疫的抗體應答反應可能下降。
11. 所有接種本品的同時也接種含全細胞百日咳疫苗的兒童,建議預防性使用退熱藥。接種本品時,對驚厥發作風險高於普通人群的嬰幼兒/兒童應考慮使用退熱藥物。
12. 除了疫苗中包含的肺炎鏈球菌血清型,本品不能預防肺炎鏈球菌其他血清型的感染,也不能預防其他微生物引起的侵襲性疾病,如菌血症、腦膜炎和肺炎,也不能預防這些病原菌所致的非侵襲性感染,如中耳炎。
13. 和所有注射用兒童疫苗一樣,早產兒初種時要考慮到有呼吸暫停的潛在風險。接種疫苗時仍在住院的每個極早早產兒(出生時≤30 孕周) ,接種後都要監測至少 48 小時。因為這類嬰兒接種疫苗的受益很大,所以要按時接種,不能推遲。
14. 注射器柱塞墊圈和注射器針頭保護帽含有乾的天然橡膠,已知對乳膠過敏或可能對乳膠過敏的人接觸或注射該產品時,可能會引起過敏反應。
15. 本疫苗不宜用於成年人。妊娠期間使用和哺乳期間接種疫苗的安全性尚不明確。
16. 本品在年齡小於 6 周的嬰兒以及 10 周歲以後的兒童中的安全性和有效性尚不明確。
17. 本疫苗不能與其他疫苗/產品放在同一個注射器中混合。
18. 本疫苗是含有佐劑的混懸液。因此,用前要在疫苗容器內用力搖勻。如果搖晃後容器內的疫苗混懸液不均勻,則不能使用
藥物相互作用:
本品在美國和歐洲批准可與其它兒童用疫苗(DTwP, DTaP, Hib, IPV, OPV, B肝疫苗,MMR,水痘疫苗)同時接種。臨床研究期間,和本疫苗同時接種的疫苗包括白喉破傷風百日咳疫苗(DTP)或白喉破傷風無細胞百日咳疫苗(DTaP) 、b 型流感嗜血桿菌(Hib) 、口服脊髓灰質炎疫苗(OPV)或滅活的脊髓灰質炎疫苗(IPV) 、B肝疫苗、腦膜炎球菌血清群 C 結合疫苗、麻疹-腮腺炎-風疹疫苗(MMR)以及水痘疫苗。因此, 本疫苗的安全性經驗說明本疫苗可以納入常規免疫計畫。有些研究中,對某些抗原所產生抗體應答的差別結果不一,儘管如此,這些差異預計沒有什麼臨床意義。但目前在國內暫不推薦本疫苗與其它兒童計畫免疫疫苗或常規兒童用疫苗同時接種。
臨床試驗:
根據肺炎鏈球菌莢膜多糖抗原的差異,大約可鑑別出 90 余種血清型,致病的血清型在不同的年齡和地理位置的分布有所不同。
本疫苗在美國的血清型覆蓋率為 89~93%之間,已在美國人群中獲得對侵襲性疾病(IPD)的臨床有效性評價。1988~2003 年的流行病學研究數據顯示,本品在歐洲的覆蓋率較低而且在不同國家和地區之間存在差異。在 2 歲以下歐洲兒童中,本疫苗可覆蓋肺炎球菌侵襲性疾病(IPD)分離株血清型的 71%~86%,及抗生素耐藥株血清型的 80%以上。兒童人群中疫苗血清型覆蓋率隨年齡增長而下降。2~5 歲歐洲兒童中,本疫苗可覆蓋大約 50%~75%導致肺炎球菌侵襲性疾病的臨床分離株。大齡兒童中所見 IPD 發生率下降的部分原因可能是自然獲得的免疫所致。
目前我國缺少近年肺炎鏈球菌引起侵襲性疾病和相關血清型別的流行病學資料, 還尚不明確本品在我國肺炎球菌所致侵襲性疾病的血清型覆蓋率。
1. 國外臨床研究
預防侵襲性疾病的有效性
在北美加利福尼亞 1995 年進行的一項由多種族人群參與的大規模隨機雙盲臨床試驗(NCKP)中評價了本品預防侵襲性疾病的有效性。超過 37,816 名嬰兒在 2、4、6 和 12~15 月齡時接種本疫苗或對照疫苗(C 型腦膜炎球菌結合疫苗) 。試驗時,疫苗中包括的血清型占 IPD 的 89%。
截至 1999 年,在盲態隨訪期間累計有 52 例由本疫苗血清型導致的侵襲性疾病(均有菌血症、還有個別腦膜炎和肺炎) ,ITT 人群試驗組發生 3 例,對照組 49 例。ITT 人群中評價血清型特異性疫苗效力為 94%(95% CI: 81,99 ) 、PP 人群為 97%(95% CI: 85,100) 。
在歐洲,考慮到本品對引起侵襲性疾病的血清型覆蓋率影響,疫苗有效性介於 65%~79%之間。在 NCKP 試驗中,對疫苗涵蓋血清型肺炎球菌所導致菌血症性肺炎的有效性為 87%(95% CI :7,99 )。
免疫原性
疫苗誘發的對每種血清型特異性莢膜多糖所產生的抗體,被認為對侵襲性疾病具有保護作用。但對侵襲性疾病各血清型的最低保護性抗體濃度尚未確定。 WHO 建議所有肺炎球菌血清型的抗體濃度≥0.35 μg/ml,則可以預測疫苗具有效預防侵襲性肺炎球菌疾病的效果。
國外在接種了 4 劑或 3 劑本疫苗的嬰兒/幼兒中,儘管血清型之間幾何平均濃度不同,但所有血清型都可見明顯的抗體應答。所有血清型在接種 3 劑後都可見基礎免疫的應答峰值,第 4 劑後可見加強。基礎免疫後採用調理吞噬試驗測定的結果顯示,本疫苗誘發產生對所有疫苗血清型的功能性抗體。尚未進行嬰兒和大齡兒童完成免疫接種後(加強免疫)抗體持久性的臨床研究。
國外的臨床試驗中在本疫苗基礎免疫13個月後使用單純多糖疫苗(如23價肺炎球菌多糖疫苗)也可誘發7種血清型的免疫記憶應答。
2. 國內臨床試驗
在國內本品進行了 3~5 月嬰兒免疫原性(基礎免疫和加強免疫)和安全性臨床試驗,尚未開展預防侵襲性疾病有效性的臨床研究。
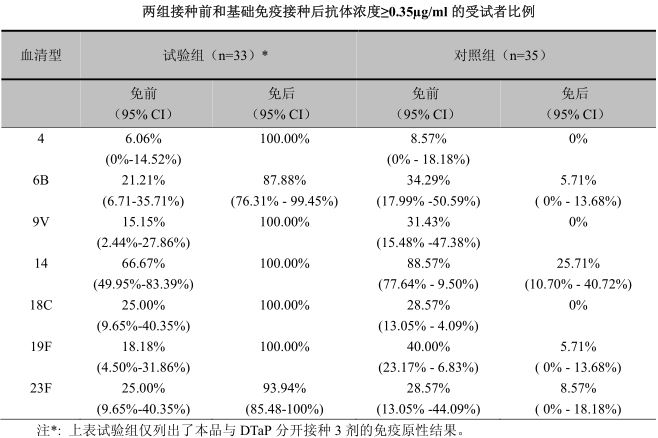
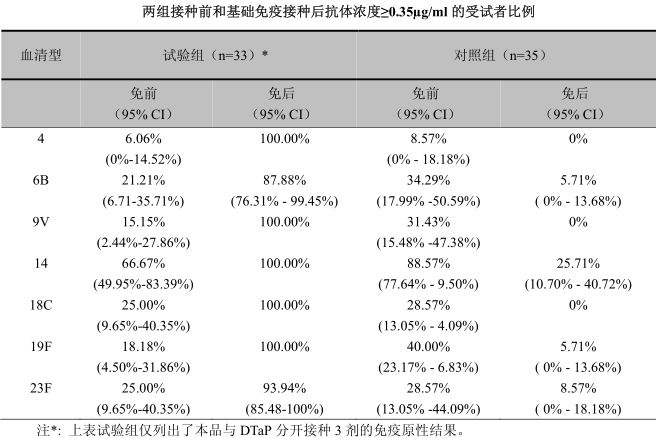
在中國健康嬰兒進行的開放、 隨機、 對照研究中對免疫原性進行了評價。 3、 4、 5 月齡時與 DTaP分開或同時接種 3 劑基礎免疫,對照組只接種 DTaP。在第 3 劑後 1 個月時,接種本疫苗受試者的血清特異性抗體幾何平均濃度(GMC)升高並顯著高於對照組。與 DTaP 分開接種的受試者 GMC 介於 3.10g/ml(血清型 6B)至 17.75g/ml(血清型 14 型)之間。抗體濃度≥0.35µg/ml 的受試者比例介於 87.88%(血清型 6B)至 100%(血清型 4,9V,14,18C)之間。在對照組中,只有 27.66%的受試者其血清型 14 抗體濃度≥0.35µg/ml,而其它血清型抗體達到這一水平的比例不到 10%。研究結果提示,本品在 3、4、5 月齡與 DTaP 分開接種,在中國嬰兒可以誘發良好的免疫應答。詳見下表:
兩組接種前和基礎免疫接種後抗體濃度≥0.35µg/ml 的受試者比例
在基礎免疫研究階段接種了本品的兩組受試者(分別為 60,61 名)在 12~15 月齡時接種第 4劑加強免疫,表現出明顯的加強免疫反應。加強免疫接種後,基礎免疫階段本品與 DTaP 分開接種的受試者 GMC 升高倍數從 5.13(血清型 14)到 18.46(血清型 23F) ,基礎免疫階段與 DTaP 同時接種的受試者 GMC 增加倍數從 9.43(血清型 14)到 27.46(血清型 23F) 。兩組各血清型 GMC 升高(接種後/接種前)都具有統計學顯著性差異(p<0.0001) 。研究結果提示,本品在中國嬰兒可以有效的誘發免疫記憶應答。
貯藏:
置於冰櫃(2°C–8°C)內貯存。本疫苗不得冷凍。
如果疫苗已冷凍,要丟棄,不能再用。
請將本品放置在兒童不能觸及的地方。
包裝:
預填充式注射器:1 支/盒,10 支/盒
1 支/盒:每個包裝中包括 1 個單劑量(0.5ml)預填充式注射器和1個針頭。
10 支/盒: 每個包裝中包括 10 個單劑量(0.5ml)預填充式注射器和 10 個針頭。
有效期:
48個月