專利背景
自1985年PCR技術問世以來,這一技術已被套用到生命科學的各信息領域,因其敏感性高、特異性強、操作簡便、所需時間短等優點,已被廣泛用於病原微生物的檢測。由於臨床標本中含有蛋白質、脂類等物質,可干擾PCR反應,故在做PCR反應前必須進行核酸提取。PCR檢測技術的第一步就是模板DNA的製備,即樣本中DNA的提取,這直接影響著PCR反應的結果。長期以來,樣本中DNA的提取和純化一直是耗時、繁瑣的過程,嚴重減慢了檢測速度。
截至2009年6月,樣品中DNA的提取方法包括兩個步驟:裂解細胞和提取核酸。裂解細胞,使DNA釋放出來的常用方法包括物理法(煮沸、凍融、微波、超聲、研磨等)、化學方法(高鹽、表面活性劑SDS、熱酚等)和酶解法(裂解酶、溶菌酶、蛋白酶K等)。
酚抽提法、異丙醇沉澱法及甲醯胺裂解法是提取DNA最為經典的方法,很多方法的改進都是在這些方法的基礎上進行的,這三種方法均是利用蛋白酶K和十二烷基硫酸鈉(SDS)消化破碎細胞。在前兩種方法中,裂解液先用酚/氯仿去除蛋白質,再分別用乙醇或異丙醇沉澱DNA。甲醯胺法是利用高濃度的甲醯胺解聚蛋白質與DNA的結合,然後利用透析來處理DNA樣品。這些經典方法獲得的DNA純度很高,能夠滿足各種試驗的要求,但操作繁瑣,用時長,且所用試劑具有一定的毒性。
套用於實時螢光定量PCR檢測的核酸提取方法主要有三種,即鹼裂解法、煮沸裂解法和磁珠法。
鹼裂解法是在NaOH提供的高pH(12.0~12.6)條件下,用強陽離子去垢劑SDS破壞細胞壁,裂解細胞,與NaOH共同使細胞的蛋白質發生變性,釋放出DNA。裂解後,細胞壁碎片與變性的蛋白質和其他雜質形成大的複合物,這些複合物在高鉀鹽條件下,可有效沉澱,而DNA保留於上清液中,再通過無水乙醇沉澱、乙醇洗滌等步驟純化DNA。鹼裂解法雖然快速簡便,但去蛋白效果欠佳,明顯影響了PCR效果。
煮沸裂解法原理,是在煮沸時將樣品中的DNA通過含蛋白酶K等裂解緩衝液的作用釋放出來,溶解在緩衝液中,沸水浴裂解細胞的同時,可破壞DNA鏈的鹼基配對,並使細胞的蛋白質與染色體DNA變性。通過離心沉澱去除變性的蛋白質和其他雜質,然後回收上清液中的DNA用於PCR擴增。然而,經高溫煮沸,蛋白凝固使部分核酸被包裹並隨離心沉澱丟失,直接導致上清液中模板核酸量減少;另外,雖經煮沸並高速沉澱,上清液中仍含有少量抑制擴增的成分如蛋白、肝素及微量血紅蛋白等,抑制了擴增效率。
磁珠法是2009年前幾年才發展起來的核酸提取方法,磁珠法提取核酸是通過細胞裂解液裂解細胞,從細胞中游離出來的核酸分子被特異的吸附到磁性顆粒表面,而蛋白質等雜質不被吸附,而留在溶液中。反應一定時間之後,再在磁場作用下,使磁性顆粒與液體分開,回收顆粒(即磁珠-DNA混合物),再用洗脫液洗脫,得到純淨的DNA。由於其系列試劑不含氯仿、苯酚等毒性大的有機溶劑,提取步驟更簡單,對核酸樣本的回收率高和純度好等優勢而倍受研究者青睞。不過產品基本上為中國國外所壟斷,價格非常昂貴,從而限制了其在中國的廣泛套用。
無論是經典方法還是各種改良法,都必須關注以下三個要點:第一、目的基因的得率;第二、操作程式的簡繁程度;第三、材料和時間的消耗。以上各種方法都必須在提取純化核酸後才可進行PCR檢測,處理大量臨床樣本的時候難免會比較吃力。
發明內容
專利目的
《一種提取靶核酸並進行PCR擴增檢測的方法》的目的在於提供一種所用器材簡單,操作簡便,成本低的提取靶核酸並進行PCR擴增檢測的方法。
技術方案
《一種提取靶核酸並進行PCR擴增檢測的方法》之提取核酸並進行PCR擴增的方法包括如下步驟:將一種裂解液、一種含靶核酸的樣品和一種進行PCR擴增的反應液加入PCR反應管中,混合均勻,置於PCR儀上進行PCR擴增。
裂解液、含靶核酸的樣品和PCR擴增反應液混勻後,宜靜置3-8分鐘,然後再置於PCR儀上進行PCR擴增。
所述裂解液由0.01~0.5毫摩爾/升(質量體積比)的表面活性肽溶解於50~200毫摩爾/升的KCl(質量體積比),0.01%~2%(體積)的SDS、LLS、Chelex-100(質量體積比),以及0.05%~1%(體積)的乙醇組成。
含靶核酸的待測樣品可以為血清、血漿、分泌液或痰液。
所述核酸可以是DNA或RNA。
PCR擴增反應液(以下簡稱“PCR反應液”)包括PCR擴增緩衝液,選自dATP、dCTP、dGTP、dTTP或dUTP中的4種dNTP的混合物,DNA聚合酶,鎂離子,針對靶基因設計的上下游引物;根據實時螢光定量PCR的不同目的,還包括螢光染料或者根據靶序列專門設計的引物和與靶序列特異雜交的探針。這些物質的配比一般是根據不同實驗的反應體系調整,如1-5U的DNA聚合酶、3-5.5毫摩爾/升的Mg2+、0.2-0.4毫摩爾/升的dNTPs、1×PCR buffer;50-900納摩爾/升的上游引物、50-900納摩爾/升的下游引物,確定濃度後再確定加入物質的量(參見後述實施例)
所述4種dNTP的混合物配比,dATP:dCTP:dGTP:dTTP的比例一般為1:1:1:1;dATP:dCTP:dGTP:dUTP的比例為1:1:1:2。
所述裂解液、含靶核酸的待測樣品、PCR反應液這三種物質之間配比無限制,即可以是任何比例,但較優選的配比為1:1-3:10-25;混配順序也無嚴格限制,但PCR反應液宜最後添加。
除裂解液、含靶核酸的待測樣品、PCR反應液之外,還可根據需要加入內標。
所述內標為已知低含量的與模板擴增效率相似的一段DNA片段,將它加入PCR反應液中,與模板共同擴增,可反應每管真實的擴增情況,如果內標和樣品都未擴增出結果,則表示該管擴增無效。
所述PCR擴增包括簡單PCR、線性擴增和實時螢光定量PCR。
改善效果
《一種提取靶核酸並進行PCR擴增檢測的方法》的優點是:只需簡單的器材,如移液槍、PCR反應管;兩種簡單的試劑(裂解液、PCR反應液),即可從樣品中快速高效提取靶核酸並同步進行實時螢光定量PCR擴增檢測。
同時,《一種提取靶核酸並進行PCR擴增檢測的方法》檢測線性範圍寬,對於不同濃度的樣本,定量準確,特異性好,重複性好。
與2009年6月前已有的核酸提取及PCR檢測方法相比較,《一種提取靶核酸並進行PCR擴增檢測的方法》操作格外簡便,接近自動化的操作保證了實驗結果穩定,避免人工操作引起的差異及錯誤,適用於不同類型的PCR儀,可廣泛套用於病原微生物的檢測,法醫學鑑定,組織和血液分型,基因突變的檢測等領域。
附圖說明
圖1(a)為《一種提取靶核酸並進行PCR擴增檢測的方法》方法檢測HBV DNA國家標準品的陽性參考品;
圖1(b)為《一種提取靶核酸並進行PCR擴增檢測的方法》方法檢測HBV DNA國家標準品的陰性參考品;
圖2為《一種提取靶核酸並進行PCR擴增檢測的方法》方法檢測HBV DNA陽性血清,從左至右濃度分別為1.0×10國際單位/毫升,1.0×10國際單位/毫升,1.0×10國際單位/毫升,1.0×10國際單位/毫升;
圖3(a)為《一種提取靶核酸並進行PCR擴增檢測的方法》方法檢測HBV DNA陽性血清,濃度為500國際單位/毫升;
圖3(b)為《一種提取靶核酸並進行PCR擴增檢測的方法》方法檢測HBV DNA陽性血清,濃度為300國際單位/毫升;
圖3(c)為《一種提取靶核酸並進行PCR擴增檢測的方法》方法檢測HBV DNA陽性血清,濃度為200國際單位/毫升;
圖4為《一種提取靶核酸並進行PCR擴增檢測的方法》方法檢測HBV DNA及相應內標。
技術領域
《一種提取靶核酸並進行PCR擴增檢測的方法》涉及一種提取靶核酸並進行PCR擴增檢測的方法。
權利要求
1.一種提取靶核酸並進行PCR擴增檢測的方法,其特徵在於,包括如下步驟:將裂解液、含靶核酸的樣品和進行PCR擴增的反應液加入PCR反應管中,混合均勻,置於PCR儀上進行PCR擴增;所述裂解液由0.01~0.5毫摩爾/升(質量體積比)的表面活性肽溶解於50~200毫摩爾/升的KCl(質量體積比),0.01%~2%(體積)的SDS、LLS、Chelex-100(質量體積比),以及0.05%~1%(體積)的乙醇組成。
2.根據權利要求1所述的提取靶核酸並進行PCR擴增檢測的方法,其特徵在於,將裂解液、含靶核酸的樣品和PCR擴增反應液混勻後,先靜置3-8分鐘,然後再置於PCR儀上進行PCR擴增。
3.根據權利要求1或2所述的提取靶核酸並進行PCR擴增檢測的方法,其特徵在於,所述核酸是DNA或RNA。
4.根據權利要求1或2所述的提取靶核酸並進行PCR擴增檢測的方法,其特徵在於,進行PCR擴增的反應液包括PCR擴增緩衝液,選自dATP、dCTP、dGTP、dTTP和dUTP中的4種dNTP的混合物,DNA聚合酶,鎂離子,針對靶基因設計的上下游引物。
5.根據權利要求4所述的提取靶核酸並進行PCR擴增檢測的方法,其特徵在於,所述4種dNTP的混合物配比,dATP:dCTP:dGTP:dTTP的比例為1:1:1:1;dATP:dCTP:dGTP:dUTP的比例為1:1:1:2。
6.根據權利要求4所述的提取靶核酸並進行PCR擴增檢測的方法,其特徵在於,還包括螢光染料或者根據靶序列專門設計的引物和與靶序列特異雜交的探針。
7.根據權利要求1或2所述的提取靶核酸並進行PCR擴增檢測的方法,其特徵在於,含靶核酸的待測樣品為血清、血漿、分泌液或痰液。
8.根據權利要求1或2所述的提取靶核酸並進行PCR擴增檢測的方法,其特徵在於,PCR擴增為簡單PCR、線性擴增或實時螢光定量PCR。
9.根據權利要求4所述的提取靶核酸並進行PCR擴增檢測的方法,其特徵在於,裂解液、含靶核酸的待測樣品、PCR反應液之間的配比為1:1-3:10-25。
實施方式
實施例1:HBV DNA的螢光定量PCR檢測實施例
用帶濾芯吸嘴吸取2微升裂解液(0.1毫摩爾/升的表面活性肽溶於80毫摩爾/升KCl、0.1%SDS、0.5%乙醇),3微升待測樣本(已知HBV DNA陽性的血清或血漿),加入PCR反應管中,移液槍頭吸打混勻,靜置5分鐘後,用帶濾芯吸嘴吸取45微升已配好的PCR反應液,於Stratagene Mx3000P或ABI7300 PCR儀上進行實時螢光定量PCR擴增。
PCR反應液各成分濃度及比例如下:
PCR反應程式為:
1)以HBV國家標準品中的陰陽性參考品作為待檢樣本,採用《一種提取靶核酸並進行PCR擴增檢測的方法》在StratageneMx3000P儀器上檢測,檢測陰陽性符合率。如圖1(a)為國家標準品中的9個陽性參考品,運用《一種提取靶核酸並進行PCR擴增檢測的方法》檢測全為陽性,圖1(b)為8個陰性參考品,經檢測全為陰性。運用《一種提取靶核酸並進行PCR擴增檢測的方法》進行HBV DNA螢光定量PCR檢測具有良好的特異性。
2)以中國生物製品檢定所(中檢所)B型肝炎病毒(HBV)核酸定量標準品標定的4種濃度的HBV DNA陽性血清為待測樣本,濃度分別為1.0×10國際單位/毫升,1.0×10國際單位/毫升,1.0×10國際單位/毫升,1.0×10國際單位/毫升,每一濃度重複實驗3次,結果如圖2所示,CT值的變異係數分別為:0.25%,0.44%,0.48%,0.36%,變異係數均在1%以內,由此可以看出運用《一種提取靶核酸並進行PCR擴增檢測的方法》檢測血清樣本的重複性很好。
3)以中檢所B型肝炎病毒(HBV)核酸定量標準品標定的HBV陽性血清為初始樣本,稀釋至500國際單位/毫升,300國際單位/毫升,200國際單位/毫升,每一濃度重複5次,如圖3,500國際單位/毫升,300國際單位/毫升的樣本均100%的擴增,而200國際單位/毫升的僅1個的樣本無擴增,故運用《一種提取靶核酸並進行PCR擴增檢測的方法》進行螢光定量PCR檢測靈敏度可達300國際單位/毫升。
4)以HBV國家標準品中的線性靈敏度參考品為待測樣本,以梯度稀釋的陽性標準品(濃度分別為1.0×10國際單位/毫升,1.0×10國際單位/毫升,1.0×10國際單位/毫升,1.0×10國際單位/毫升)採用《一種提取靶核酸並進行PCR擴增檢測的方法》的快速方法進行檢測,分析檢測值與理論值的符合性:
線性靈敏度參考品 | 質量標準(國際單位/毫升) | 理論濃度對數值 | 檢測值 | 檢測濃度對數值 |
|---|
| | | | |
| | | | |
| | | | |
| | | | |
| | | | |
| | | | |
| | | | |
理論濃度和檢測濃度的雙對數曲線線性相關係數(r)為0.9993,運用此方法進行實時螢光定量PCR檢測定量很準確。
實施例2:HBV DNA及相應內標的快速螢光定量PCR檢測實施例
如實施例1的方法,用帶濾芯吸嘴吸取2微升裂解液(0.1毫摩爾/升的表面活性肽溶於80毫摩爾/升KCl、0.1%SDS、0.5%乙醇),3微升待測樣本(已知HBV DNA陽性的血清或血漿),加入PCR反應管中,移液槍頭吸打混勻,靜置約5分鐘。根據反應數按照每反應加入0.3微升內標(10copies/微升)的比例將內標加入PCR反應液中。本實施例選用了低濃度HBV DNA樣本(濃度為500國際單位/毫升、200國際單位/毫升)以及一個陰性樣本作為待測樣本。如圖4,螢光信號較高的一組為內標的擴增曲線,螢光信號較低的一組為待測樣本的擴增曲線,內標擴增正常且對於低濃度檢測樣本無影響。內標為已知低含量的與模板擴增效率相似的一段DNA片段,將它加入PCR反應液中,與模板共同擴增,可反應每管真實的擴增情況,如果內標和樣品都未擴增出結果,則表示該管擴增無效,本快速方法可加入內標監控並具有很好的效果。
通過對B型肝炎病毒脫氧核糖核酸(HBV DNA)運用Taqman實時螢光定量PCR進行絕對定量實驗證明,《一種提取靶核酸並進行PCR擴增檢測的方法》檢測線性範圍寬,對於不同濃度的樣本,定量準確,特異性好,重複性好。
對照例1:煮沸法提取HBV DNA及螢光定量PCR檢測
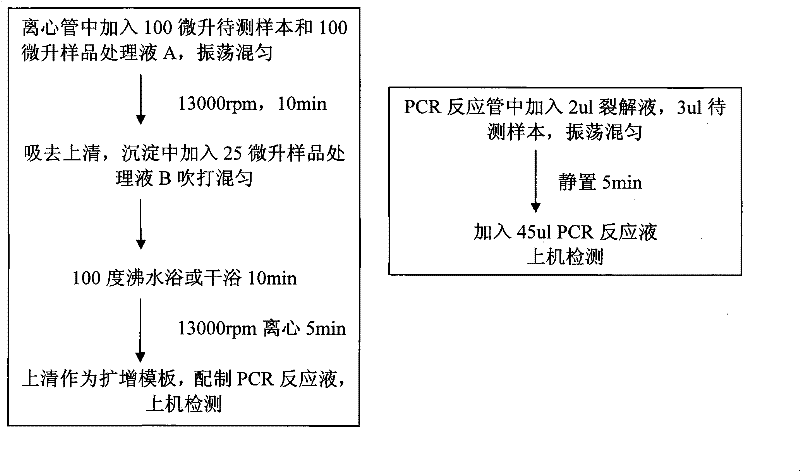
圖左為煮沸法,圖右為該發明方法
截至2009年6月,中國國內有很多採用煮沸法提取核酸並進行HBV定量檢測,但靈敏度僅能達到500國際單位/毫升或10國際單位/毫升以上,而《一種提取靶核酸並進行PCR擴增檢測的方法》靈敏度較煮沸法高,且操作更簡便。
對照例2:磁珠法提取HBV DNA及螢光定量PCR檢測
磁珠法:待測樣本中加入細胞裂解液,待細胞裂解後,向裂解液中加入磁珠,當溶液的pH值小於6.5時,磁珠選擇性的與最佳化的DNA結合,此時將吸附有DNA的磁珠置於磁場中,通過緩衝液去除沒有被吸附的雜質(蛋白等),然後將磁珠置於pH值8.5的緩衝液中,純化的DNA即可進入緩衝液,將洗脫的DNA加入PCR反應液中上機進行實時螢光定量PCR檢測。
2009年6月前已知的資料中,運用磁珠法提取核酸並擴增的靈敏度可達到10國際單位/毫升,《一種提取靶核酸並進行PCR擴增檢測的方法》靈敏度較磁珠法稍低,但在操作上相對簡便很多。
專利榮譽
2021年6月24日,《一種提取靶核酸並進行PCR擴增檢測的方法》獲得第二十二屆中國專利優秀獎。


