金屬簡介
由於金屬的電子傾向脫離,因此具有良好的
導電性,且
金屬元素在化合物中通常帶正價電,但當溫度越高時,因為受到了
原子核的熱震盪阻礙,電阻將會變大。金屬分子之間的連結是
金屬鍵,因此隨意更換位置都可再重新建立連結,這也是金屬伸展性良好的原因。
在自然界中,絕大多數金屬以
化合態存在,少數金屬例如金、銀、
鉑、
鉍以游離態存在。
金屬礦物多數是氧化物及硫化物,其他存在形式有氯化物、
硫酸鹽、碳酸鹽及矽酸鹽。
屬於金屬的物質有金、
銀、銅、
鐵、錳、鋅等。在一大氣壓及25攝氏度的常溫下,除汞(液態)外,其他金屬都是固體。大部分的純金屬是銀白(灰)色,只有少數不是,如金為黃赤色,銅為紫紅色。金屬大多帶“釒”旁。
通常將具有正的溫度電阻係數的物質定義為金屬。使用的含112種元素的元素周期表中,金屬元素共90種。位於“硼-砹分界線”的左下方,在s區、p區、d區、f區等5個區域都有金屬元素,過渡元素全部是金屬元素。
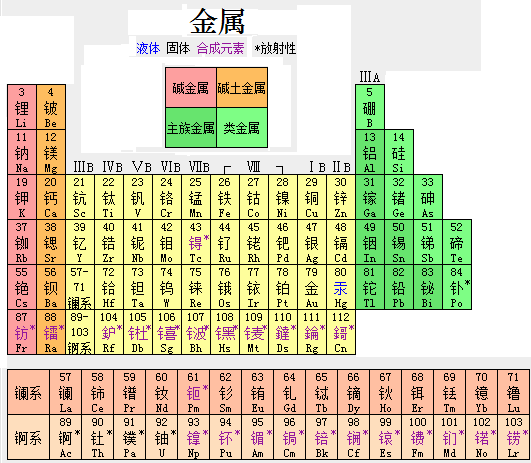 金屬在元素周期表中
金屬在元素周期表中在固態金屬
導體內,有很多可移動的
自由電子。雖然這些電子並不束縛於任何特定
原子,但都束縛於金屬的晶格內;甚至於在沒有外電場作用下,因為熱能,這些電子仍舊會隨機地移動。但是,在導體內,平均淨電流是零。挑選導線內部任意截面,在任意時間間隔內,從
截面一邊移到另一邊的電子數目,等於反方向移過截面的數目。
金屬原子結構
除
錫、銻、
鉍等少數幾種金屬的原子最外層電子數大於或等於4以外,絕大多數金屬原子的最外層電子數均小於4,主族金屬原子的外圍電子排布為ns1或ns2或ns2 np(1-4),過渡金屬的外圍電子排布可表示為(n-1)d(1-10) ns(1-2)。主族金屬元素的原子半徑均比同周期
非金屬元素(
稀有氣體除外)的原子半徑大。
有色金屬
狹義的有色金屬又稱非鐵金屬,是鐵、錳、鉻以外的所有金屬的統稱。廣義的有色金屬還包括有色合金。有色合金是以一種有色金屬為基體(通常大於50%),加入一種或幾種其他元素而構成的合金。
 有色金屬
有色金屬中國在1958年,將鐵、鉻、錳列入黑色金屬,並將鐵、鉻、錳以外的64種金屬列入有色金屬。這64種有色金屬包括:鋁、鎂、鉀、鈉、鈣、鍶、鋇、銅、鉛、鋅、錫、鈷、鎳、銻、汞、鎘、鉍、金、銀、鉑、釕、銠、鈀、鋨、銥、鈹、鋰、銣、銫、鈦、鋯、鉿、釩、鈮、鉭、鎢、鉬、鎵、銦、鉈、鍺、錸、鑭、鈰、鐠、釹、釤、銪、釓、鋱、鏑、鈥、鉺、銩、鐿、鑥、鈧、釔、矽、硼、硒、碲、砷、釷。
有色合金的強度和硬度一般比純金屬高,電阻比純金屬大、電阻溫度係數小,具有良好的綜合機械性能。常用的有色合金有鋁合金、銅合金、鎂合金、鎳合金、錫合金、鉭合金、鈦合金、鋅合金、鉬合金、鋯合金等。
有色金屬中的銅是人類最早使用的金屬材料之一。現代有色金屬及其合金已成為機械製造業、建築業、電子工業、航空航天、核能利用等領域不可缺少的結構材料和功能材料。
合成金屬
由兩種或兩種以上化學元素,且其中至少有一種是金屬元素所組成具有金屬特性的物質稱為合金。由兩種元素組成的合金統稱為“二元合金”,由三種以上元素組成的合金通稱為“多元合金”。合金的結構和性質,決定於組成合金的組分間相互作用的特性。
 鈦合金
鈦合金合金的晶體由不同類的原子組成,根據組成元素的相互作用不同,具有不同的晶體結構和性質。鎳鉻合金具有較高的電阻率和耐熱性(1000℃~1200℃),常用作電爐絲;鋁合金單位重量的強度高的接近於優質鋼;鈹青銅具有極高的硬度和強度,且有較好的彈性,抗腐蝕性強,可焊性和切削加工性良好,常用於製造特殊軸承、彈性元件、不發生火花的工具。由於合金的機械性、物理和化學性能往往優於純金屬,因此,工業上套用的金屬材料幾乎都是合金。
金屬分類
常見金屬:如鐵、鋁、銅、鋅等。
輕金屬:密度小於4500千克/立方米,如鈦、鋁、鎂、鉀、鈉、鈣、鍶、鋇等。
重金屬:密度大於4500千克/立方米,如銅、鎳、鈷、鉛、鋅、錫、銻、鉍、鎘、汞等。
貴金屬:價格比一般常用金屬昂貴,
地殼豐度低(又稱
克拉克值(CLARKE value),一種表示地殼中化學元素平均含量的數值),提純困難,如金、銀及
鉑族金屬。
準金屬元素:性質價於金屬和非金屬之間,如矽、硒、碲、砷、硼等。
稀有分散金屬:如鎵、銦、鍺、鉈等;
化學性質
金屬分為活性金屬和鈍性金屬兩種。 根據金屬活動性順序,氫前金屬稱為活性金屬,氫後金屬就是鈍性金屬。
鉀 鈣 鈉 鎂 鋁 鋅 鐵 錫 鉛 (氫) 銅 汞 銀 鉑 金
 鈦合金
鈦合金K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
1、氫前面的金屬能與弱氧化性強酸反應,置換出酸中的氫(
濃硫酸、
硝酸強氧化性強酸與金屬反應不生成氫氣)。
如:Fe + 2HCl ═ FeCl2 + H2↑
2、活動性強的金屬能與活動性弱的金屬鹽溶液反應。
4、排在H前面的金屬,理論上講都能與水發生化學反應。在常溫下,鉀,鈣,鈉等能與水發生劇烈反應,鎂、鋁等能與熱水反應,鐵等金屬在高溫下能與水蒸氣反應。
5、金屬均無
氧化性,但金屬離子有氧化性,活動性越弱的金屬形成的離子氧化性越強。
部分金屬用途
金屬元素是化學元素的主體,是人們生產和生活的主要物質資源。
鎢(W) 在各種金屬元素中,鎢是最難熔化和最難揮發的金屬元素。鎢主要用於製造合金鋼;純鎢則主要用於製造燈炮中的鎢絲,也用於電子儀器、光學儀器等。
鉻(Cr) 鉻是銀白色金屬,硬度極高,具有抗腐蝕性,用於電鍍和製造特殊鋼材。本世紀,當人們致力於研究鉻的堅硬性質時,無意中發現了它的耐腐蝕性,從而誕生了不鏽鋼。現在,不鏽鋼及鍍鉻製品已在醫療器械、飲具、餐具等領域得到廣泛套用。
錳(Mn) 純淨的錳性堅而脆,難以在生產和生活中套用,但錳的合金則有廣泛的用途。錳鋼既堅硬、又堅韌,是製造鐵軌、軸承、裝甲板的理想材料。
鋰(Li) 鋰是最輕而比熱最大的金屬元素。鋰不僅用於製造超輕合金和鋰電池,而且是尖端技術的重要材料。鋰合金在航天工業上可大大減輕重量而降低能耗,在原子能工業上有重要作用;在冶金工業中,鋰常用作脫氧劑和脫氣劑,以消除金屬鑄件中的孔隙和氣泡。
鈦(Ti) 鈦的比強度(強度與比重的比值)在所有金屬元素中最高。鈦及鈦為主體的合金是新型的結構材料,質硬而輕,主要用於製造飛機、潛艇、耐腐蝕化工設備及各種機械零件。鈦合金在-253~ 500°C的溫度範圍內,都可保持高強度,是理想的航天材料。在煉鋼中,少量的鈦還是良好的脫氧、除氮及脫硫劑。
金屬之最
人體中含量最高的金屬元素:鈣(含量為1.5%)
密度最小的金屬:氫(2016年1月英國科學家在愛丁堡大學首次製成金屬態氫,氫成為密度最小的金屬)
導熱性最強的金屬:銀
製造新型高速飛機最重要的金屬:鈦(被科學家稱為“二十一世紀的金屬”或“未來的鋼鐵”)
海水中儲量最大的放射性元素:
鈾(陸地鈾礦的總儲量約200萬噸,海洋里含鈾的總量高達40萬萬噸)
含同位素最少的元素:鈉(只有Na-23穩定)
展性最強的金屬:金(最薄的金厚度只有1/10000mm)
延性最好的金屬:
鉑(最細的鉑絲直徑只有1/5000mm)
熔點最高的金屬:鎢(熔點:3410±20℃)
熔點最低的金屬:汞(熔點-38.8℃)
熔沸點相差最大的元素是
鎵(熔點30℃,沸點2403℃)
地殼中含量最少的金屬是
鍅(即使是在含量最高的礦石中,每噸也只有37×10負13次方克;地殼中的含量約為1×10^-21 %)
光照下最易產生電流的金屬元素:
銫(當其表面受到光線照射時,電子便能獲得能量從表面逸出,產生光電流)
金屬性最強的金屬:銫
世界上最貴的金屬:鐦(每克1千萬美元,比金貴50多萬倍)
最易套用的超導元素:
鈮(把它冷卻到-263.9℃的超低溫時,會變成一個幾乎沒有電阻的超導體)
 金屬在元素周期表中
金屬在元素周期表中 有色金屬
有色金屬 鈦合金
鈦合金 鈦合金
鈦合金
 金屬在元素周期表中
金屬在元素周期表中 有色金屬
有色金屬 鈦合金
鈦合金 鈦合金
鈦合金