烯醇化物等價體對α,β-不飽和羰基類化合物的加成反應是構建C-C鍵的常用方法之一,相應的不對稱催化反應也在過去的幾十年中得到廣泛的研究。α,β-不飽和醛、酮可通過亞銨離子、Brønsted酸及Lewis酸等參與的不對稱催化方法實現Michael加成。
基本介紹
- 中文名:Mukaiyama-Michael偶聯反應
- 本質:不對稱催化反應
- 套用:構建C-C鍵的常用方法之一
- 學科:有機化學
簡介
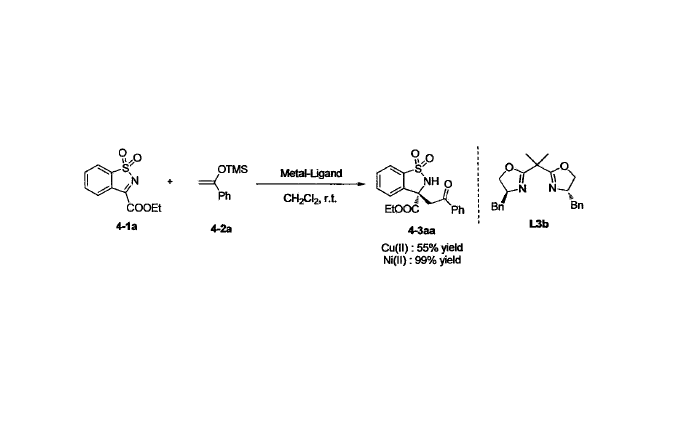
偶聯反應
底物合成
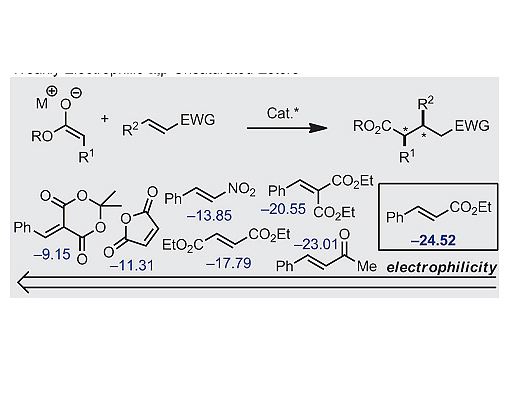
烯醇化物等價體對α,β-不飽和羰基類化合物的加成反應是構建C-C鍵的常用方法之一,相應的不對稱催化反應也在過去的幾十年中得到廣泛的研究。α,β-不飽和醛、酮可通過亞銨離子、Brønsted酸及Lewis酸等參與的不對稱催化方法實現Michael加成。


Mukaiyama-Michael偶聯反應95 Negishi交叉偶聯反應96 Nicholas反應97 Normant反應98 Nozaki-Hiyama-Kishi反應99 Olefin metathesis(烯烴複分解)反應100 Peterson成烯反應103 Rauhut-Currier反應104 Reformatsky反應105 Reppe羰基化反應106 Roskamp...
Michael 加成 /80 Mukaiyama-Michael 加成反應 /82 Mukaiyama 羥醛反應 /85 Negishi 偶聯反應 /89 Nicholas 反應 /99 Nozaki-Hiyama 反應和Nozaki-Hiyama-Takai-Kishi 反應 /103 Prins 反應 /108 Reformatsky 反應...
Kagan-Molander二碘化釤介入的偶聯反應88 Keck立體選擇性烯丙基化反應88 Kulinkovich羥基丙烷化反應89 Kumada交叉偶聯反應91 Liebeskind偶聯反應92 Lombardo-Takai烯基化反應93 McMurry偶聯反應94 Mukaiyama-Michael偶聯反應95 Negishi交叉偶聯...
此部分研究工作的創新點包括:利用有機小分子催化的不對稱Mukaiyama-Michael反應為關鍵步驟,快速構建了五元內酯類天然產物的核心骨架,並通過側鏈衍生實現Plakilactones的全合成;利用分子內[2+2]環加成反應完成(+)-Hippolachnin A的首次...
