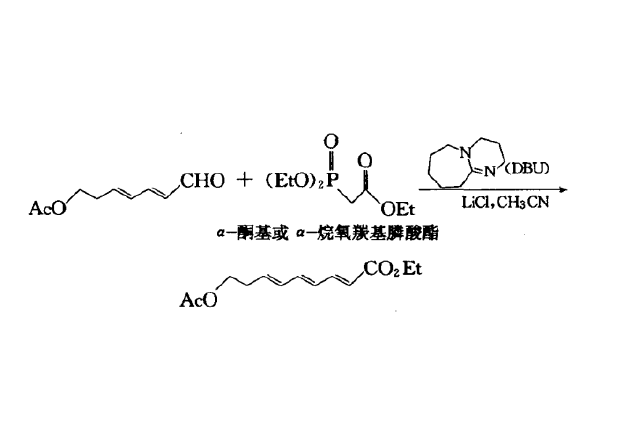
Masamune-Roush反應是Horner–Wadsworth–Emmons反應的改進方法。利用穩定的磷酸酯的碳負離子(多數情況下R1=O-alkyl and R2=CO2-alkyl)和醛酮立體選擇性地製備烯烴的反應被稱為Horner-Wadsworth-Emmons 成烯反應(或HWE反應)。產物主要為E-型烯烴。
基本介紹
- 中文名:Masamune-Roush條件
- 改進於:Horner–Wadsworth–Emmons反應
- 產物:主要為E-型烯烴
- 領域:有機合成
Horner–Wadsworth–Emmons反應,反應優點,反應特點,Masamune-Roush條件套用,
Horner–Wadsworth–Emmons反應
1958年,L. Horner利用烷基二苯基氧膦的負離子和醛酮反應成功製備了烯烴。這一對Wittig反應的改進反應被稱為Horner-Wittig反應(或Horner反應)。但這一改進被廣泛套用於有機合成,卻是在六十年代早期,因為此時W.S. Wadsworth和W.D. Emmons成功利用了磷酸酯(R1=O-alkyl)製備烯烴。在他們的研究中指出了磷酸酯比原來的三苯基膦葉立德有更多的優點。
反應優點
HWE反應和傳統的Wittig反應有如下優點:
1)磷酸酯比原來的鏻鹽更容易製備,並且更加經濟;
2)磷酸酯負離子比原來的磷葉立德親核性更強,因此它幾乎可以和所有的醛酮在溫和的條件下進行反應;
3)位阻較大的酮在Wittig反應中是不反應的,但在此反應中可以進行;
4)磷酸酯的α-碳負離子在成烯反應之前可以進一步修飾(和一些親電試劑反應,如烷基,鹵化物等),而葉立德一般是不可以的進行的;
5)副產物磷酸二烷基酯是水溶性的,因此可以很容易的從烯烴產物中分離,而非水溶性的三苯氧膦則很難分離。
反應特點
1)選擇性的製備E構型的二取代烯烴比Wittig反應需要更溫和的條件(R2需要和期初的雙鍵進行共軛);
2)可以增大烷基取代基(R1或R2, R=異丙基)來增加E構型的選擇性;
3)立體選擇性主要和底物相關,但可以通過使用更小位阻的取代基(如R1,R2=甲基)或使用強的游離鹼(如KOt-Bu)使之主要生成Z構型的烯烴。
Masamune-Roush條件套用
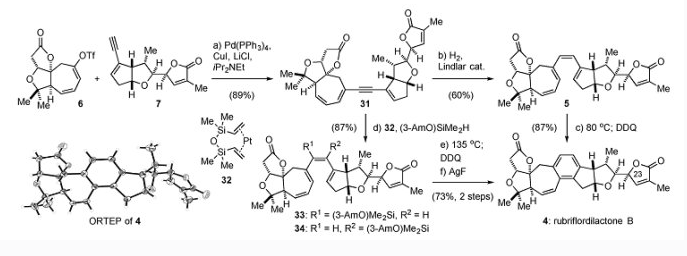
來自上海有機化學研究所的李昂研究員,在2014年,該小組在《JACS》上發表了降三萜類天然產物Rubriflordilactone A的全合成研究工作(J. Am. Chem. Soc.,2014,136, 16477)。今天介紹的分子是該家族另外一個分子Rubriflordilactone B。
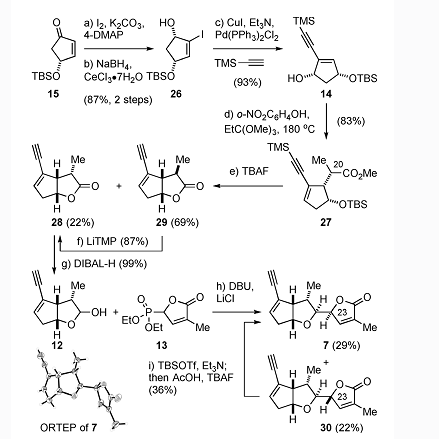
從商業可得的Perillyl alcohol 11出發,在ZnI2以及P(OEt)3參與下發生Arbuzov-type反應得到膦酸酯16,隨後臭氧切斷較為富電子的環內雙鍵,以及分子內的HWE反應構築環庚烯酮17。隨後17經過Mukaiyama脫氫反應得到雙烯酮,在L-selectride選擇性還原位阻較小一側雙鍵,得到雙鍵位置在羰基另一側的環庚烯酮9,隨後現場產生的Et2AlCN對9機型共軛加成,得到化合物19。化合物19在Mukaiyama水合條件下得到叔醇,隨後與在鹼性條件下水解的腈基生成內酯20.化合物20通過wittig試劑將羰基轉化成烯烴,防止對接下來的酯基α位氧化進行干擾。在Davis試劑的作用下,內酯α位氧化至羥基並矽基保護得到22。臭氧切斷雙鍵,做成三氟甲磺酸酯,將矽基轉為乙醯基保護,強鹼攫取乙醯基質子,同時進攻內酯,得到的半縮醛,其在矽氫的存在下還原得到三環化合物24。隨後自由基溴代,引入芳基硒,氧化/消除得到化合物6.
烯酮15經過碘代以及Luche還原得到烯丙醇化合物26,隨後26通過Sonogashira偶聯得到炔烴化合物14,化合物與原丙酸甲酯反應,經過Johnson–Claisen得到化合物27.其經過TBAF脫矽以及內酯化得到差向異構體28和29,29在大位阻鹼作用下可以轉化為期望的化合物28.內酯28通過DIBAL-H還原為半縮醛,與膦酸酯在溫和的Masamune-Roush條件下得到一對差向異構體7與30。其中7是期望的產物。該步反應機理是HWE反應得到雙烯脂,隨後氧雜Michael反應得到7。
得到兩個片段6和7以後,通過Sonogashira偶聯反應連線得到化合物31。31在Lindlar催化劑存在下部分氫化得到順式三烯化合物5,通過6π電環化/氧化芳構化得到Rubriflordilactone B。該路線的問題是反應重複性不好,以及得到的三烯的穩定性問題。為了克服這個缺點,將化合物31在Karstedt's catalyst作用下,經過炔烴氫矽化反應得到區域異構體33和34,再通過6π電環化/氧化芳構化/脫矽得到Rubriflordilactone B。