基本介紹
簡介,反應機理,套用,
簡介
Combes喹啉合成
芳香胺類與β-二酮縮合得到2,4-二取代喹啉。R通常為烷基,Rˊ可以是烷基或芳基,或取代芳基。在縮苯胺的氮原子的間位有強的鄰,對位定向取代基存在時,則閉環反應容易發生;但強鄰、對位定向取代基存在於氮原子的對位時,則阻礙閉環作用。
 喹啉合成反應
喹啉合成反應這個反應通過中間體縮苯胺(Ⅰ),此環化作用不能只靠加熱來完成,必須與濃硫酸共同溫熱才能環化。
近年來發現當β-氯乙烯醛和一級芳香胺的溶液在室溫容易形成亞胺-烯胺鹽酸鹽,並且為一般反應,很少有不能形成亞胺-烯胺鹽酸鹽的例子。3-氯-2-甲醯基丁烯-2-酸甲酯和苯胺,間硝基苯胺和3-氯-2-甲基丁烯-2-醛反應分別得到(Ⅱ)和(Ⅲ)。
PhNHC(Me)═C(CO2Me)—CHO(Ⅱ),m—O2N—C6H4NH—C(Me)═C(Me)—CHO(Ⅲ)
(Ⅲ)不能和另一分子胺進行反應,可能由於間硝基苯胺的低親核性,關於(Ⅱ)不能和第二個分子苯胺反應還無解釋。
當亞胺-烯胺鹽酸鹽在乙酸或類似沸點的醇(如正丁醇)中回流加熱時,得到喹啉,產率良好Ⅲ。
 亞胺-烯胺鹽酸鹽反應
亞胺-烯胺鹽酸鹽反應這個反應和經典的由β-二酮與一級芳香胺縮合製備喹啉的貢貝斯方法極類似。
反應機理
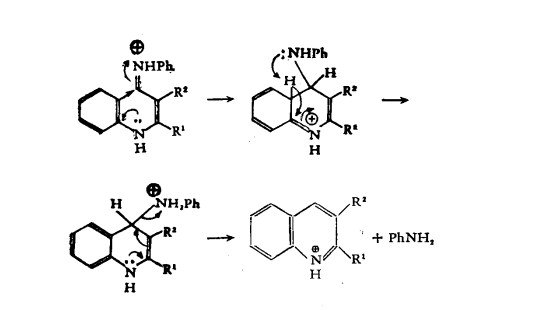
苯胺和β-二酮在濃硫酸共同溫熱的條件下發生環化,得到2,4-二取代喹啉。
 Combes喹啉合成反應
Combes喹啉合成反應該反應機理如下:
 反應機理
反應機理—NH2是鄰對位取代基,帶正電基團定位於鄰對位,但對位的可能性很小。
套用
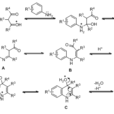
Combes反應是合成喹啉及其衍生物重要的方法,它是用苯胺(或其衍生物)與無水甘油、濃硫酸及適當的氧化劑一起加熱反應而得。Combes反應只有當反應進行激烈時,才能得到較好的產量,但如果反應猛烈,有時較難控制,為避免反應過於劇烈,常加入少量硫酸亞鐵或硼酸緩和反應。濃硫酸是脫水劑,也可用磷酸代替。氧化劑常用硝基苯,也可用碘、五氧化二砷、氧化鐵等,但不能用強氧化劑。甘油含水多,產率會降低。如用碘做氧化劑,甘油不必無水。
喹啉及其衍生物的生成過程,可能是由濃硫酸首先使甘油脫水成丙烯醛,苯胺與丙烯醛發生1,4-共軛加成,產生β-苯氨基丙醛,再在酸催化下脫水環化,形成1,2-二氫喹啉,在氧化劑的作用下,1,2-二氫喹啉氧化脫氫得到產物,此反應實際上是一步完成,產率很高。其反應過程如下:
 1,2-二取代喹啉製備過程
1,2-二取代喹啉製備過程