腓骨肌萎縮症病理機制,脫髓鞘型常染色體隱性遺傳的腓骨肌萎縮症,1.1CMT4A,1.2CMT4B,1.3CMT4C,1.4CMT4D,1.5CMT4E,1.6CMT4F,1.7HMSN-Russe,軸突型常染色體隱性遺傳的CMT,2.1CMT2B1,2.2CMT2B2,結語,應該做的檢查,臨床表現,I型脫髓鞘型,II型軸突型,診斷,1CMT 1脫髓鞘型,2CMT 2軸索型,腓骨肌萎縮症的治療,治療原則,
腓骨肌萎縮症病理機制
脫髓鞘型常染色體隱性遺傳的腓骨肌萎縮症
脫髓鞘型常染色體隱性遺傳的CMT主要特徵是發病年齡早,常在兒童期起病,神經傳導速度減慢,周圍神經有髓纖維髓鞘脫失或減少。隨著分子遺傳學的進展,已發現其至少有7個疾病基因位點,分別為8q13-21.1,11q22,11p15,5q23-33,8q24,19q13.1-13.3,10q22-23。其中5種疾病基因已被克隆,分別為神經節苷脂誘導的分化蛋白1(GDAP1)、肌管蛋白相關蛋白2(MTMR2)、N-myc Downstream-Regulated Gene 1(NDRG1)、早期生長反應蛋白2(EGR2)、軸突周圍蛋白(periaxin)等基因的突變已被發現能導致本病。脫髓鞘型常染色體隱性遺傳的CMT又分成7個亞型,具體如下:
1.1CMT4A
CMT4A以發病年齡早(通常兩歲之前)伴運動系統發育遲緩為特徵,先出現肢體遠端的無力和萎縮,十歲末累及近端肌肉,許多病人只能靠輪椅生活,常有骨骼畸形和脊柱側凸。運動神經傳導速度減慢(平均30m/s),神經活檢顯示厚髓纖維喪失伴髓鞘減少,無異常的髓鞘摺疊[1,2,3]。
Othmane等[1]將CMT4A的疾病基因定位於8q13-21.1,
周圍神經髓鞘蛋白2(PMP2)也位於此區,其主要在周圍神經中表達,隨後他們對該家系的患者進行PMP2測序,最終排除了PMP2是CMT4A的致病基因。BaXter等[2]分析了四個不相關的CMT4A家系,在GDAP1基因中發現三個不同的突變包括兩個無義突變和一個錯義突變,從而明確了GDAP1是CMT4A的致病基因。Cuesta等[3]也在三個不相關的以軸突病變為主的CMT4A家系中發現GDAP1三個不同的突變,進一步證實了GDAP1基因突變可引起CMT4A。GDAP1不僅在施萬細胞中表達而且還在中樞神經系統中表達,其作用即與細胞分化有關又與施萬細胞-軸突間相互作用有關,可能通過一種特殊的機制導致CMT4A,具體尚不明確[2,3]。
1.2CMT4B
CMT4B主要特徵是嬰兒期起病,始於下肢的進行性、對稱性的遠近端肌肉無力和萎縮,下肢的腱反射缺如,末梢感覺缺失,常見有
弓形足和
顱神經受累。組織學特徵有大髓鞘纖維密度顯著降低,階段性脫髓鞘和髓鞘再生,洋蔥頭改變,最顯著的特徵是局部髓鞘摺疊形成[4,5]。
CMT4B是一基因座異質性的疾病,至少已定位兩型,分別為11q22和11p15,還有一型尚未定位。Bilino等[6]分析了一個很大的近親結婚的CMT4B家系,利用純合子定位法和
單體型分析將其疾病基因定位於11q22。隨後,Bolino等[7]在不相關的CMT4B患者中套用定位克隆方法,檢測到MTMR2基因上五個不同的突變,從而明確了MTMR2基因突變可引起CMT4B。MTMR2是肌管相關雙特異性磷酸酶(DSP)家族中的一個成員,在這五個導致該酶功能喪失的突變中,第426號密碼子處的無義突變破壞了
蛋白酪氨酸磷酸酶(PTP)/DSP功能區,而12號外顯子和13號外顯子的突變都位於SET(Suvar3-9,Enhancer-of-zeste,Trithorax)相互作用區,由MTMR2基因無義突變導致MTMR2蛋白功能喪失,從而引起CMT4B。Houlden等[7]也在不相關的CMT4B家系中發現了MTMR2基因4號外顯子兩個新的突變,這些突變破壞了MTMR2基因,可能通過改變MTMR2蛋白的結構或破壞剪接位點而引起其功能的喪失,從而引起其作用底物活性過度,但這種結果怎樣引起
脫髓鞘和髓鞘局部摺疊形成卻不太清楚。
Othmane等[4]研究了兩個大的CMT4B家系,將其中一個家系的疾病基因定位於11p15,而另一家系的疾病基因既不在11q22又不在11p15,提示可能還存在另外一個疾病基因位點,並且發現11q22與11p15兩種類型的CMT4B之間具有相同的形態學特徵,但起病年齡與臨床表現存在差異。
1.3CMT4C
CMT4C主要特徵是起病較早(一般10歲以前發病),嚴重的脊柱側凸,而
運動障礙相對較輕。
神經傳導速度中等程度減慢,神經病理學典型改變:不論是形成髓鞘的施萬細胞或未形成髓鞘的施萬細胞,可塑性均有異常[8]。
Legnern等[9]研究了兩個CMT4C家系,將CMT4C疾病基因定位於5q23-33。Anneke等[8]也發現了六個CMT4C家系,證實了其疾病基因位於5q23-33。CMT4C中施萬細胞特殊的形態學改變提示:參與CMT4C發病機制的蛋白質存在於施萬細胞中或細胞外基質,而並非髓鞘蛋白,且早期即發生嚴重的脊柱側凸可能與細胞外基質蛋白的缺陷有關。雖然5q23-33區域有許多基因,但尚無CMT4C合適的候選基因[9]。
1.4CMT4D
CMT4D又為HMSN-Lom,因此病首先發現於Lom鎮故命名為HMSNL[10,11]。主要臨床特點是發病年齡早,在成年時即發展成嚴重的殘疾。腦幹誘發電位(BAEP)顯著異常,神經病理學發現有髓纖維數量顯著減少,尚存的一部分也都很小,施萬細胞功能異常(表現為髓鞘減少和脫髓鞘),而形成典型的洋蔥頭樣改變[10,11]。
Kalaydjieva等[10]將其定位於8q24,並發現HMSNL的建立者突變:在NDRG1第48號密碼子處有一提前終止的密碼子[12]。NDGR1在許多地方都有表達,在生長停止和細胞分化中發揮一定的作用,可作為穿梭細胞漿和核之間的一個標記蛋白。他們研究了其在
周圍神經系統(PNS)中的表達情況,結果顯示其在施萬細胞中表達水平較高,這個發現指出NDGR1在PNS中發揮作用,特別是在施萬細胞中可作為與HMSNL有關的軸突恢復的一個信號。HMSNL的神經病理學特徵表明其病因不能直接歸因於施萬細胞或神經元,施萬細胞和軸突的相互作用受損可能是其主要的發病機制 [12]。
1.5CMT4E
CMT4E又稱為先天性少髓鞘神經病(CHN)[11,13]。其主要特徵為大部分患者出生時就顯得笨拙,早期就有
運動障礙,四肢肌肉顯著萎縮,以近端為主,表現為明顯的跨閾步態。電生理檢查對感覺刺激反應差,運動神經傳導速度顯著減慢(達3m/s)腓腸神經活檢顯示所有的纖維幾乎均無髓鞘包裹。
Warner等[14]在一個CHN家系中發現EGR2基因中有一突變(T→A),引起Ile268Asn,此區是一般公認的
抑制區。EGR2定位於10q21.2-22.1,全長4.3Kb,包括兩個外顯子,它是編碼半胱2組2(Cys2His2)型鋅指蛋白的多基因家族中的一個組成部分,通過調節基因的表達來調節細胞的增殖,在
周圍神經系統中,它於神經髓鞘化的開始就有恆定的表達[14,15]。EGR2基因一般公認
抑制區的突變可能與CMT4E的發病有關[13]。
1.6CMT4F
CMT4F主要特徵是運動發育遲緩,10歲左右出現下肢遠端的
肌肉萎縮和無力及明顯的
弓形足,約15歲時出現
上肢無力,但以後病情進展緩慢。電生理檢查顯示上下肢感覺和運動誘發反應均缺如,組織病理學主要表現為有髓纖維缺失明顯(密度<1000/mm2)和施萬細胞增殖明顯並伴許多小的洋蔥頭樣改變 [11]。
Delague等[11]研究了一個大的近親結婚的CMT4F家系,通過全基因組掃描和連鎖分析將其定位於19q13.1-13.3。髓鞘相關糖蛋白基因(MAG)位於19q13.1,該基因編碼中樞神經系統和
周圍神經系統的跨膜糖蛋白,且一些脫髓鞘型感覺或運動感覺性神經病的病人中發現了抗-MAG
抗體,這促使他們把MAG基因作為CMT4F的候選基因,並對受累病人的MAG基因編碼區進行測序但最終並未發現任何改變,從而認為MAG基因並非CMT4F的致病基因[11]。Delague和Guilbot等[17]對同一家系進行了進一步的研究,發現在19q13位點的Periaxin基因有一無義突變R196X。Periaxin基因編碼L-periaxin和S-periaxin,他們是施萬細胞用以形成髓鞘的蛋白質,在形成髓鞘過程中,Periaxin參與膜蛋白的相互作用,這是維持髓鞘成熟所必需的[16]。純合性的Periaxin基因缺失的小鼠在
周圍神經系統中存在廣泛的脫髓鞘,這進一步證實了在施萬細胞形成髓鞘過程中Periaxin發揮的作用[17]。小鼠的Periaxin基因定位於7號染色體,與人類的19號染色體是同線性的。Guilbot等[17]通過腓腸神經活檢的組織病理學和
免疫組織化學分析發現人類CMT4F與小鼠的純合性Periaxin突變有共同的特徵,他們認為不論從功能或位置方面,Periaxin都是CMT4F一個很好的候選基因,利用純合性Periaxin基因缺失的小鼠作為
常染色體隱性遺傳的CMT的動物模型,有望對常染色體隱性遺傳的CMT,有助於研究CMT4F的發病機制。
1.7HMSN-Russe
HMSNR主要特徵是嚴重的進行性的運動感覺性神經病,有顯著的感覺缺失,可導致患者關節變性,大都有手足畸形。電生理檢查
神經傳導速度中等程度減慢,感覺神經運動電位缺如,對電刺激閾值增加,神經病理學顯示大的有髓神經纖維缺乏,有豐富的再生活動,髓鞘厚度減少程度與軸突直徑成正比,提示為髓鞘減少[15,18]。
Royers等[15]研究一家系,經基因組掃描將HMSNR定位於10q22-23, EGR2基因位於此區域內,由於EGR2是周圍神經髓鞘中一重要的轉錄因子,且已發現其突變可引起
常染色體顯性遺傳的CMT,他們將其作為常染色體隱性遺傳的CMT的候選基因,但進一步通過測序分析和檢測基因內多態性證實EGR2並非HMSNR致病基因。Thomas等[18]研究了另外一個HMSNR家系,連鎖分析將HMSNR基因定位於EGR2基因末端之外的10q23.2。這兩個家系在HMSNR區都有相關的多態
單體型,因此他們認為HMSNR可能是遺傳同質性的,是由一單獨的建立者突變所引起[18]。
軸突型常染色體隱性遺傳的CMT
軸突型常染色體隱性遺傳的CMT主要特徵是發病年齡相對較早,常在青春期起病,
神經傳導速度正常或輕度減慢,神經病理學顯示為軸突變性。已發現兩個基因位點1q21.2-21.3、19q13.3與之有關,分別命名為CMT2B1、CMT2B2[19,21], 核纖層蛋白A/C基因(LMNA)的突變可導致CMT2B1,具體如下:
2.1CMT2B1
CMT2B1主要特徵是起病年齡相對較早(20歲之前),對稱性的下肢遠端肌肉無力和萎縮,大部分還有近端肌肉的受累,下肢反射一般消失,大都有足部畸形。電生理檢查可發現運動神經傳導速度一般正常或輕微減慢,感覺神經動作電位下降或消失,神經病理學顯示為軸突變性,厚髓纖維明顯減少,很少有髓鞘再生現象[19,20]。
Bouhouche等[19]對九個近親結婚的CMT2B1家系進行了研究,將CMT2B1基因定位於1q21.2-21.3。與導致CMT1的
髓鞘蛋白零(MPZ)基因也位於此區,物理製圖顯示MPZ位於候選疾病基因區(D1S303-D1S506)的端粒側,且在MPZ基因的編碼區並未發現任何突變,故排除了MPZ基因為其致病基因。最近,Sandre-Giovannoli等[20]研究了三個CMT2B1家系,發現在LMNA第5號外顯子有一C892T的純合性突變,其引起R298C,被認為是來自三個家系CMT2B1的致病建立者突變。對純合性缺失LMNA的小鼠進行觀察,發現其有與HMSN相似的
運動障礙和脊柱側凸,神經病理學發現坐骨神經軸突密度下降,直徑增加,存在一些無髓鞘的軸突,而在雜合子的小鼠中則沒有這些變化[20]。結合LMNA定位於連鎖不平衡區、在神經生長中的表達模式及其與中間絲(IF)多基因家族之間的關係,認為LMNA是CMT2B1的致病基因,他們之間的關係有待進一步明確[20]。
2.2CMT2B2
CMT2B2主要特徵是上肢遠端的肌肉無力,踝部對稱性的趾伸、屈肌無力,踝反射減弱或消失,成對稱性的末端感覺障礙。運動神經傳導速度減慢,感覺神經傳導速度減慢不明顯[21]。
Alejadro等[21]將其疾病基因定位於19q13.3 。上皮膜蛋白3 (EMP3)基因也位於19q13.3,其主要編碼與PMP22同源的蛋白,基於PMP22與周圍多發性神經病的關係,EMP3基因曾被認為是CMT2B2的候選基因,但通過對EMP3基因進行測序和PCR擴增,排除了EMP3是CMT2B2的致病基因。CMT4F也被定位於19q13.1-13.3,通過分析其基因座和表型發現其與CMT2B2並無關係,尚無CMT2B2合適的候選基因[21]。
結語
綜上所述,常染色體隱性遺傳的CMT是一組明顯臨床和
遺傳異質性的疾病。雖然已定位了一些疾病位點,並克隆了一些疾病基因,但是毫無疑問,在此基礎上,進一步多採集一些家系,發現一些新的致病基因,對揭示CMT的分子遺傳學機制具重要作用,並最終為此病的基因診斷和治療奠定基礎。
應該做的檢查
腓骨肌萎縮症應該做哪些檢查?
本病的輔助檢查方法主要是神經電生理檢查
神經傳導速度的檢測對該病的診斷有很大的幫助對分型則必不可少常選大小魚際肌脛前肌腓腸肌進行肌肉安靜狀態下有無矢神經電位小力收縮時運動單位電位的時限波幅大力收縮時的電位位相及峰值電位檢測用表面電極檢測運動神經傳導速度(motor nerve con2duction velocity,mcv) 及感覺神經傳導速度( sensory nerve con2duction velocity, ncv)常檢測正中神經和尺神經的mcv 及scv脛神經和腓總神經的mcv腓腸神經的scv肌電圖神經傳導速度正常值參照湯曉芙標準大多數患者可表現為均勻一致的減慢而無傳導阻滯構成遺傳性脫髓鞘神經病的特徵性表現
臨床表現
本病主要分為兩型
I型脫髓鞘型
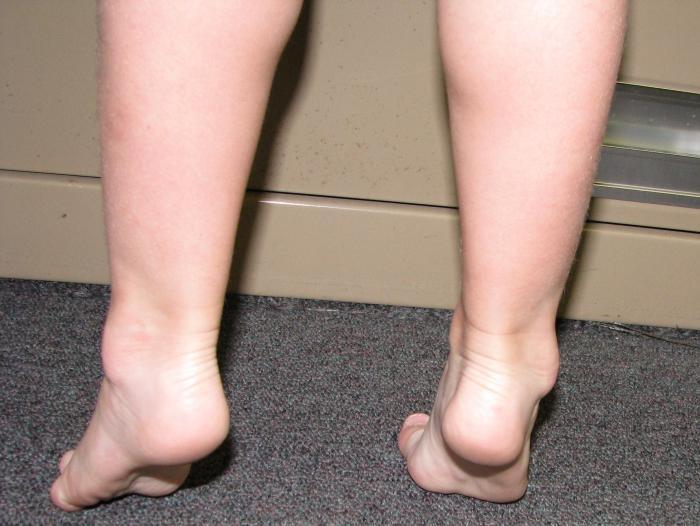
是典型的腓骨肌萎縮症雙下肢呈倒立酒瓶狀或稱鶴立腿同時出現足弓高聳爪形趾馬蹄內翻畸形等行走時表現特殊的跨越步態表現肌無力肌萎縮肌束顫腱反射減退或消失首發於手部肌前臂肌萎縮而後下肢遠端肌萎縮者僅見於少數病例四肢末梢可出現手套狀襪狀深淺感覺障礙和一系列植物神經與營養代謝障礙局部皮膚呈青紫色皮膚溫度低潰瘍形成等
II型軸突型
發病晚成年開始有肌萎縮部位和症狀與I型相似但程度較I型為輕臨床上按症狀組合有多種變異型如肩胛腓骨肌萎縮型視神經萎縮型
弗里德賴希共濟失調若伴有腓骨肌萎縮則稱腓骨肌萎縮型共濟失調即Roussy-Levy綜合徵
診斷
1CMT 1脫髓鞘型
①在10歲以內發病慢性進展性病程嚴重程度不同;周圍神經對稱性進行性變性導致肢體遠端肌無力和肌萎縮自足和下肢開始CX出現內翻馬蹄足和爪形足畸形數月至數年波及手肌和前臂肌伴遊或不伴感覺缺失;常伴脊柱側彎垂足呈跨閾步態;病程緩慢病程長時期穩定;部分病人雖有基因突變但不出現肌無力和肌萎縮僅有弓形足或神經傳導速度減慢甚至無臨床症狀;
②檢查可見小腿和大腿下1/3肌萎縮形似“鶴腿”或倒立的香檳酒瓶狀手肌萎縮變成爪形設可波及前臂肌受累肢體腱反射減低或消失;深淺感覺減退呈手套襪子樣分布伴自主
神經功能障礙和營養障礙約50%的病例可觸及神經變粗腦神經通常不受累;
③運動NCV減慢為38m/s以下(正常50m/s);CSF蛋白正常或輕度增高;肌活檢可見神經源性肌萎縮神經活檢顯示周圍神經脫髓鞘和Schwann細胞增生形成“洋蔥頭”樣結構
2CMT 2軸索型
①發病晚成年開始出現肌萎縮症狀及出現部位與CMT 1型相似程度較輕;
②運動NCV正常或接近正常CSF蛋白正常或輕度增高神經活檢主要為軸突變性
腓骨肌萎縮症的治療
本病尚未無特殊有效治療,主要是對症和支持療法,垂足和足畸形可穿著矯鞋,由於病程進展緩慢,大多數患者可存活數十年,對證治療可提高患者生活質量。
治療原則
現如今臨床對CMT尚無有效治療手段,對患者主要是採取一些對症和支持療法,如畸形足可穿矯形鞋,指導CMT患者進行康復訓練也可改善患者的生活質量。
康復治療:康復治療在腓骨肌萎縮症疾病管理中占主導地位,以改善行走能力和生活質量為基本目標,包括力量訓練和拉伸訓練以維持肌力、防止肌萎縮,以及適當的輔具(矯形器)以鼓勵患者活動並提高安全性,同時囑咐患者控制體重,避免肥胖增加運動負擔。運動鍛鍊是康復治療的重要環節,包括耐力訓練、力量訓練和拉伸訓練,以維持肌力、提高有氧運動能力、改進體能、保持運動幅度、避免關節攣縮為目標,其中,耐力訓練和力量訓練以近端未受累肌肉為主,如膝關節伸曲、髖關節伸展和外展等,以增加行走過程中對遠端肌無力的代償、改善運動功能。
外科矯形手術:腓骨肌萎縮症患者足部畸形是逐步進展的過程,兒童期和青春期患兒表現為柔性高弓內翻足畸形,隨著年齡增長進展為固定畸形。早期以穿戴矯形鞋聯合物理治療為主,儘量避免外科手術;而對於足踝畸形致功能障礙嚴重患者,可早期予外科手術;已形成固定畸形或畸形嚴重患者應採取積極的外科手術治療。手術治療原則是糾正足部畸形,重建和平衡足踝肌力。