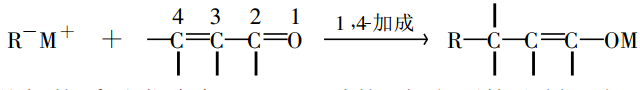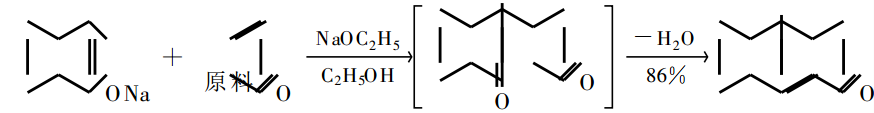反應介紹
麥可反應是以美國化學家 A.Michael(1853—1942)的名字命名的,整個反應由兩部分構成,一是碳負離子親核試劑,一是帶有吸電子活化基Z的不飽和
共軛體系。前者對後者進行共軛親核加成直接生成C—C鍵 。
例如下式 :
上述的不飽和共軛體系通常稱為 Michael受體,它由不飽和鍵及與不飽和鍵相連的不飽和活化基Z組成。典型CHO 、COR、COOH、COOR、 CONR2、CN 、NO2 、SOR、SO2R 等等。這些基團能夠活化親核試劑對烯或炔的共軛加成,其活化能力的相對大小基本上和它們穩定碳負離子的能力一致,如 NO2 >COR >CO2R >CN >CONR2。
碳負離子
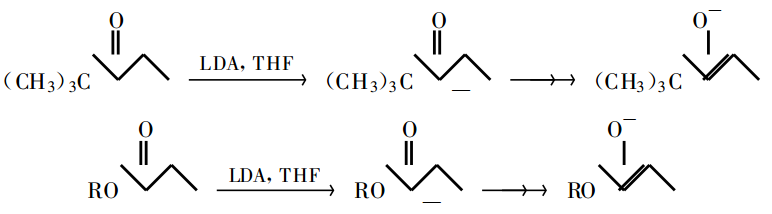
在 Michael 反應中,碳負離子通常是指那些具有雜原子π共軛穩定的碳負離子。它的產生通常用鹼催化來實現。用的催化劑有烷氧化物(如醇鈉)、鹼性胺(如叔胺)、金屬氫化物(如 NaH)和胺基鋰(如二異丙胺鋰 LDA)等。只含有一個羰基 、酯基或氰基的化合物,其活潑亞甲基的酸性不夠強,需要較強的鹼才能使其產生碳負離子或烯醇負離子。如下圖:
被一個硝基或兩個羰基 、酯基 、氰基等活化的亞甲基其酸性較強(通常比一般的脂肪醇的酸性 強),用金屬烷氧化物 、金屬氫氧化物或胺處理就可生成烯醇負離子。
反應機理
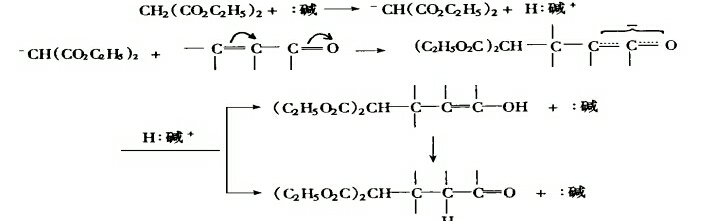
以丙二酸酯和 α,β-不飽和羰基化合物的加成為例:
這一鹼催化的Michael反應的結果是不飽和共軛體系的C —Cπ鍵被打破,在產物中形成了新的C—Cσ鍵。
競爭反應
與Michael加成相競爭的加成是1,2-加成,通過選擇適當的實驗條件和反應物可以使 1,2-加成的競爭趨於最小 。下列因素有利於 Michael 加成:
① 增大碳負離子和羰基周圍的立體阻礙;
② 使用極性溶劑如 HMPA ;
③ 更穩定的碳負離子 ;
④ 較高的溫 度 ;
⑤ 較長的反應時間。
在反應中,1,2-加成產物為動力學控制產物,上述因素均能促使形成的1,2-加成產物和初始原料達成平衡,最終轉化為更穩定的共軛加成產物 。
有機套用
Michael反應最直接的套用就是增長碳鏈,合成含有多個官能團的化合物,這些化合物均具有進一步反應的能力,生成各種類型的有機化合物。
α、β-不飽和醛、酮是最有效和最有用的 Michael 受體,由
羰基穩定的碳負離子(烯醇負離子)與之共軛加成生成 1,5-二羰基化合物,後者在鹼性條件下發生分子內羥醛縮合反應,失水生成 α、β-不飽和環酮。這一過程稱為 Robinson 成環反應:
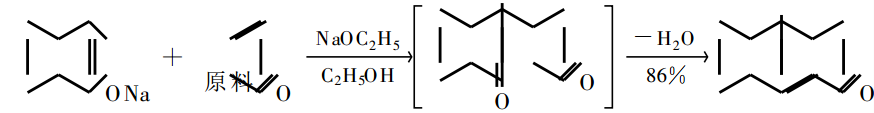
這是製取帶有一個角甲基的氫化萘酮(天然甾族分子的部分結構)的首選方法,通過選擇適當的溶劑可以獲得高立體選擇性的產物 。
Robinson成環反應的操作通常是將 α、β-不飽和酮慢慢加到活潑亞甲基化合物和催化量的 冷的乙醇鈉溶液中,形成的加成產物緊接著發生羥醛縮合 。酯或醯胺作為碳負離子源與 α、β- 不飽和醛 、酮的 Michael反應產生 γ-酮酸酯或 γ-酮醯胺。