專利背景
鹽酸安妥沙星是具有以下結構式的抗菌藥:
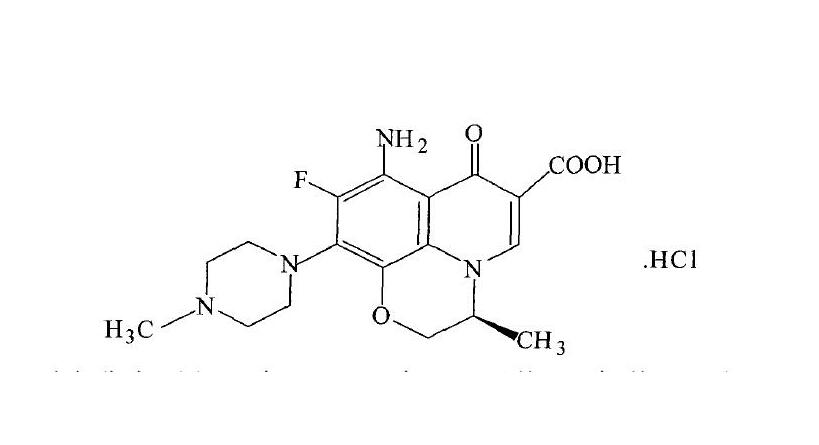
其化學名稱為:(S)-9-氟-2,3-二氫-3-甲基-8-氨基-10-(4-甲基-1-哌嗪基)-7-氧代-7H-吡啶並苯並噁嗪-6-羧酸鹽酸鹽,這是一種高度有效的抗感染藥物。根據CN1055927C專利公開的製備方法,其縮哌反應收率僅為55%,存在原料浪費較多,生產成本較高的缺點,同時其純度達不到鹽酸安妥沙星原料質量標準的要求。
發明內容
專利目的
《高純鹽酸安妥沙星的製備方法》所要解決的技術問題是提供一種高純鹽酸安妥沙星的製備方法。
技術方案
《高純鹽酸安妥沙星的製備方法》公開了一種製備高純鹽酸安妥沙星的生產工藝方法,其技術方案為:
(1)安妥沙星的製備:①將來源豐富的(S)-9,10-二氟-2,3-二氫-3-甲基-8-氨基-7-氧代-7H-吡啶並苯並噁嗪-6-羧酸(簡稱氨基左氧羧酸物)、N-甲基哌嗪和吡啶按照重量比1:1.5-2.5:15-25置於搪瓷夾套反應釜中,特別優選重量比為1:1.92:20;②攪拌溶解後蒸汽加熱至回流,加熱溫度110-120℃反應8-12小時,特別優選加熱溫度115℃±2℃反應10小時;③減壓蒸出吡啶,殘餘物按氨基左氧羧酸物與乙醇重量比1:4.21投入乙醇,過濾,濾餅用乙醇洗滌,在60-100℃進行常壓乾燥或真空乾燥8小時得安妥沙星粗品,該反應收率在80%左右。
(2)高純鹽酸安妥沙星的製備:
①將上述所得的安妥沙星粗品和水按重量比1:25-35的比例投入搪瓷夾套反應釜中,攪拌下緩慢加入鹽酸使溶液的pH值為4.0~4.5,並保持30分鐘;②用精密微孔濾膜過濾,置潔淨反應釜中,緩緩滴加氨水溶液調節pH值為7.0~7.5,並保持30分鐘;③抽濾,按濾餅濕重3倍加水至結晶反應釜中,攪拌下加入濾餅,滴加鹽酸調節pH至4.0~4.5,保持30分鐘;④趁熱用精密濾器過濾,濾液壓入潔淨區內的結晶釜中,蒸餾出約2/3的水分。⑤通入冷卻水進行冷卻,至常溫析出結晶後離心過濾;⑥濾餅在60-100℃進行常壓乾燥或真空乾燥8小時,將乾燥後的鹽酸安妥沙星在粉碎機中粉碎,將粉碎後的產品置於多維混合機內混合均一,即得鹽酸安妥沙星精品,該步反應收率約為75%。
改善效果
按照《高純鹽酸安妥沙星的製備方法》提供的製備方法製備高純鹽酸安妥沙星,具有原料浪費少、生產成本較低的優點,同時製備的高純鹽酸安妥沙星的純度能達到鹽酸安妥沙星原料質量標準的要求。
技術領域
《高純鹽酸安妥沙星的製備方法》涉及高純鹽酸安妥沙星的製備方法。
權利要求
1.鹽酸安妥沙星的製備方法,包括以下工藝步驟:
(1)安妥沙星的製備:①將(S)-9,10-二氟-2,3-二氫-3-甲基-8-氨基-7-氧代-7H-吡啶並苯並噁嗪-6-羧酸、N-甲基哌嗪和吡啶按照重量比1:1.5-2.5:15-25置於搪瓷夾套反應釜中;②攪拌溶解後蒸汽加熱至回流,加熱溫度110-120℃,反應8-12小時;③減壓蒸出吡啶,殘餘物按(S)-9,10-二氟-2,3-二氫-3-甲基-8-氨基-7-氧代-7H-吡啶並苯並噁嗪-6-羧酸與乙醇重量比1:4.21投入乙醇,過濾,濾餅用乙醇洗滌,在60-100℃進行常壓乾燥或真空乾燥8小時得安妥沙星粗品;
(2)鹽酸安妥沙星的製備:①將上述所得的安妥沙星粗品和水按重量比1:25-35的比例投入搪瓷夾套反應釜中,攪拌下緩慢加入鹽酸使溶液的pH值為4.0~4.5,並保持30分鐘;②用精密微孔濾膜過濾,置潔淨反應釜中,緩緩滴加氨水溶液調節pH值為7.0~7.5,並保持30分鐘;③抽濾,按濾餅濕重3倍加水至結晶反應釜中,攪拌下加入濾餅,滴加鹽酸調節pH至4.0~4.5,保持30分鐘;④趁熱用精密濾器過濾,濾液壓入潔淨區內的結晶釜中,蒸餾出約2/3的水分;⑤通入冷卻水進行冷卻,至常溫析出結晶後離心過濾;⑥濾餅在60-100℃進行常壓乾燥或真空乾燥8小時,將乾燥後的鹽酸安妥沙星在粉碎機中粉碎,將粉碎後的產品置於多維混合機內混合均一,即得鹽酸安妥沙星。
2.根據權利要求1所述的鹽酸安妥沙星的製備方法,其特徵在於:所述步驟(1)的反應收率為70-90%,所述步驟(2)的反應收率為70-80%。
3.根據權利要求1所述的鹽酸安妥沙星的製備方法,其特徵在於:所述步驟(1)中(S)-9,10-二氟-2,3-二氫-3-甲基-8-氨基-7-氧代-7H-吡啶並苯並噁嗪-6-羧酸、N-甲基哌嗪和吡啶的重量比為1:1.92:20。
4.根據權利要求1所述的鹽酸安妥沙星的製備方法,其特徵在於:所述步驟(1)中的加熱溫度為113-117℃,反應時間為10小時。
實施方式
將(S)-9,10-二氟-2,3-二氫-3-甲基-8-氨基-7-氧代-71H-吡啶並苯並噁嗪-6-羧酸(簡稱氨基左氧羧酸物)、N-甲基哌嗪和吡啶按照重量比2.56千克:4.9千克:52千克投料,攪拌溶解後蒸汽加熱至回流,加熱溫度115℃±2℃反應10小時,減壓蒸出吡啶,殘餘物投入乙醇10.8千克,過濾,濾餅用乙醇洗滌,在60-100℃進行常壓乾燥或真空乾燥8小時得安妥沙星粗品。將上述所得的安妥沙星粗品和水按重量比2.68千克:80千克的比例投入搪瓷夾套反應釜中,攪拌下緩慢加入鹽酸使溶液的pH值為4.0~4.5,並保持30分鐘,用精密微孔濾膜過濾,置潔淨反應釜中,緩緩滴加氨水溶液調節pH值為7.0~7.5,並保持30分鐘,抽濾,按濾餅濕重3倍加水至結晶反應釜中,攪拌下加入濾餅,滴加鹽酸調節pH至4.0~4.5,保持30分鐘,趁熱用精密濾器過濾,濾液壓入潔淨區內的結晶釜中,蒸餾出約2/3的水分,通入冷卻水進行冷卻,至常溫析出結晶後離心過濾,濾餅在60-100℃進行常壓乾燥或真空乾燥8小時,將乾燥後的鹽酸安妥沙星在粉碎機中粉碎,將粉碎後的產品置於多維混合機內混合均一,即得高純鹽酸安妥沙星精品。
經上述反應得到的鹽酸安妥沙星的質量標準可達到國家食品藥品監督管理局YBH0452009質量標準的要求。質量標準如下:
該產品為(S)-(-)-9-氟-2,3-二氫-3-甲基-8-氨基-10-(4-甲基-1-哌嗪基)-7-氧代-7H-吡啶並-苯並噁嗪-6-羧酸鹽酸鹽。按乾燥品計算,含C18H21FN4O4不得少於89.3%。
該產品為亮黃色結晶性粉末;無臭、味苦。
比旋度取該產品,精密稱定,加水溶解並定量稀釋製成每1毫升中含20毫克的溶液,依法測定(中國藥典2005年版二部附錄VIE),比旋度應為-44°至-51°。
(1)取該產品,加0.1摩爾/升鹽酸溶液製成每1毫升中含6微克的溶液,照紫外-可見分光光度法(中國藥典2005年版二部附錄IVA)測定,在227納米,297納米的波長處有最大吸收。
(2)在含量測定項下記錄的色譜圖中,供試品主峰的保留時間與對照品主峰的保留時間一致。
(3)該產品的紅外光吸收圖譜應與對照品的圖譜一致。
(4)該產品的水溶液顯氯化物的鑑別反應(中國藥典2005年版二部附錄III)。 酸度取該產品0.1克,加水20毫升溶解後,依法測定(中國藥典2005年版二部附錄VIH),pH值應為3.5~5.0。
溶液的澄清度取該產品5份,分別加水製成每1毫升中含安妥沙星5毫克的溶液,溶液應澄清,如顯渾濁,與2號濁度標準液(中國藥典2005年版二部附錄IXB)比較,不得更濃。 有關物質照高效液相色譜法(中國藥典2005年版二部附錄VD)測定色譜條件與系統適用性試驗均照含量測定項下的方法試驗測定法取該產品適量,加流動相製成每1毫升中含1毫克的溶液,作為供試品溶液;量取適量,加流動相稀釋成每1毫升中含0.01毫克的溶液,作為對照品溶液。取對照品溶液10微升注入液相色譜儀,調節靈敏度,使主成分峰的峰高為滿量程的30%;再取供試品溶液10微升注入液相色譜儀,記錄色譜圖至主成分峰保留時間的2倍。供試品溶液的色譜圖中如顯示雜質峰,最大雜質峰面積不得大於對照品溶液色譜圖主峰面積1/10(0.1%),供試品溶液色譜圖上各雜質峰面積的和不得大於對照品溶液色譜圖主峰面積1/2(0.5%)。
右旋異構體照高效液相色譜法(中國藥典2005年版二部附錄VD)測定色譜條件與系統適用性試驗用十八烷基矽烷鍵合矽膠為填充劑;以含硫酸銅和L-異亮氨酸的水溶液(取1.25克
硫酸銅和2.62克
L-異亮氨酸溶於1000毫升水中)-甲醇(80:20)為流動相;流速為每分鐘1.0毫升;檢測波長為297納米。同時精密稱取鹽酸安妥沙星對照品和其右旋異構體用流動相溶解稀釋為每1毫升含上述兩種物質各0.5毫克的混合溶液,進樣測試,出峰順序為鹽酸安妥沙星,右旋異構體;鹽酸安妥沙星峰與其右旋異構體峰的分離度應符合規定。
測定法取該產品鹽酸安妥沙星約50毫克,精密稱定,置25毫升量瓶中,用流動相稀釋至刻度,搖勻,作為供試品溶液;量取適量,加流動相稀釋成每1毫升中含0.002毫克的溶液,作為對照品溶液。取對照品溶液10微升注入液相色譜儀,調節靈敏度,使主成分峰的峰高為滿量程的30%;再取供試品溶液10微升注入液相色譜儀,記錄色譜圖。供試品溶液的色譜圖中如顯示右旋異構體峰,峰面積不得大於對照品溶液色譜圖主峰面積1/10(0.1%)。
乙醇照氣相色譜法(中國藥典2005年版二部附錄VE),採用頂空進樣測定乙醇含量。
色譜條件與系統適用性採用SPB-1毛細管柱(或與之相當的柱),柱溫:50℃,氫火焰離子化檢測器,檢測器溫度:250℃,進樣口溫度:200℃,頂空瓶溫度:100℃,頂空時間:20分鐘,進樣針溫度:105℃。
進樣條件壓力:13psi,時間:0.2分鐘,載氣:氮氣,流速:1.5毫升/分鐘。出峰順序為:乙醇、
丙酮,兩峰間的分離度應符合規定。
內標溶液:取丙酮適量,加水製成每1毫升含0.05毫克的溶液。
測定法取乙醇適量,用內標溶液溶解並稀釋成每1毫升含0.1毫克的溶液,精密量取該溶液5.0毫升至頂空瓶中,密封瓶口,作為對照品溶液。另精密稱取供試品100毫克,置20毫升頂空瓶中,精密量取內標溶液5.0毫升使其溶解,密封瓶口。分別進樣,記錄峰面積,按內標法計算,含乙醇不得過0.5%。
吡啶照高效液相色譜法(中國藥典2005年版二部附錄VD)測定色譜條件與系統適用性試驗用十八烷基矽烷鍵合矽膠為填充劑;以乙腈-0.25摩爾/升磷酸二氫銨溶液(取磷酸二氫銨57.515克,用水溶解並稀釋至2000毫升)-水(300:100:600)用氨溶液調節pH值至7.0為流動相;流速為每分鐘1.0毫升;檢測波長為254納米。取吡啶對照溶液20微升注入液相色譜儀,理論板數應不低於3000。
吡啶對照溶液的製備精密稱取吡啶約1克,置100毫升量瓶中,加水溶解並稀釋至刻度,精密量取10毫升,置另一100毫升量瓶中,加水溶解至刻度,於15℃以下貯存。臨用前精密量取2毫升,置200毫升量瓶中,加pH7.0磷酸鹽緩衝液(稱取無水磷酸氫二鈉5.68克、磷酸二氫鉀3.63克,加水溶解並稀釋至1000毫升)稀釋至刻度,作為對照溶液。
測定法精密稱取該產品約660毫克,置100毫升量瓶中,加上述pH7.0磷酸鹽緩衝液溶解並稀釋至刻度(於15℃以下貯存,1小時內進樣完畢),搖勻,取20微升注入液相色譜儀,記錄色譜圖;另取吡啶對照溶液同法測定。按外標法計算,含吡啶不得過0.1%。
乾燥失重取該產品,在105℃乾燥至恆重,減失重量不得過0.5%(中國藥典2005年版二部附錄VIIIL)。
熾灼殘渣取該產品1.0克,置鉑坩堝中,依法檢查(中國藥典2005年版二部附錄VIIIN),遺留殘渣不得過0.2%。
重金屬取熾灼殘渣項下遺留的殘渣,依法檢查(中國藥典2005年版二部附錄VIIIH第二法),含重金屬不得過百萬分之二十(供口服用);含重金屬不得過百萬分之十(供注射用)。
細菌內毒素取該產品適量,依法檢查(中國藥典2005年版二部附錄XIE),每1毫克中含細菌內毒素的量應小於1.5EU(供注射用)。
照高效液相色譜法(中國藥典2005年版二部附錄VD)測定色譜條件與系統適用性試驗用十八烷基矽烷鍵合矽膠為填充劑;以0.05摩爾/升的磷酸二氫鉀溶液(含0.005摩爾/升己烷磺酸鈉和0.007%EDTA二鈉,用磷酸調pH2.4±0.1)-乙腈(84∶16)為流動相;流速為每分鐘1.0毫升;檢測波長為297納米。同時精密稱取安妥沙星對照品和氧氟沙星對照品用流動相溶解稀釋為每1毫升含上述兩種物質各0.2毫克的混合溶液,進樣測試,氧氟沙星峰與安妥沙星峰的分離度應不小於2.0。
測定法取該產品鹽酸安妥沙星對照品約50毫克,精密稱定,置50毫升量瓶中,用流動相稀釋至刻度,搖勻,精密量取該溶液2毫升,置10毫升量瓶中,用流動相稀釋至刻度,搖勻,取10微升注入液相色譜儀,記錄色譜圖;另取該產品適量,同法測定。按外標法以峰面積計算,即得。
榮譽表彰
2020年7月17日,《高純鹽酸安妥沙星的製備方法》獲得安徽省第七屆專利獎銀獎。


