高氯酸(HClO4)在水溶液中完全電離得到高氯酸根(ClO4-),其中氯元素的價態為+7,是氯的最高價態。
基本介紹
- 中文名:高氯酸根
- 別稱:過氯酸根
- 化學式:ClO4-
基本介紹,結構,常見疑惑,
基本介紹
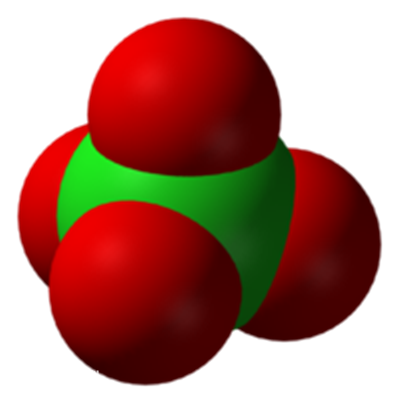
高氯酸根 ClO4-
在高氯酸根中,氯元素呈現+7價,按照化學價的意義,氯原子對電子有很強的吸引能力,即很容易得電子,因此具有氧化性。
HClO 次氯酸
HClO2 亞氯酸
HClO3 氯酸
HClO4 高氯酸 六大無機強酸之一
在氯的含氧酸根中氧化性最弱
結構
中心Cl發生sp3雜化,形成4個sp3雜化軌道,7個電子,其中3對填充在3個雜化軌道上(記為雜化軌道A),最後1個雜化軌道只有一個電子(記為雜化軌道B)。4個O中,一個連線了H原子,這個O還剩1個2p軌道,這個軌道與Cl的雜化軌道B重疊,形成一個共價單鍵。剩下的3個O,發生電子重排,6個電子挪到3個軌道上,空出1個2p軌道,然後與Cl的雜化軌道A形成3個配位鍵。
也就是說,HClO4分子結構如下,箭頭表示配位鍵。

除此以外,還有氧原子的孤對電子與氯原子的空d軌道形成的d-pπ鍵。
常見疑惑
高氯酸根比次氯酸根的氧化性弱
按照一般規律,同種元素,處於高價態的氧化性高於處於低價態的。
但是高氯酸根是標準的正四面體結構,正四面體結構是一個較為穩定的結構,本身不易分解,難以得到氧自由基。而且Cl處於正四面體的中心,被四個O包圍,不易反應,難以體現出氧化性。
所以高氯酸根比次氯酸根的氧化性弱。