基本介紹
- 中文名:電子成對能
- 外文名:electron pairing energy
- 產生原因:自旋相反到同一軌道克服靜電排斥
定義,多電子體系,電子排布,電子配對,
定義
當一個軌道中已有一個電子時,若在該軌道填入相反的電子與之成對,而必須克服的電子與電子之間的靜電排斥作用能稱為電子成對能,記為Epair或Ep。
顯然,電子成對能不僅與原子、分子的類型有關,還取決於其軌道的空間分布形狀,依賴於庫侖積分與交換積分K(θ)。
鑒於Ep>0,故為了使多電子體系的能量降低,對於具有相同能量的軌道而言,電子傾向於以自旋平行的方式占據儘可能多的等價軌道,這就是洪特規則。由此可見,洪特規則並不是一個獨立的原理,它是保里不相容原理與能量最低原理在L-S偶合情況下的定量表示。
多電子體系
由玻爾的理論發展而來的現代量子物理學認為原子核外電子的可能狀態是不連續的,因此各狀態對應能量也是不連續的。這些能量值就是能級。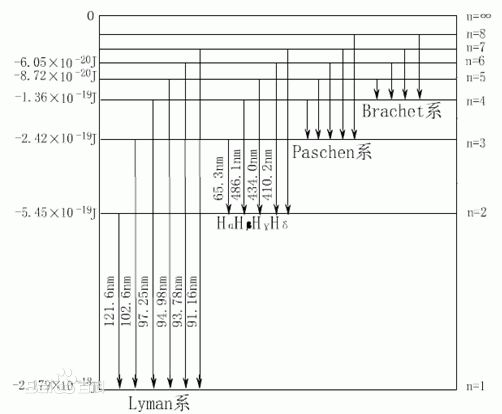 能級
能級
 能級
能級對於多電子原子與分子來說,其能級的計算是一個非常困難的工作。由於無法精確求解,故只能藉助各種近似方法。例如,在中心場近似下,多電子原子中電子的能級可以粗略地用斯萊特歸納出的一套禁止常數σ=σ(n,l)進行估算: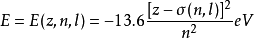 。
。
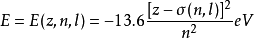
此式說明:多電子原子中電子的能級不僅依賴於原子的種類核電荷z,而且對同一種原子而言還與其主量子數n,角量子數l有關。但是,卻與其磁量子數m及自旋量子數ms無關,故具有相同能量的nl亞層含有2l+1個軌道-2(2l+1)個自旋軌道。
因此,當電子處在不同的軌道上時,其能量差將與z、n1、l1及有n2、l2有關。
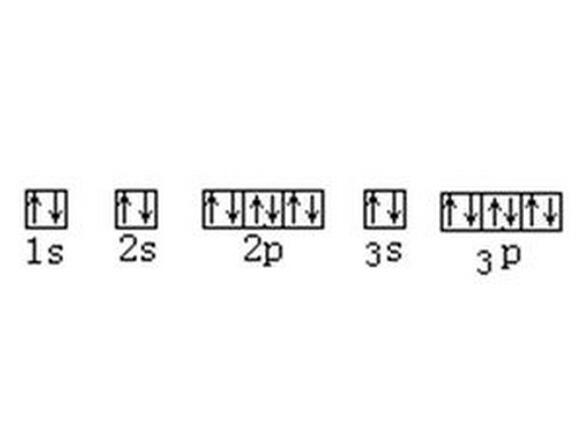
電子排布
無論在原子領域還是在分子領域,保里不相容原理與能量最低原理都是電子排布遵循的兩條基本原理,並且在排布時都應考慮電子成對能。 電子在原子軌道與分子軌道上的排布
電子在原子軌道與分子軌道上的排布
 電子在原子軌道與分子軌道上的排布
電子在原子軌道與分子軌道上的排布假設所討論的體系含有5個電子,能量最低的軌道有a、b、c、d、e5個,其能量為Ea、Eb、Ec、Ed、Ee。
若其最大的能量差EΔmax=Ee-Ea小於電子成對能Ep,則根據能量最低原理與保里不相容原理電子將以自旋平行的方式分別占據此5個軌道,如圖1所示。自由金屬離子Fe3+的電子在3d軌道上的排布情況就是這樣。在弱的配位場中的情況也與此類似,從而形成具有很強磁性的高自旋配合物[FeF6]3-。
如果Ep<EΔmax,則電子將以自旋配對的形式占據較少的空間軌道,如圖2、圖3所示。
電子配對
電子永遠是互相排斥的,自旋相反的電子也絕不會彼此吸引。電子成對能Ep就是由於電子間距離減小而引起的相互排斥能的增加。
電子云在核間的密集是形成化學鍵的實質,只有自旋相反的電子才能彼此靠攏並在原子核之間形成所需要的電子云密集。這時,雖然因為電子間的靜電排斥使體系的能量增加Ep,但由於它們同時受到2個或多個原子核的吸引使電子與原子核的勢能減少ΔU,且Ep+ΔU<0,故導致體系能量的降低,形成穩定的化學鍵。
由此可見,電子配對絕不意味著自旋相反的電子彼此吸引,分子體系能量降低僅僅是由於其電子與原子核間勢能的減少大於電子成對能Ep。