雙脫氧測序,簡介,原理,簡介,Sanger法的試劑,引物,模板,DNA聚合酶,大腸桿菌DNA聚合酶IKlenow 片段,反轉錄酶,測序酶,Taq DNA聚合酶,放射性標記的dNTP,dNTP類似物,測定戰略,測定方法,M13噬菌體複製型雙鏈DNA的製備,重組噬菌體製備,單鏈噬菌體DNA(模板DNA)的製備,引物製備,微量滴板,變性聚丙烯醯胺凝膠,電泳後將凝膠乾燥,放射自顯影,凝膠上讀取DNA序列,
雙脫氧測序
簡介
整個過程利用了DNA聚合酶的兩個性質:(1)它能合成單鏈DNA模板的互補拷貝;(2)它能以2′,3′-雙脫氧核苷三磷酸酯為底物。一旦當這一類似物被結合,其3′-端因缺少羥基而不再是鏈伸長所需的底物,從而使伸長中的DNA鏈終止。在實際操作中,使用DNA聚合酶I的克倫諾片段(Klenow fragment),它缺乏完整酶的5′,3′-核酸外切酶的活性。DNA的合成是在有四個脫氧核苷三磷酸酯的存在下進行,其中有一個或幾個用32p作了標記,四個反應混合物中的每一個都含有一個雙脫氧物。當反應結束時,最終反應混合物的每一個反應物中都有一系列新DNA的片段,都有一個相同的5′-端,但長度各不相同,並以鹼基-特定3′-端為終止。這些混合物可用電泳法分離,用放射自顯影術(射線顯跡法)使之可視化,並讀出序列。
1980年
桑格因設計出這種測定DNA(脫氧核糖核酸)核心苷酸排列順序的方法而與W·吉爾伯特、P·伯格共獲1980年諾貝爾化學獎。
原理
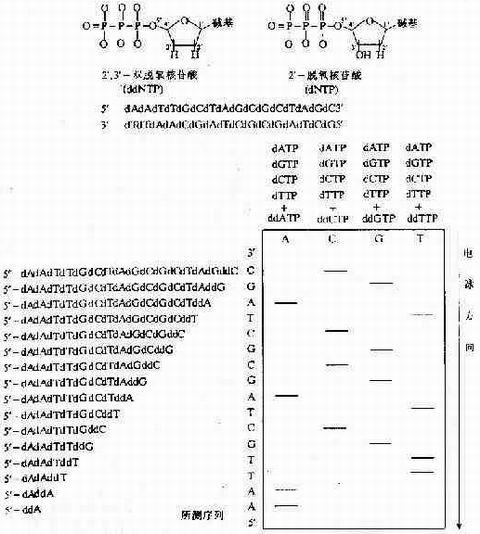
通常DNA的複製需要:DNA聚合酶,單鏈DNA模板,帶有3'-OH末端的單鏈寡核苷酸引物,4種dNTP(dATP、dGTP、dTTP和dCTP)。聚合酶用模板作指導,不斷地將dNTP加到引物的3'-OH末端,使引物延伸,合成出新的互補DNA鏈。如果加入一種特殊核苷酸,雙 脫氧核苷三磷酸(ddNTP),因為它與普通dNTP不同,在脫氧核糖的3’位置缺少一個羥基,故不能同後續的dNTP形成磷酸二酯鍵。例如,存在ddCTP、dCTP和三種其他的dNTP(其中一種為α-32P標記)的情況下,將引物、模板和DNA聚合酶一起保溫,即可形成一種全部具有相同的5'-引物端和以ddC殘基為3’端結尾的一系列長短不一片段的混合物。經變性聚丙烯醯胺凝膠電泳分離製得的放射性自顯影區帶圖譜將為新合成的不同長度的DNA鏈中C的分布提供準確信息,從而將全部C的位置確定下來。採用類似的方法,在ddATP、ddGTP和ddTTP存在的條件下,可同時製得分別以ddA、ddG和ddT殘基為3'端結尾的三組長短不一的片段。將製得的四組混合物全部平行地點加在變性聚丙烯酸受凝膠電泳板上進行電泳,每組製品中的各個組分將按其鏈長的不同得到分離,從而製得相應的放射性自顯影圖譜。從所得圖譜即可直接讀得DNA的鹼基序列。
簡介
現行的邏終止法人加減法序列測定技術(Sacger和Coulson,1975)發展而來的。加減法首次引入了使用特異引物在DNA聚合酶作用下進行延伸反應、鹼基特異性的鏈終止,以及採用聚丙烯醯胺凝膠區分長度差一個核苷酸的單鏈DAN等3種方法。儘管有了這些進展,但加減法仍然太不精確,也太不得法,因此難以廣為接受。直至引入雙氧核苷三磷酸(ddTBP)作為鏈終止劑(Sanger等,1977 ),酶法DNA序列測定技術才得到廣泛套用。2',3'ddNTP與普通dNTP不同之處在同它們在脫氧核糖的3' 位置缺少一個羥基。它們可以在DNA聚合酶作用下通過其5' 三磷酸基團摻入到正在增長的DNA鏈中,但由於沒有3'羥基,它們不能同後續的dNTP形成磷酸二酯鏈,因此,正在增長的DNA鏈不可能繼續延伸。這樣,在DNA合成反應混合物的4種普通dNTP中加入少量的一種ddNTP後, 鏈延伸將與偶然發生但卻十分特異的鏈終止展開競爭,反應產物是一系列的核苷酸鏈,其長度取決於從用以起始DNA合成的引物末端到出現過早鏈終止的位置之間的距離。在4組獨立的酶反應中分別採用4種不同的ddNTP,結果將產生4組寡核苷酸,它們將分別終止於模板鏈的每一個A、每一個G或每一個T的位置上。
Sanger法的試劑
引物
酶促測序反應中利用一個與模板鏈特定序列互補的合成寡核苷酸作為DNA合成的引物。在許多情況下,可將靶DNA片段克隆於M13噬菌體或噬菌粒載體,以取得單鏈DNA分子作為模板。但也可以採用Sanger 法商定變性雙鏈DNA模板的序列。在以上兩種情況下, 可以採用能與位於靶DNA側翼的載體序列相退火的通用引物,而不必取得與未知DNA序列互補的引物。適M13噬菌體重組克隆的通用測序引物一般長15-29 個核苷酸,並可與緊靠M13mp18噬菌體多克隆位點區的HindⅢ位點成M13mp19 噬菌體多克隆位點區的EcoRI位點的序列互補。這些引物同樣也可用於對克隆於pUC質粒的DNA進行“雙鏈”測序,並可從許多廠商中購置得到。此外,還有若干家公司出售一些引物,這些引物下為了對通過多種限制酶切位點克隆於不同質粒的靶DNA進行測序而設計的。
模板
如上所述,有兩類DNA可以用作Sanger 法測序的模板:純單鏈DNA和經過熱變性或鹼變性的雙鏈DNA。採用通常從重組M13噬菌體顆粒中分離得到的單鏈DNA應中獲得數百個核苷酸的序列。如用變性雙鏈DNA作模板,則較難獲得這一質量的結果,儘管採用雙鏈DNA模板的方法顯然既簡單又方便(Chen和Seeburg,1985)。
然而只是在不久前得到改進以後,這一方法才發展到能夠獲得明確可信結果的水平。其中有兩個因素是至關重要的,這就是模板DNA的質量和所用DNA聚合酶的種類。小量制箅的質粒DNA常常被寡脫氧核糖核苷酸小分子、核糖苷酸及DNA聚合酶的抑制劑所污染,其中前兩種污染物可被用作隨機引物。結果,種種“鬼”帶、強終止現象,以及其他假象往往使測序凝膠含混不清、黯然失色。因此採用小量製備的質粒NDA來測定未知DNA克隆片段的序列,並不可取。然而,這類DNA常可作為對已經通過另一方法測定的序列進行進一步的合適模板。採用CsCl-溴化乙錠梯度平衡離心法來純化質粒DNA,測序的結果會好得多,但卻要耗費大量的人務和物力。模板鏈的每一個A、每一個G或每一個T的位置上。
DNA聚合酶
通常用於雙脫氧法序列測定的有幾種不同的酶,其中包括大腸桿菌DNA聚合酶I的Klenow片段(Sanger等,1977),反轉錄酶(見文獻,如Mieredorf和Prfeffer,1987)經過修飾消除了3'→5'外節酶活性的T7噬菌體DNA聚合酶(Sequenase)和測序酶2.0),Tabor和Richardson,1978]惟及從嗜熱水生菌(T'hermus aquaticus)分離的耐熱DNA聚合物(Taq DNA聚合酶)。這些酶的特性差別懸殊,因而可大大影響通過鏈終止反應所獲得的DNA序列的數量的質量。
 DNA聚合酶
DNA聚合酶大腸桿菌DNA聚合酶IKlenow 片段
這種酶是最初用以建立Sanger法的酶,也是至今仍然廣泛用於DNA序列測定的酶。 通常碰到的兩個問題是:
1)Koenow片段的持續合成能力低,以致一些片段並非由於dd NTP的摻入,而是因為聚合酸人模板上隨機解離而終止合成,因而導致背景增高。由於該酶不能沿模板進行長中距離移動,因此利用該酶進行的標準測序反應所得序列的長度有限。通常,這一反應只能得到大約250-350個核苷酸的序列。 如果分兩步進行反應,所得序列的數目可以翻一番;其中第一步是初始標記步驟,採用低濃度的dNTP,而隨後的第二步是鏈延伸-鏈終止反應,含有ddNTP和高濃度的dNTP(Johoston-Dow等,1987;Stambaugh和Blakesley,1988)。然而即使有了這些改進,用Klenow 酶所測序列的長度通常還是不如持續合成能力較強的測序酶。
2)這種酶對模板中的同聚核苷酸段或其他含牢固二級結構的區域進行複製的效能很低。將聚合反應的溫度提高到55℃,可以緩解但並不能徹底解決這一問題(Gomer和Firtel,1985)。有時可採用一些dNTP類似物[如dITP或7-脫氮dGTP(7-deaza-dGTP)]來獲取模板中可形成穩定二級結構的相應區段的序列信息,但Kleow酶對這些類似物的作用不如測序酶有效,這也許是因為它們使Klenow酶原已較低的持續合成能力進一步降低。
總而言這,可以選用大腸桿菌DNA聚合酶IKlenow片段測定從引物5'位置起250個鹼基以內的一段DNA序列,但不宜用它來測定更長一段DNA序列或者具有二重對稱和(或)同聚核苷酸段的DNA序列。
反轉錄酶
儘管日常測序工作並不廣泛使用反轉錄酶,但有時用這個酶解決一些由於模板DNA中存在A/T或G/C同聚核苷酸區而引起的問題。來自禽類和鼠類反轉錄病毒的反轉錄酶在這一看來要比Klenow酶略勝一籌(Karanthaansis,1982;Graham等,1986
),儘管它們也許還是比測序酶遜色(Cameron-Mills,1988;Revak等1988)。
測序酶
測序酶(SequenaseTM)是一種經過化學修飾的T7噬菌體DNA聚合酶。這酶原來具有很強的3'→5'外切核酸活性,經過修飾後,這一活性大部分均被消除。測序酶2.0版是測序酶的基因工程產品,它完全缺失了3' →5'外切核酸酶活性,極其穩定而經活性要比經化學修飾的測序酶高2倍。測序酶持續合成能力很強,聚合速率很高,對諸如dITP和7-脫氮-dGTP等用於提高分子辨率使測序凝膠某些區段上的壓縮條帶得以分開的核苷酸類似物具有廣泛的耐受性。它是測定長段DNA序列的首選酶。測序酶可以沿模板移動很長的距離,因而一套反應常常就可以測定數百個核苷酸的DNA序列。實際上,測得序列的長度更多是受聚丙烯醯胺凝膠的分辨能力而不是受該聚合酶的特性所制約。為了充分利用測序酶極高的持續合成能力,可採用兩步測序反應。第一步首先採用低濃度的dNTP的較低溫度,以便將合成反應限制在適度之下並確保放射性標記dNTP和較低溫度,以便將合成反應限制在適度之下並確保放射性標記dNTP的有效摻入,這步反應的產物是僅僅延伸了20-30鹼基的引物。 再將第一步反應等分於4組1套的標準反應系統中,每組反應中都含有高濃度的dNTP和一種ddNTP。這樣聚合反應就得以繼續,直至造成鏈終止的核革酸摻入正在增長的鏈中。
Taq DNA聚合酶
Taq DNA聚合酶適用於測定在37 ℃形成大段穩定十級結構的單鏈DNA模板序列。這是因為Taq
DNA聚合酶在70-75℃活性最高,這一溫度下即使GC豐富的模板也無法形成二級結構。按照1nnis 等(1988)介紹的方法使用Taq DNA聚合酶進行測序,在放射自顯影片上得到的測序梯連續數百個鹼基條帶始終清晰如一,表明這種酶的持續合成能力甚佳。模板鏈的每一個A、每一個G或每一個T的位置上。模板鏈的每一個A、每一個G或每一個T的位置上。
放射性標記的dNTP
直至幾年以前,實際上所有DNA測序反應都用[α-32P]dNTP來進行。然而32P發射的強β粒子造成兩個問題。首先由於發生散射,放射自顯影片上的條帶遠比凝膠上的DNA條帶更寬、更為擴散,因此將影響到所讀取的序列(尤其是從放射自顯影片的上部所讀取的序列)的正確性並將制約從單一凝膠上能讀出的核苷酸序列的長度。其次32P的衰變會引起樣品中DNA的輻射分解,因此用32P進行標記的測序反應只能保存一兩天,否則DNA將被嚴重破壞以至測序凝膠上模糊不清、真假莫辨。[35S]dATP的引入(Biggin等,1983)大大緩解了上述兩方面的矛盾。由於35S衰變產生較弱的β粒子,其散射有所減弱,凝膠和放射自顯影片之間在解析度上相差無幾,因此可以從一套反應中確切測定數百核苷酸的DNA序列。此外,35S的低能輻射所引起的樣品分解比較輕微,因此,測序反應可在-20℃保存至1周,而解析度不見下降。這樣,職果聚丙烯醯胺凝膠方面了發生技術故障,只要對測序反應進行重分析即可。
dNTP類似物
二重對稱的DNA區段(特別是GC含量高者)可以形成鏈內二級過程中不能充分變性。因此將引起不規則遷移,使鄰近的DNA條帶壓縮在一起,以致難以讀出序列。這種壓縮現象歸因於DNA二級結構的存在,而且不可能通過改變測序反應中出序列。這種壓縮現象歸因於DNA二級結構地存在,而且不可能通過改變測序反應中所用DNA聚合酶的種類而得到減輕。但是凝膠中的壓縮區段往往可以通過採用諸如dITP(2'-脫氧次黃苷15' -三磷酸)或7-脫氮-dGTP(7-脫氮-2'-脫氧鳥苷-5' -三磷酸)等核苷酸類似物進行分辨。這些類似物與普通鹼基的配對能力較弱,而且是測序酶和Taq DNA聚合酶等DNA聚合酶的合適底物(Gough和Murray,1983;Mixusawa等,1986;Innis等,1988)。但對某些壓縮條帶,7-脫氮-dGTP無濟於事;同樣,dITP也無補於另一壓縮條帶(尤其是得於GC豐富區的縮條帶)的分辨。如果需要採用類似物,首先可試用dOTP,如果壓縮條帶用d ITP或7-脫氮-dGTP都無法分辨, 則轉而測定另一條鏈的DNA序列幾乎總能如願以償。如上所述,兩種形式的測序酶和Taq DNA聚合酶對核苷酸類似物的耐受性優於大腸桿菌DNA聚合酶IKlenow片段。此外,製造廠商聲稱在測定含穩固二結構的模板序列時,測序酶2.0版要優於原來的測序酶。測序酶2.0版持續合成能力強於測序酶,其作用總是一氣呵成,很少半途而廢,因而消除了“鬼”帶。 而且,測序酶2.0版對諸如dITP類核苷酸類惟物的耐受性看來也優於原來的測序酶。
 dNTP類似物
dNTP類似物測定戰略
由於DNA一般都由幾千個單核苷組成。而目前測定DNA序列的最好方法,一次也只能測約600個核苷酸,因此進行DNA順序測定前,需要用不同限制酶消化等測DNA,使其降成小片段,分別克隆到pUC1,18pUCl18,pUC19,M13mp18,M13mp19等載體中,分別測定各小片段的順序,由於不同限制酶產生的片段之間有交錯重疊順序,根據片段間和末端重疊序列,用計算機軟體如Mac Vector TM5.0分析DNA,Assemblylign TM排列出各片段的位置,進而排出DNA的全序列。
測定方法
以M13噬菌體為載體的雙氧鏈終止法的實施步驟為例:
M13噬菌體複製型雙鏈DNA的製備
M13噬菌體複製型雙鏈DNA(RFDNA)的製備。
為了將待測雙鏈DNA進行克隆,必須製備M13mp18或M13 mp19複製型(閉環雙鏈)DNA,從M9培養基中,挑起單個克隆大腸桿菌,JM101到50ml2×YT培養基中,37℃振盪過夜。稀釋1ml培養物到50ml2×YT培養中,於37℃振搖6h,轉移2ml培養物於微量離心管中,12000g,離心5min細菌沉澱保留用於分離複製型RFDNA,上清用於分離噬菌體單鏈DNA。
細菌沉澱用於分離複製型DNA,可以採用標準的鹼解方法或採用天美公司的Wizard Miniperps DNA試劑盒製備。(方法同分離質粒DNA方法)。
重組噬菌體製備
採用多克隆位點上的限制性內加酶切割待測DNA,並採用相同內切酶切割M13噬菌體RFDNA(採用Biol 101gene clean Ⅱ試劑盒分別純化內切酶切割後的DNA片段),然後將待測外源DNA片段與M13複製型載體DNA連線過夜,連線反應物轉染JM101感受態細菌,將連線物10μl與200μl感受態細菌混勻,放置冰上40~50min,再放在42℃水浴2min,然後加入1ml新鮮的靜止相JM101培養物混勻,然後分別以300μl於含有IPIG(200mg/ml)和X-gal200mg/ml的2×YT培養基上,於37℃培養8h即可出現藍色和白色噬斑,白色或稱無菌噬斑,即為陽性重組噬菌體。
單鏈噬菌體DNA(模板DNA)的製備
上述平板的每個白色噬菌斑是由一種重組M13DNA分子轉染細菌後產生的,如果取一個白色噬菌斑進行培養便可得到一種單鏈形式的DNA。為此,挑取一個白色噬菌斑轉接到一個新鮮製備的OD600=0.1的大腸桿菌JM101培養物中,於37℃振搖5h左右,12000g離心10min,上清轉移到另一新微量離心管中用於分離單鏈DNA,按1ml上清液中加入含20%聚乙二醇PEG-6000的2.5m NaCl 200μl沉澱噬菌體,再用飽和酚抽提除去噬菌體蛋白,最後用1/10體積的3m NaAc和乙醇沉澱單鏈DNA,濃度調至0.1~0.5μg/μl,也可採用天美公司的Wizard TM M13DNA純化試劑盒分離純化M13單鏈DNA。
引物製備
可以購買通用引物或實驗室合成15bp~26bp長度的引物,通常以2μg/ml的濃度貯存於-20℃備用。
微量滴板
進行大批量的模板測序時,常在密閉的微量離心管中進行與引物的退火反應,然後在微量滴板中進行鏈延伸-鏈終止反應。
變性聚丙烯醯胺凝膠
測序凝膠裝置的大小形狀均不相同,其主要參數有:①長度通常為40~50cm;②寬度通常為20cm;③厚度通常為0.3~0.4mm;④橫截面形狀為楔形或錐形,即頂部薄,底部厚,或者是將底部凝膠緩衝液的濃度提高;⑤加樣槽;⑥整塊凝膠上的溫度應均一。
電泳後將凝膠乾燥,放射自顯影
如標題
凝膠上讀取DNA序列
此時讀取的是目的DNA的互補鏈3'~5'的序列。

 DNA聚合酶
DNA聚合酶 dNTP類似物
dNTP類似物

 DNA聚合酶
DNA聚合酶 dNTP類似物
dNTP類似物